WikiDer > Нарлапревир
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Арланса |
| Другие имена | SCH 900518 |
| Маршруты администрация | Устно |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Связывание с белками | 86.5–91.4% |
| Метаболизм | Обширный печеночный за счет окисления, восстановления и N-деалкилирование (CYP3A4) |
| Экскреция | Кал (81,1%), моча (3,14%) |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Химические и физические данные | |
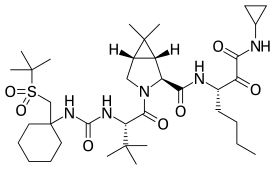
| Формула | C36ЧАС61N5О7S |
| Молярная масса | 707.97 г · моль−1 |
| 3D модель (JSmol) | |
| |
| |
Нарлапревир (торговое наименование Арланса,[1] кодовое название SCH 900518),[2] является ингибитор из NS3/4А сериновая протеаза, предназначенный для лечения хронических гепатит С вызванный вирусом генотипа 1) в сочетании с другими противовирусные препараты.[3][4][5]
Нарлапревир - первый в России таблетированный препарат для лечения хронического гепатита С.[4][6]
Механизм действия
Нарлапревир является пероральным ингибитором сериновой протеазы NS3 вируса гепатита С. Подавляет вирусную репликация в зараженном хосте клетки.[2] Механизм торможения предполагает обратимый ковалентное связывание нарлапревира с протеазой NS3 активный сайт через кетоамид функциональная группа.[2]
Нарлапревир не связывается с человеком протеазы, за исключением катепсин B (69% ингибирование). Избыточная экспрессия катепсина B связана с развитием злокачественных новообразований.[7]
Применение
- Показания
Лечение хронической инфекции вируса гепатита С (HCV) генотипа 1 в сочетании с ритонавир, пегилированный интерферон альфа и рибавирин, у пациентов старше 18 лет с компенсированным печень заболевание, ранее не получавшие лечения или не получившие двойную комбинацию пегилированного интерферона альфа и рибавирина. Нарлапревир нельзя использовать как одно средство.[1][2][6][8][9]
- Противопоказания
Нарлапревир имеет некоторые противопоказания. Особенно:[1][8]
- беременность или лактация
- дети до 18 лет
- серьезный нейтропения
- отказ печени
- предварительное лечение ингибиторами протеазы HCV
- лактаза дефицит, непереносимость лактозы, глюкозо-галактозная мальабсорбция.
Исследования эффективности
H. Reesink et al. (2009) продемонстрировали безопасность и противовирусную активность нарлапревира как в виде отдельного агента, так и в двойной комбинации с пегилированным интерфероном альфа-2b.[10]
X. Tong et al. (2010) продемонстрировали активность нарлапревира против ВГС. мутации вызывая сопротивление к боцепревир и телапревир.[2]
В 2016 году была завершена крупномасштабная фаза III многоцентрового исследования PIONEER. Устойчивый вирусологический ответ (УВО) составил 89% у пациентов, ранее не получавших лечение, и 70% у пациентов, получавших лечение, через 24 недели после окончания лечения в группе нарлапревира, тогда как в контрольной группе УВО был только 59,6% у пациентов, не получавших лечение, и 24,5%. у опытных пациентов, получающих двойную терапию пегилированным интерфероном альфа и рибавирином. Добавление нарлапревира к двойной терапии с пегилированным интерфероном альфа и рибавирином не повлияло на профиль безопасности нарлапревира. Фаза I исследования нарлапревира фармакокинетика в комбинации с ритонавиром у пациентов с компенсированным цирроз также был завершен (Liver Meeting AASLD, 13–17 февраля 2015 г., Сан-Франциско, Калифорния, США).[9][11]
По мнению профессора И.Г. Бакулин, заведующий отделением гепатологии Московского клинического исследовательского центра и главный гастроэнтеролог Департамента здравоохранения Москвы, одобрение регулирующими органами нарлапревира стало важной вехой в борьбе с гепатитом С в России.[9]
История
В 2012 году фармацевтическая группа «Р-Фарм» приобрела лицензию на производство нарлапревира из Merck & Co. (МСД).[12] Дальнейшая разработка препарата проводилась компанией «Р-Фарм» совместно с Texas Liver Institute (США) при поддержке Федеральной целевой программы «Развитие фармацевтической и медицинской промышленности Российской Федерации на период до 2020 года и далее». .[9] В клинические испытания и разработку препарата вложено около 700 млн рублей.[4][13] из них 120 миллионов рублей поступило от Правительства РФ.[14]
Доклинические и клинические исследования препарата проводились в Schering-Plough Research Institute (США), а также в ряде клинических центров Европы, Соединенные Штаты Америки и Россия.[9][13][14]
Препарат производится на фармацевтическом заводе в российском городе Ярославле.[4]
Рекомендации
- ^ а б c «Российский государственный реестр лекарственных средств. Таблетки, покрытые пленочной оболочкой Арланса (нарлапревир): Свидетельство о регистрации» (на русском). Получено 11 января 2017.
- ^ а б c d е Тонг X, Арасаппан А., Беннет Ф., Чейз Р., Фелд Б., Го З. и др. (Июнь 2010 г.). «Доклиническая характеристика противовирусной активности SCH 900518 (нарлапревир), нового ингибитора протеазы NS3 вируса гепатита С». Противомикробные препараты и химиотерапия. 54 (6): 2365–70. Дои:10.1128 / AAC.00135-10. ЧВК 2876368. PMID 20308381.
- ^ Чен К.Х., Ньороге Ф.Г. (2012). «12. Открытие боцепревира и нарлапревира: первое и второе поколение ингибиторов протеазы NS3 HCV». В Huang X, Aslanian RG (ред.). Примеры из практики открытия и разработки современных лекарств. Оксфорд: John Wiley & Sons, Inc., стр. 296–335. Дои:10.1002 / 9781118219683.ch12. ISBN 9781118219683.
- ^ а б c d "Российский препарат от гепатита С готовится к выпуску" (на русском). Собеседник.RU. 30 июня 2016 г.
- ^ Ван Х, Гэн Л., Чен Б.З., Цзи М. (октябрь 2014 г.). «Вычислительное исследование молекулярных механизмов лекарственной устойчивости Нарлапревира из-за мутаций V36M, R155K, V36M + R155K, T54A и A156T протеазы NS3 / 4A HCV». Биохимия и клеточная биология = Biochimie et Biologie Cellulaire. 92 (5): 357–69. Дои:10.1139 / bcb-2014-0039. PMID 25178998.
- ^ а б Рудакова А.В., Гусев Д.А., Усков А.Н., Коновалова Л.Н., Лобзин Ю.В. (2016). «Экономическая эффективность второй волны ингибиторов протеазы в лечении хронического гепатита С (генотип 1) у пациентов, ранее не получавших противовирусные препараты, и при рецидиве заболевания». Журнал инфектологии (на русском). 8 (1): 79–82. Дои:10.22625/2072-6732-2016-8-1-79-82 (неактивно 24.11.2020).CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (ссылка на сайт)
- ^ Арасаппан А., Беннетт Ф., Боген С.Л., Венкатраман С., Блэкман М., Чен К.Х. и др. (Май 2010 г.). «Открытие Нарлапревира (SCH 900518): сильнодействующего ингибитора сериновой протеазы NS3 второго поколения». Письма о медицинской химии ACS. 1 (2): 64–9. Дои:10,1021 / мл 9000276. ЧВК 4007962. PMID 24900178.
- ^ а б Бакулин И. "Вторая волна" ИП Нарлапревир у российских больных хроническим гепатитом С 1 генотипа " (PDF).
- ^ а б c d е ""«Р-Фарм» запускает «Нарлапревир - новый пероральный препарат от гепатита С» (на русском). R-Pharm.com. 6 июня 2016 г. Архивировано с оригинал 28 августа 2016 г.. Получено 23 декабря 2016.
- ^ Reesink H, Bergmann J, de Bruijne J, Weegink C, Van Lier J, Van Vliet A и др. (2009). «Безопасность и противовирусная активность SCH 900518, вводимого в качестве монотерапии и в комбинации с пегинтерфероном альфа-2B наивным пациентам и пациентам, инфицированным ВГС-1, прошедшим лечение». Журнал гепатологии. 50 (Приложение 1): S35 – S36. Дои:10.1016 / S0168-8278 (09) 60088-X.
- ^ Бакулин И.Г., Абдурахманов Д.Т., Богомолов П.О., Бурневич Э.З., Волошина Н.Б., Гейвандова Н.И. и др. «Предварительные результаты исследования фазы III нового ингибитора протеазы нарлапревира у пациентов, ранее не получавших лечения, и пациентов, прошедших лечение с хроническим гепатитом С генотипа 1 (исследование PIONEER)» Проверьте
| url =ценить (Помогите) (PDF) (на русском). п. 20. - ^ Дранишникова М, Фомченко Д (21 июня 2012 г.). «Вместе против гепатита» (на русском). Ведомости.
- ^ а б Лапин М. (30 июня 2016 г.). «В России начнется производство лекарства от гепатита С» (на русском).
- ^ а б Невинная И. «Минпромторг поддерживает разработку новых препаратов» (на русском языке) (Федеральный выпуск №5823 (150)). Российская газета.
дальнейшее чтение
- Бурневиш Е.З., Тихонова Н.Ю., Щаницына С.Е. (2014). «Нарлапревир, усиленный ритонавиром, в сочетании с пегилированным интерфероном альфа-2А и рибавирином в лечении хронического гепатита С». Клиническая фармакология и терапия. 5: 34–9.