WikiDer > Антагонист каннабиноидных рецепторов
А антагонист каннабиноидных рецепторов, также известный как антагонист каннабиноидов или как антиканнабиноид, это тип каннабиноидергический препарат, средство, медикамент это связано с каннабиноидные рецепторы (CBR) и предотвращает их активацию эндоканнабиноиды. Они включают антагонисты, обратные агонисты, и антитела ЦБ РФ. Открытие эндоканнабиноидная система привело к развитию CB1 рецептор антагонисты. Первый антагонист CBR, римонабант, был описан в 1994 году. Римонабант блокирует CB1 рецептора избирательно и, как было показано, снижает потребление пищи и регулирует прибавку в весе. Распространенность ожирение во всем мире резко увеличивается и оказывает большое влияние на здравоохранение. Отсутствие эффективных и хорошо переносимых препаратов для лечения ожирения привело к повышенному интересу к исследованиям и разработке антагонистов CBR.[1][2] Каннабидиол (CBD), каннабиноид природного происхождения, неконкурентоспособный CB1/ CB2 антагонист рецепторов. И Δ9-тетрагидроканнабиварин (THCV), природный каннабиноид, модулирующий действие THC через прямую блокаду каннабиноидов CB1 рецепторы, таким образом, ведя себя как CB первого поколения1 обратные агонисты рецепторов, такие как римонабант. CBD - это CB с очень низким сродством1 лиганд, который, тем не менее, может влиять на CB1 рецепторная активность in vivo косвенным образом, в то время как THCV является высокоаффинным CB1 рецепторный лиганд и мощный антагонист in vitro и все же лишь изредка производит эффект in vivo в результате CB1 рецепторный антагонизм. THCV также имеет высокое сродство к CB2 рецепторы и сигналы как частичный агонист, в отличие от CBD и римонабанта.[3]
История
На века гашиш и марихуана из индийской конопли Каннабис сатива L. использовались в лечебных и рекреационных целях.[4][5] В 1840 году Шлезингер С. был, по-видимому, первым исследователем, получившим активный экстракт из листьев и цветов конопли.[6] Несколько лет спустя, в 1848 году, Декуртив Э. описал приготовление этанольного экстракта, который при испарении растворителя давал темную смолу, которую он назвал «каннабином».[7][8] В 1964 г. основная активная составляющая C. sativa Л., Δ9-тетрагидроканнабинол (THC), был выделен и синтезирован Mechoulam's лаборатория.[4][9] Два типа каннабиноидные рецепторы, CB1 и CB2, ответственные за эффекты THC, были обнаружены и клонированы в начале 1990-х годов.[1][10] После открытия каннабиноидных рецепторов стало важно установить, агонисты происходят естественным образом в организме. Этот поиск привел к открытию первого эндогенного каннабиноида (эндоканнабиноида), анандамид (арахидоноилэтаноламид). Позже были обнаружены и другие эндоканнабиноиды, например 2-AG (2-арахидоноилглицерин).[4] Эти результаты подняли дополнительные вопросы о фармакологической и физиологической роли каннабиноидной системы. Это возродило исследования антагонистов каннабиноидных рецепторов, которые должны были помочь ответить на эти вопросы.[10] Использование каннабиноидного агониста ТГК во многих его препаратах для повышения аппетита - хорошо известный факт. Этот факт привел к логическому выводу, что блокирование каннабиноидных рецепторов может быть полезно для снижения аппетита и потребления пищи.[11] Затем было обнаружено, что блокировка CB1 рецептор представляет собой новую фармакологическую мишень. Первый конкретный CB1 антагонист рецепторов / обратный агонист был римонабант, обнаруженный в 1994 году.[10][11][12]
Эндоканнабиноиды и их сигнальная система
В эндогенная каннабиноидная система включает каннабиноидные рецепторы, их эндогенные лиганды (эндоканнабиноиды) и ферменты для их синтеза и разложения.[13]
Существует два основных типа рецепторов, связанных с эндоканнабиноидной сигнальной системой: каннабиноидный рецептор 1 (CB1) и 2 (CB2). Оба рецептора представляют собой 7-трансмембранные рецепторы, связанные с G-белком (GPCR), которые препятствуют накоплению циклический аденозинмонофосфат внутри клеток.[14][15] CB1 рецепторы присутствуют в наибольшей концентрации в головном мозге, но также могут быть обнаружены на периферии. CB2 рецепторы в основном расположены в иммунных и гематопоэтический системы.[1][14]
Эндоканнабиноиды - это эйкозаноиды действуют как агонисты каннабиноидных рецепторов, и они естественным образом встречаются в организме.[9] Процессы, связанные с каннабиноидными рецепторами, например, участвуют в познании; объем памяти; беспокойство; контроль аппетита; рвота; двигательное поведение; сенсорный, автономный, нейроэндокринныйи иммунные ответы; и воспалительные эффекты.[13]Есть два хорошо охарактеризованных эндоканнабиноида, расположенных в головном мозге и периферия. Первым идентифицированным был анандамид (арахидоноилэтаноламид), а вторым был 2-AG (2-арахидоноилглицерин). Дополнительные эндоканнабиноиды включают: виродамин (О-арахидоноил этаноламин), ноладиновый эфир (2-арахидоноилглицериловый эфир) и НАДА (N-арахидоноил дофамин).[14]
Механизм действия
CB1 рецепторы связаны через Gввод / вывод белки и подавляют аденилилциклаза и активировать митоген-активированный белок (MAP) киназа. Кроме того, CB1 рецепторы подавляют пресинаптические кальциевые каналы N- и P / Q-типа и активируют внутреннее выпрямление калиевые каналы.[4][11] CB1 антагонисты вызывают обратные каннабимиметические эффекты, противоположные по направлению действиям, вызываемым агонистами этих рецепторов.[4][16]
CB1 рецепторы сильно выражены в гипоталамический области, которые участвуют в централизованном контроле приема пищи и пищевого поведения. Это убедительно указывает на то, что каннабиноидная система напрямую участвует в регуляции питания. Эти регионы также связаны с мезолимбический дофаминовый путь, так называемая система «вознаграждений». Следовательно, CB1 антагонисты могут косвенно подавлять опосредованные дофамином полезные свойства пищи.[14][16] Периферийный CB1 рецепторы расположены в желудочно-кишечном тракте, печени и жировой ткани. В GI, CB1 рецепторы расположены на нервных окончаниях в кишечнике. Эндоканнабиноиды действуют на ХБ1 рецепторы, усиливающие чувство голода и способствующие кормлению, и предполагается, что они уменьшают кишечные перистальтика и опорожнение желудка. Таким образом, антагонизм к этим рецепторам может обратить эти эффекты.[14] Также в периферических тканях антагонизм ЦБ1 рецепторов увеличивается инсулин чувствительность и окисление жирные кислоты в мышцах и печени.[1] Гипотетическая схема метаболических эффектов CB1 антагонисты рецепторов показаны на рисунке 1.
Дизайн лекарств
Первым подходом к разработке антагонистов каннабиноидов в конце 1980-х было изменение структуры ТГК, но результаты были неутешительными. В начале 1990-х годов было обнаружено новое семейство агонистов каннабиноидов из НПВП (нестероидный противовоспалительный) препарат правадолин что привело к открытию антагонистов аминоалкилиндола с некоторым, но ограниченным успехом. Поскольку поиск, основанный на структуре агонистов, разочаровал, неудивительно, что первый мощный и селективный антагонист каннабиноидов принадлежал к совершенно новому химическому семейству. В 1994 году появился первый селективный антагонист каннабиноидов, SR141716 (римонабант), был введен Санофи принадлежит к семейству 1,5-диарилпиразолов.[10][17]
Римонабант


Римонабант, также известный под систематическим названием [N- (пиперидин-1-ил) -5- (4-хлорфенил) -1- (2,4-дихлорфенил) -4-метил-1ЧАС-пиразол-3-карбоксамидгидрохлорид)], представляет собой 1,5-диарилпиразол CB1 антагонист рецептора (рисунок 2).[17] Римонабант - это не только мощный и высокоселективный лиганд CB1 рецептора, но он также активен при пероральном приеме и противодействует большинству эффектов каннабиноидных агонистов, таких как THC, оба in vitro и in vivo. Римонабант продемонстрировал явную клиническую эффективность для лечения ожирения.[18]
Привязка
Связывание лиганда-агониста с CB1 рецептор вызывает конформационные изменения и приводит к активному состоянию рецептора, который отвечает за передачу сигнала. Однако существует дополнительный механизм, который может привести к активному состоянию в отсутствие лиганда. Как и многие другие GPCR, CB1 рецептор проявляет высокий уровень конститутивной активности и, таким образом, он может спонтанно принимать активное конформационное состояние в отсутствие связывания агониста, поддерживая повышенные базальные уровни внутриклеточной передачи сигналов.[19] Это можно объяснить с помощью модели активации рецепторов с двумя состояниями, в которой рецепторы находятся в равновесии между двумя состояниями, активным и неактивным (R * и R). Агонист стабилизирует активное состояние, ведущее к активации, нейтральный антагонист одинаково связывается с активным и неактивным состояниями, тогда как обратный агонист будет предпочтительно стабилизировать неактивное состояние (рисунок 3).[19]
Во многих случаях сообщалось, что римонабант ведет себя как обратный агонист, а не как нейтральный антагонист, и вполне вероятно, что он связывается преимущественно с неактивным состоянием CB1, тем самым уменьшая активацию сигнального пути.[20][21] Ключевое взаимодействие привязки - это водородная связь сформированный между карбонил группа римонабанта и остаток Lys192 CB1 рецептор. Эта связь стабилизирует Lys192-Asp366. соляной мост внутриклеточного конца трансмембранный спирали 3 и 6 (рисунок 4). Этот специфический солевой мостик присутствует в неактивном состоянии рецептора, но отсутствует в активном состоянии.[20][21]
В неактивном состоянии CB1 римонабант связывается в пределах трансмембранного ароматического микродомена-3-4-5-6. Связывание римонабанта включает прямые ароматические взаимодействия между его 2,4-дихлорфенильным кольцом и остатками Trp279 / Phe200 / Trp356 на одной стороне и параграф-хлорфенильное кольцо и остатки Tyr275 / Trp255 / Phe278 с другой стороны. Липофильный пиперидинил фрагмент хорошо вписывается в полость, образованную аминокислотными остатками Val196 / Phe170 / Leu387 и Met384 (рис. 4).[20][18][19][22]
Фармакофор
Большинство CB1 антагонисты, описанные на данный момент, являются близкими аналогами или изостеры римонабанта.[23] Общий CB1 обратный агонист фармакофор Модель может быть извлечена из общих черт этих аналогов, диарилпиразолов (Рисунок 4).[20] Этот фармакофор содержит циклическое ядро C (например, пиразол в римонабанте), замещенное двумя ароматическими фрагментами, A и B. акцептор водородной связи единица D соединяет C с циклической липофильной частью E. В некоторых случаях единица E напрямую соединяется с C.[20][23] На рисунке 4 римонабант используется в качестве примера. Элемент A представляет собой 4-хлорфенильную группу, а элемент B - 2,4-дихлорфенильное кольцо. Блок C - центральный пиразол кольцо и звено D представляет собой карбонильную группу, которая служит акцептором водородной связи. Единица E представляет собой липофильный аминопиперидинильный фрагмент.[20]
Отношения структура-деятельность
Оптимальное связывание в CB1 рецептор требует параграф-замещенное фенильное кольцо в 5-положении пиразола. 5-заместитель пиразола участвует в распознавании рецептора и антагонизме. В параграф-заместитель фенильного кольца может быть хлором, бромом или йодом, но было показано, что алкильная цепь также может быть допустимой.[20] Нумерация центрального пиразольного кольца показана на рисунке 2.
2,4-дихлорзамещенное фенильное кольцо в положении пиразола 1 является предпочтительным как по сродству, так и по активности. Было показано, что дополнительные галогены на этом фенильном кольце уменьшается сродство.[20]
Также предпочтительно иметь замещение в кольце у 3-карбоксамидной группы, такой как 1-пиперидинильная группа в римонабанте.[20] Замена аминопиперидинильного заместителя на алкил амиды, эфиры, кетоны, спирты или же алканы привело в основном к снижению аффинности. Замена пиперидинила на пентил или гептильная цепь придает соединениям агонистические свойства. На основании этих результатов был сделан вывод, что положение пиразола 3, по-видимому, участвует в агонизме, тогда как положения 1, 4, 5, по-видимому, участвуют в антагонизме.[18]
Исследования показали, что отсутствие карбоксамид кислород приводит к снижению сродства. Кроме того, присутствие кислорода карбоксамида способствует приданию свойств обратного агониста, тогда как аналоги, лишенные этого кислорода, как обнаружено, являются нейтральными антагонистами. Эти результаты подтверждают гипотезу о том, что кислород карбоксамида образует водородную связь с остатком Lys192 на CB1 рецептор.[24]
Производные диарилпиразола
Аналоги SR141716 (римонабанта) недавно были описаны несколькими группами, что привело к хорошему пониманию взаимосвязь структура-деятельность (SAR) в этой химической группе. Хотя большинство описанных соединений менее эффективны, чем SR141716, стоит упомянуть два из них: SR147778 и AM251, хотя оба могут действовать и на мю-опиоидные рецепторы.[25][2]
SR147778 (Суринабант), антагонист второго поколения, обладает большей продолжительностью действия, чем римонабант, и повышенной пероральной активностью. Такая увеличенная продолжительность действия, вероятно, связана с наличием более метаболически стабильной этильной группы в 4-м положении пиразольного кольца. Еще одно изменение - замена 5-фенилхлорного заместителя на бром.[2][20][26]
Было описано производное диарилпиразола, AM251, в котором заместитель хлора был заменен йодом в параграф положение 5-фенильного кольца. Это производное оказалось более сильнодействующим и избирательным, чем римонабант.[11][18]
21 аналог, содержащий алкиламид или алкил гидразид вариантов длин в положении 3 были синтезированы. Было замечено, что сродство увеличивается с увеличением длины углеродной цепи до пяти атомов углерода. Аналоги амида также обладают более высоким сродством, чем аналоги гидразида. Однако ни один из этих аналогов не обладал значительно большей аффинностью, чем римонабант, но, тем не менее, они были немного более селективными, чем римонабант в отношении CB1 рецептор над CB2 рецептор.[18]
Было предпринято несколько попыток повысить сродство производных диарилпиразола путем придания жесткости структуре римонабанта. В терминах общей модели фармакофоров единицы A, B и / или C связаны дополнительными связями, ведущими к жестким молекулам. Например, конденсированный полициклический пиразол НЕСС-0327 показал в 5000 раз большую близость к CB1 рецептора, чем римонабант. Однако это соединение обладает плохой центральной биодоступность.[20][18]
Другое соединение, индазол производная О-1248, можно рассматривать как аналог римонабанта, в котором его 5-арильная группа конденсирована с пиразольным фрагментом. Однако эта структурная модификация привела к 67-кратному снижению CB1 рецепторное сродство.[20]
Эти диарилпиразольные производные римонабанта приведены в таблице 1.
 |  |
| SR147778 | AM251 |
 | 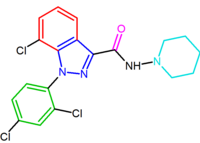 |
| НЕСС-0327 | О-1248 |
Прочие производные
Структурно отличается от 1,5-диарилпиразолов химический ряд 3,4-диарилпиразолинов. В эту серию входит SLV-319 (ибипинабант), мощный CB1 антагонист, который примерно в 1000 раз более селективен в отношении CB1 по сравнению с CB2 и отображает in vivo активность аналогична римонабанту.[2][20]
Другой подход, использованный для разработки аналогов римонабанта, заключался в замене центрального пиразольного цикла другим гетероцикл. Примером этого подхода являются 4,5-диарилимидазолы и 1,5-диарилпиррол-3-карбоксамиды.[2]
Сообщается о большом количестве конденсированных бициклических производных диарилпиразола и имидазолов. Примером этого является производное пурина, где пиримидин кольцо сливается с имидазол звенеть.[2] Отенабант (CP-945,598) представляет собой пример конденсированной бициклической производной, разработанной Pfizer.[27]
Несколько исследовательских групп изучали пиразол с шестичленным кольцом. биоизостеры. Например, было показано, что одно производное 2,3-диарилпиридина является сильнодействующим и селективным CB1 обратный агонист. Структура этого соединения демонстрирует возможность того, что амидная часть римонабанта может быть разделена на липофильную (бензилокси) и полярную (нитрильную) функциональность. Другими аналогами шестичленного кольца являются, например, пиримидины и пиразины.[2]
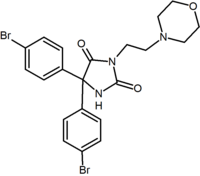
Помимо аналогов с пяти- и шестичленным кольцом, существуют другие циклические производные, такие как азетидины. Одним из примеров является производное азетидина метилсульфонамида, которое имеет 1,1-диарильную группу, которая имитирует 1,5-диарильную группу диарилпиразолов. В сульфонил группа служит акцептором водородной связи. 1,1-диарильная группа также присутствует в таких производных, как бензодиоксолы и гидантоины.[2][20]
Сообщалось также об ациклических аналогах. Эти аналоги содержат 1,2-диарильный мотив, который соответствует 1,5-диарильным заместителям римонабанта.[2] Пример ациклического аналога: таранабант (MK-0364) разработан Merck.[27]
Представители этих аналогов представлены в таблице 2.
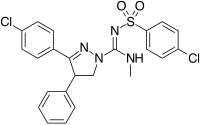 |  |  | |
| Тип производная | 3,4-диарилпиразолин (Ибипинабант) | 4,5-диарилимидазол | 1,5-диарилпиррол-3-карбоксамиды |
 |  | 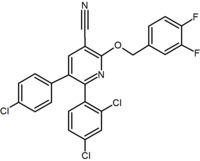 | |
| Тип производная | Пурин (пиримидин звенеть слился с имидазол звенеть) | Производное пурина (Отенабант) | 2,3-диарилпиридин |
 |  | 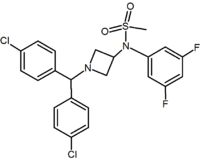 | |
| Тип производная | Пиримидин | Пиразин | Метилсульфонамид азетидин |
 |  |  | |
| Тип производная | Бензодиоксол | Гидантоин | Ациклическое производное (Таранабант) |
CB1 рецепторные антитела
Антитела против ЦБ1 рецепторы были разработаны и внедрены в клиническую практику в Россия.[28] Они включают бризантин (Русский: Бризантин®) и диетресса (Русский: Диетресса®).[28] Бризантин показан для лечения никотиновая абстиненция и Отказ от курения и диетресса показана для потеря веса.[28] Dietressa доступна без рецепта в России.[28][2]
Текущее состояние
Римонабант (Acomplia) одобрен в Евросоюз (ЕС) с июня 2006 г. для лечения ожирения. 23 октября 2008 г. Европейское агентство по лекарствам (EMEA) рекомендовала приостановить действие регистрационного удостоверения Acomplia от Sanofi-Aventis на территории ЕС из-за риска серьезных психических расстройств.[29] 5 ноября 2008 г. Санофи-Авентис объявила о прекращении программы клинических исследований римонабанта.[30]
Санофи-Авентис также прекратила разработку суринабанта (SR147778), CB1 антагонист рецепторов для прекращения курения (31 октября 2008 г.).[31]
Компания Merck заявила в своем пресс-релизе от 2 октября 2008 г., что не будет добиваться разрешения регулирующих органов на применение таранабанта (MK-0364) для лечения ожирения и прекратит свою программу клинических разработок Фазы III. Данные клинического исследования фазы III показали, что более высокая эффективность и больше побочных эффектов были связаны с более высокими дозами таранабанта, и было определено, что общий профиль таранабанта не поддерживает дальнейшее развитие ожирения.[32]
Другая фармацевтическая компания, Pfizer, прекратила программу разработки фазы III своего препарата отенабанта для лечения ожирения (CP-945,598), селективного антагониста CB1 рецептор. Согласно Pfizer, их решение было основано на изменении регуляторных взглядов на профиль риска / выгоды ЦБ.1 класс и, вероятно, новые нормативные требования для утверждения.[33]
Был опубликован ряд инициатив по разработке антагонистов CB1, которые нацелены только на периферические рецепторы CB1, ограничивая их способность пересекать гематоэнцефалический барьер. Среди этих инициатив 7TM Pharma сообщила о разработке TM38837.[нужна цитата]В настоящее время опубликован обзор подходов и соединений, используемых в качестве периферически ограниченного ХБ.1 блокаторы рецепторов.[34]
Смотрите также
Рекомендации
- ^ а б c d Patel, P.N .; Патак, Р. (2007), «Римонабант: новый селективный антагонист рецептора каннабиноида-1 для лечения ожирения», Американский журнал фармации системы здравоохранения, 64 (5): 481–489, Дои:10.2146/060258, PMID 17322160
- ^ а б c d е ж грамм час я Барт, Ф. (2005), "Антагонисты каннабиноидных рецепторов CB1", Годовые отчеты по медицинской химии Том 40, Годовые отчеты по медицинской химии, 40, стр. 103–118, Дои:10.1016 / S0065-7743 (05) 40007-X, ISBN 978-0-12-040540-4, заархивировано из оригинал на 2009-01-05, получено 2008-11-14
- ^ Макпартленд, Джон М; Дункан, Марни; Ди Марцо, Винченцо; Пертви, Роджер Дж. (2017-03-10). «Являются ли каннабидиол и Δ9-тетрагидроканнабиварин отрицательными модуляторами эндоканнабиноидной системы? Систематический обзор». Британский журнал фармакологии. 172 (3): 737–753. Дои:10.1111 / bph.12944. ISSN 0007-1188. ЧВК 4301686. PMID 25257544.
- ^ а б c d е Пертви, Р. (2006), «Фармакология каннабиноидов: первые 66 лет», Британский журнал фармакологии, 147 (S1): S163 – S171, Дои:10.1038 / sj.bjp.0706406, ЧВК 1760722, PMID 16402100
- ^ Реджио, П. (2003), «Фармакофоры для распознавания лигандов и активации / инактивации каннабиноидных рецепторов» (PDF), Текущий фармацевтический дизайн, 9 (20): 1607–1633, Дои:10.2174/1381612033454577, PMID 12871061
- ^ Шлезингер С. Untersuchung der Cannabis sativa. Repertorium für die Pharmacie. 1840: 190-208.
- ^ Обложка E. Note sur le haschisch. CR Hebd Séances Acad Sci .. 1848; 26: 509-510.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) на 2011-07-10. Получено 2010-04-01.CS1 maint: заархивированная копия как заголовок (связь)
- ^ а б Howlett, A.C .; Breivogel, C.S .; Childers, S.R .; Deadwyler, S.A .; Hampson, R.E .; Поррино, Л.Дж. (2004 г.), «Физиология и фармакология каннабиноидов: 30 лет прогресса», Нейрофармакология, 47: 345–358, Дои:10.1016 / j.neuropharm.2004.07.030, PMID 15464149
- ^ а б c d Barth, F .; Ринальди-Кармона, М. (1999), «Развитие антагонистов каннабиноидов», Современная лекарственная химия, 6 (8): 745–755, PMID 10469889
- ^ а б c d Маки К. (2006), «Каннабиноидные рецепторы как терапевтические мишени» (PDF), Анну. Rev. Pharmacol. Toxicol., 46: 101–22, Дои:10.1146 / annurev.pharmtox.46.120604.141254, PMID 16402900.
- ^ Фонг TM, Хеймсфилд С.Б. (сентябрь 2009 г.), «Обратные агонисты рецептора каннабиноида-1: современное понимание механизма действия и оставшиеся без ответа вопросы», Int J Obes (Лондон), 33 (9): 947–55, Дои:10.1038 / ijo.2009.132, PMID 19597516.
- ^ а б Svíženská, I .; Дубовы, П .; Šulcová, A. (2008), "Каннабиноидные рецепторы 1 и 2 (CB1 и CB2), их распределение, лиганды и функциональное участие в структурах нервной системы - краткий обзор", Фармакология, биохимия и поведение, 90 (4): 501–511, Дои:10.1016 / j.pbb.2008.05.010, PMID 18584858
- ^ а б c d е Xie, S .; Furjanic, M.A .; Ferrara, J.J .; McAndrew, N.R .; Ardino, E.L .; Ngondara, A .; Bernstein, Y .; Thomas, K.J .; и другие. (2007), «Эндоканнабиноидная система и римонабант: новый препарат с новым механизмом действия, включающий антагонизм каннабиноидного рецептора CB1 - или обратный агонизм - в качестве потенциального лечения ожирения и другого терапевтического применения», Журнал клинической фармации и терапии, 32 (3): 209–231, Дои:10.1111 / j.1365-2710.2007.00817.x, PMID 17489873
- ^ Ashton, J.S .; Wright, J.L .; McPartland, J.M .; Tyndall, J.D.A. (2008), «Специфичность каннабиноидного рецептора CB1 и лиганда рецептора CB2 и разработка CB2-селективных агонистов», Современная лекарственная химия, 15 (14): 1428–1443, Дои:10.2174/092986708784567716, PMID 18537620
- ^ а б Ди Марцо, В. (2008), "Антагонизм рецептора CB1: биологическая основа метаболических эффектов", Открытие наркотиков сегодня, 13 (23–24): 1–16, Дои:10.1016 / j.drudis.2008.09.001, PMID 18824122
- ^ а б Ринальди - Кармона, М .; Barth, F .; Héaulme, M .; Shire, D .; Calandra, B .; Congy, C .; Мартинес, С .; Maruani, J .; и другие. (1994), «SR141716A, мощный и селективный антагонист каннабиноидного рецептора мозга», Письма FEBS, 350 (2–3): 240–244, Дои:10.1016 / 0014-5793 (94) 00773-X, PMID 8070571
- ^ а б c d е ж Muccioli, G.G .; Ламберт, Д. (2005), «Современные знания об антагонистах и обратных агонистах каннабиноидных рецепторов» (PDF), Современная лекарственная химия, 12 (12): 1361–1394, Дои:10.2174/0929867054020891, PMID 15974990
- ^ а б c Ortega-Gutiérrez, S .; Лопес-Родригес, М. (2005), «Исследования связывания каннабиноидных рецепторов CB1 и CB2, основанные на подходах моделирования и мутагенеза», Мини-обзоры по медицинской химии, 5 (7): 651–658, Дои:10.2174/1389557054368754, PMID 16026311
- ^ а б c d е ж грамм час я j k л м п Lange, Jos H.M .; Круз, Крис Г. (2005), "Стратегии лекарственной химии для CB1 антагонисты каннабиноидных рецепторов ", Открытие наркотиков сегодня, 10 (10/24): 693–702, Дои:10.1016 / S1359-6446 (05) 03427-6, PMID 15896682
- ^ а б McAllister, S.D .; Rizvi, G .; Anavi-Goffer, S .; Hurst, D.P .; Barnett-Norris, J .; Lynch, D.L .; Реджо, штат Пенсильвания; Abood, M.E. (2003), «Ароматический микродомен в каннабиноидном рецепторе CB1 представляет собой область связывания агониста / обратного агониста», Журнал медицинской химии, 46 (24): 5139–5152, Дои:10.1021 / jm0302647, PMID 14613317
- ^ Fan, H .; Kotsikorou, E .; Hoffman, A.F .; Ravert, H.T .; Holt, D .; Hurst, D.P .; Lupica, C.R .; Реджо, штат Пенсильвания; и другие. (2008), «Аналоги JHU75528, лиганда ПЭТ для визуализации церебральных каннабиноидных рецепторов (CB1): разработка лигандов с оптимизированной липофильностью и аффинностью связывания», Европейский журнал медицинской химии, 44 (2): 1–16, Дои:10.1016 / j.ejmech.2008.03.040, ЧВК 2728551, PMID 18511157
- ^ а б Foloppe, N .; Allen, N.H .; Bentlev, C.H .; Брукс, Т.Д .; Kennett, G .; Knight, A.R .; Леонарди, С .; Misra, A .; и другие. (2008), «Открытие нового класса селективных обратных агонистов CB1 человека», Письма по биоорганической и медицинской химии, 18 (3): 1199–1206, Дои:10.1016 / j.bmcl.2007.11.133, PMID 18083560
- ^ Jagerovic, N .; Фернандес - Fernandez, C .; Гойя, П. (2008), "Антагонисты каннабиноидов CB1: взаимосвязь структура - активность и потенциальные терапевтические применения", Актуальные темы медицинской химии, 8 (3): 205–230, Дои:10.2174/156802608783498050, PMID 18289089
- ^ «AM-251 и римонабант действуют как прямые антагонисты мю-опиоидных рецепторов: значение для исследований взаимодействия опиоидов / каннабиноидов»., Нейрофармакология. 2012 Октябрь; 63 (5): 905-15. DOI: 10.1016 / j.neuropharm.2012.06.046. Epub 2012 4 июля.
- ^ Вемури, В.К .; Janero, D.R .; Макрияннис, А. (2008), «Фармакотерапевтическое воздействие на эндоканнабиноидную сигнальную систему: препараты от ожирения и метаболического синдрома», Физиология и поведение, 93 (4–5): 671–686, Дои:10.1016 / j.physbeh.2007.11.012, ЧВК 3681125, PMID 18155257
- ^ а б Kim, M .; Yun, H .; Kwak, H .; Kim, J .; Ли, Дж. (2008), «Дизайн, химический синтез и биологическая оценка новых триазолильных аналогов таранабанта (MK-0364), обратного агониста рецептора каннабиноида-1», Тетраэдр, 64 (48): 10802–10809, Дои:10.1016 / j.tet.2008.09.057
- ^ а б c d Барчуков, В. В .; Жавберт, Э. С .; Дугина, Ю. L .; Эпштейн, О. И. (2015). «Использование препаратов на основе высвобождающих активных антител для профилактики головокружения у взрослых». Вестник экспериментальной биологии и медицины. 160 (1): 61–63. Дои:10.1007 / s10517-015-3098-z. ISSN 0007-4888. PMID 26608378.
- ^ [1]
- ^ «Санофи, глобальная биофармацевтическая компания, специализирующаяся на здоровье человека - Санофи» (PDF). en.sanofi-aventis.com. Архивировано из оригинал (PDF) на 2008-11-24. Получено 2008-11-14.
- ^ http://www.sanofi-aventis.ca/live/ca/medias/DA924A61-8E54-4D1D-B1FB-71C953E398C2.pdf[постоянная мертвая ссылка]
- ^ «Архивная копия». Архивировано из оригинал на 2008-10-06. Получено 2008-11-14.CS1 maint: заархивированная копия как заголовок (связь)
- ^ http://www.pfizer.com/news/press_releases/pfizer_press_releases.jsp?rssUrl=http://mediaroom.pfizer.com/portal/site/pfizer/index.jsp?ndmViewId=news_view&ndmConfigId=1010794&news500sId=1010794&news500
- ^ Чорват, Роберт Дж. (2013). «Блокаторы рецепторов CB-1 с ограниченной периферией». Биоорг. Med. Chem. Латыш. 23 (17): 4751–4760. Дои:10.1016 / j.bmcl.2013.06.066. PMID 23902803.


