WikiDer > Лимфотоксин альфа
Лимфотоксин-альфа (LT-α) или фактор некроза опухоли-бета (TNF-β) представляет собой белок что у людей кодируется LTA ген.[5][6] Принадлежность к кроветворный линия клеток LT-α проявляет антипролиферативную активность и вызывает разрушение линий опухолевых клеток.[5] Как цитотоксический белка, LT-α выполняет множество важных ролей в иммунной регуляции в зависимости от формы, в которой он секретируется. В отличие от других членов TNF суперсемейство, LT-α обнаруживается только как растворимый гомотример, когда обнаруживается на поверхности клетки, он обнаруживается только как гетеротример с LTβ.[7]
LT-α оказывает значительное влияние на поддержание иммунной системы, включая развитие вторичные лимфоидные органы.[8][9] Отсутствие LT-α приводит к нарушению развития желудочно-кишечного тракта, предотвращает Патч Пейера развитие и приводит к дезорганизации селезенки.[10]
Как сигнальная молекула, LT-α участвует в регуляции выживаемости клеток, распространение, дифференциация, и апоптоз.[11] LT-α играет важную роль в врожденный иммунитет Было показано, что регулирование и его присутствие предотвращают рост опухоли и разрушают линии раковых клеток.[12] Напротив, нерегулируемая экспрессия LT-α может приводить к постоянно активному сигнальному пути, что приводит к неконтролируемому росту клеток и созданию опухоли.[11] Следовательно, в зависимости от контекста, LT-α может функционировать, предотвращая рост раковых клеток или способствуя развитию опухолей. Кроме того, эффекты LT-α зависят от типа органа, на который он действует, типа раковых клеток, клеточной среды, пола и времени действия во время иммунного ответа.[13][12]
Ген
Ген человека, кодирующий LT-α, был клонирован в 1985 году.[5][14] Ген LT-α расположен на хромосома 6 и находится в непосредственной близости от гена, кодирующего главный комплекс гистосовместимости.[15]
Структура
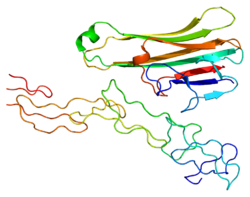
LT-α транслируется как гликозилированный полипептид массой 25 кДа со 171 аминокислотным остатком.[6] Кроме того, человеческий LT-α на 72% идентичен мышиному LT-α по первичной последовательности белка.[16]
Экспрессия LTα сильно индуцируется и при секретировании образует растворимую гомотримерную молекулу. LT-α может также образовывать гетеротримеры с лимфотоксин-бета, который прикрепляет лимфотоксин-альфа к поверхности клетки. Взаимодействие между LT-α и LT-β приводит к образованию мембраносвязанного комплекса (LT-α1-β2).[9]
Функция
Лимфотоксин альфа, член фактор некроза опухоли надсемейство, это цитокин, продуцируемый лимфоциты. LT-α1-β2 может взаимодействовать с рецепторами, такими как LT-β рецепторы.[11] Отсутствие LT-β на поверхности клеток снижает способность LT-α образовывать LT-α.1-β2, что снижает его эффективную способность как цитокин.[8][9] LT-α опосредует большое количество воспалительный, иммуностимулирующие и противовирусные реакции. LT-α также участвует в формировании вторичных лимфоидных органов во время развития и играет роль в апоптозе.[17]
В LT-α нокаутные мыши, Патчи Пейера лимфатические узлы не будут развиваться, что демонстрирует важную роль цитокинов в иммунологическом развитии.[18]
Как цитотоксический белок, LT-α вызывает разрушение линий раковых клеток, активирует сигнальные пути и эффективно убивает трансформированные опухолевые клетки.[8][11] Однако у мышей со сверхэкспрессией LT-α или LT-β наблюдался повышенный рост опухоли и метастаз в нескольких моделях рака. В других исследованиях мыши с нокаут гена LT-α показал усиленный рост опухоли, что указывает на возможную защитную роль LT-α при раке. Однако в этих исследованиях использовались мыши с полным дефицитом LT-α, что не позволяло отличить эффекты растворимых и связанных с мембранами LT.[19]
LT-опосредованный сигнальный путь
Как член Семья TNF, LT-α связывается с различными рецепторами и активирует Путь NF-κB, тем самым способствуя иммунной регуляции через врожденный иммунитет отклик.[11] Для того чтобы активация произошла, LT-α должен образовывать комплекс с LT-β, чтобы сформировать LT-α.1-β2 сложный. Формирование LT-α1-β2 комплекс обеспечивает связывание с рецепторами LT-β и последующую активацию сигнальных путей.[20] Активация сигнальных путей, таких как NF-κB, в конечном итоге приводит к различным клеточным судьбам, включая пролиферацию и гибель клеток. После активации рецептора LT-β продуцируются IKK-α, β и γ, что увеличивает деградацию I-κB, ингибитор NF-kB, и продуцируют NF-kB1 (p50) и ReIA (p60).[20] Продукция NF-kB1 и ReIA увеличивает скорость транскрипции генов цитокинов и молекул, вызывающих воспаление.[20][21]
Антиканцерогенные свойства
Активация рецепторов LT-β способна вызывать гибель раковых клеток и подавлять рост опухоли.[22][23] Процесс гибели клеток опосредуется присутствием IFN-γ и может включать апоптотические или некротические пути.[22] Видно, что рецепторы LT-β способствуют усилению регуляции молекул адгезии и привлекают лимфоциты к опухолевым клеткам для борьбы с ростом опухоли.[5][11] Другими словами, взаимодействия LT-α с рецепторами LT-β могут усиливать противоопухолевые эффекты за счет прямого разрушения опухолевых клеток.
Проканцерогенные свойства
Однако недавние исследования показали вклад опосредованной LT-α передачи сигналов в развитие рака.[8][11][12][13] Как упоминалось ранее, передача сигналов LT-α может способствовать воспалительным реакциям, но длительное воспаление может вызывать серьезные клеточные повреждения и повышать риск некоторых заболеваний, включая рак.[12] Таким образом, мутации в регуляторных факторах в сигнальных путях LT-α могут способствовать нарушениям передачи сигналов в клетках и стимулировать создание линий раковых клеток. Одна из этих мутаций включает постоянное связывание LT-α1-β2 комплекса с рецепторами LT-β, что приводит к постоянной активации альтернативного пути NF-κB.[11][12] Наличие конститутивно активного пути NF-κB проявляется в множественная миелома и другие заболевания, связанные с раком.[11] Удаление рецепторов LT-β ингибирует рост и уменьшение опухоли. ангиогенез.[12] Таким образом, лимфотоксин и его нисходящая передача сигналов через путь NF-κB иллюстрируют влияние цитокина на развитие опухоли и метастазирование.
Полностью гуманизированное антитело против LT-α (Патеклизумаб или MLTA3698A), как было показано, реагирует как с LT-α, так и с LT-β.[8] Клинические испытания с участием этого антитела еще предстоит провести, но создание этого антитела предлагает альтернативные методы ингибирования пути NF-κB.
Воздействие на желудочно-кишечный тракт
В иммунной системе желудочно-кишечного тракта содержится до 70-80% клеток организма, вырабатывающих антитела.[10] Во время эмбрионального развития передача сигналов LT-α играет активную роль в формировании иммунной системы желудочно-кишечного тракта.[10] В частности, передача сигналов, опосредованная LT-α, ответственна за развитие лимфоидных структур кишечника, таких как Патчи Пейера.[24][25] Этот лимфоидный фолликул кишечника играет важную роль в иммунной системе пищеварительного тракта.
Бляшки Пейера представляют собой узкоспециализированные лимфоидные узелки, расположенные в кишечнике. Они окружены фолликул-связанным эпителием и способны взаимодействовать с другими иммунными клетками через трансцитоз чужеродных антигенов.[26] Помимо этой функции патчи Пейера облегчают производство Ig-A продуцируют иммуноциты, тем самым повышая эффективность адаптивная иммунная система.[27]
Развитие пятен Пейера требует связывания и активации рецептора LT-β с помощью LT-α.1-β2 сложный. Эксперименты с участием трансгенных мышей показали, что отсутствие LT-α приводит к отсутствию пейеровских бляшек и других лимфатических узлов.[10] Отсутствие пейеровских бляшек и других лимфатических узлов также снижает уровень Ig-A.[10] Являясь наиболее продуцируемым иммуноглобулином, Ig-A защищает слизистую оболочку. патогены регулируя рост бактерий и ингибируя антиген адгезия в кишечник в нормальных условиях.[28] Снижение уровня Ig-A значительно снижает регуляцию иммунной системы кишечника и нарушает защиту от микробов, тем самым подчеркивая важность LT-опосредованного ответа для экспрессии Ig-A.
Номенклатура
Обнаруженный Грейнджером и его исследовательской группой в 1960 году, LT-альфа был известен как лимфотоксин.[29] С годами его название было изменено на фактор некроза опухоли-бета (TNF-β).[30] Позднее открытие LT-β и LT-α1-β2 Комплекс вызвал избавление от TNF-β и подразделение LT на два класса: LT-α и LT-β.[31][32]
Взаимодействия
Лимфотоксин альфа взаимодействовать с LTB.[33][34][35]
Смотрите также
Рекомендации
- ^ а б c ENSG00000223919, ENSG00000173503, ENSG00000226275, ENSG00000230279, ENSG00000238130, ENSG00000226979 GRCh38: выпуск Ensembl 89: ENSG00000231408, ENSG00000223919, ENSG00000S307930002 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000024402 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d Недвин Г.Е., Нейлор С.Л., Сакагути А.Ю., Смит Д., Джарретт-Недвин Дж., Пенника Д., Геддел Д.В., Грей П.В. (сентябрь 1985 г.). «Гены лимфотоксина и фактора некроза опухолей человека: структура, гомология и хромосомная локализация». Исследования нуклеиновых кислот. 13 (17): 6361–73. Дои:10.1093 / nar / 13.17.6361. ЧВК 321958. PMID 2995927.
- ^ а б Аггарвал BB, Eessalu TE, Hass PE (февраль 1986 г.). «Характеристика рецепторов фактора некроза опухолей человека и их регуляция гамма-интерфероном». Природа. 318 (6047): 665–7. Дои:10.1038 / 318665a0. PMID 3001529. S2CID 4341571.
- ^ Кальмон-Хамати, Флавия; Комб, Бернард; Хане, Майкл; Морель, Жак (2011). «Пересмотр лимфотоксина α: общие характеристики и последствия ревматоидного артрита». Исследования и лечение артрита. 13 (4): 232. Дои:10.1186 / ar3376. ISSN 1478-6354. ЧВК 3239340. PMID 21861866.
- ^ а б c d е Ruddle NH (апрель 2014 г.). «Лимфотоксин и TNF: как все начиналось - дань уважения путешественникам». Отзывы о цитокинах и факторах роста. 25 (2): 83–9. Дои:10.1016 / j.cytogfr.2014.02.001. ЧВК 4027955. PMID 24636534.
- ^ а б c Нго В. Н., Корнер Х., Ганн М. Д., Шмидт К. Н., Риминтон Д. С., Купер М. Д., Браунинг Дж. Л., Седжвик Дж. Д., Цистер Дж. Г. (январь 1999 г.). «Лимфотоксин альфа / бета и фактор некроза опухоли необходимы для экспрессии хемокинов в стромальных клетках в B- и T-клеточных областях селезенки». Журнал экспериментальной медицины. 189 (2): 403–12. Дои:10.1084 / jem.189.2.403. ЧВК 2192983. PMID 9892622.
- ^ а б c d е Губернаторова Е.О., Туманов А.В. (ноябрь 2016). «Фактор некроза опухоли и лимфотоксин в регуляции воспаления кишечника». Биохимия. Биохимия. 81 (11): 1309–1325. Дои:10.1134 / S0006297916110092. PMID 27914457. S2CID 15764230.
- ^ а б c d е ж грамм час я Бауэр Дж., Наминени С., Райзингер Ф, Цёллер Дж., Юань Д., Хайкенвельдер М. (01.01.2012). «Лимфотоксин, NF-B и рак: темная сторона цитокинов». Пищеварительные заболевания. 30 (5): 453–68. Дои:10.1159/000341690. PMID 23108301. S2CID 13165828.
- ^ а б c d е ж Fernandes MT, Dejardin E, dos Santos NR (апрель 2016 г.). «Контекстно-зависимая роль передачи сигналов рецептора лимфотоксина-β в развитии рака». Biochimica et Biophysica Acta (BBA) - Обзоры на рак. 1865 (2): 204–19. Дои:10.1016 / j.bbcan.2016.02.005. HDL:10400.1/9527. PMID 26923876.
- ^ а б Вонг Г. Х., Каспар Р. Л., Цвейгер Г., Карлсон К., Фонг С. Е., Эхсани Н., Вехар Г. (январь 1996 г.). «Стратегии манипулирования апоптозом для лечения рака с помощью фактора некроза опухоли и лимфотоксина». Журнал клеточной биохимии. 60 (1): 56–60. Дои:10.1002 / (SICI) 1097-4644 (19960101) 60: 1 <56 :: AID-JCB9> 3.0.CO; 2-2. PMID 8825416.
- ^ Похолок Д.К., Марулаков И.Г., Купраш Д.В., Алимжанов М.Б., Козлов С.В., Новобранцева Т.И., Турецкая Р.Л., Грин Ю.Е., Недоспасов С.А. (январь 1995 г.). «Клонирование и анализ экспрессии гена лимфотоксина бета мыши». Труды Национальной академии наук Соединенных Штатов Америки. 92 (3): 674–8. Bibcode:1995ПНАС ... 92..674П. Дои:10.1073 / пнас.92.3.674. ЧВК 42682. PMID 7846035.
- ^ Недоспасов С.А., Хирт Б., Шахов А.Н., Добрынин В.Н., Кавашима Э., Акколла Р.С., Джонженель К.В. (октябрь 1986 г.). «Гены фактора некроза опухоли (TNF-альфа) и лимфотоксина (TNF-бета) расположены тандемно на 17 хромосоме мыши». Исследования нуклеиновых кислот. 14 (19): 7713–25. Дои:10.1093 / nar / 14.19.7713. ЧВК 311791. PMID 3490653.
- ^ Pennica D, Nedwin GE, Hayflick JS, Seeburg PH, Derynck R, Palladino MA, Kohr WJ, Aggarwal BB, Goeddel DV (1984). «Фактор некроза опухоли человека: структура предшественника, экспрессия и гомология лимфотоксина». Природа. 312 (5996): 724–9. Bibcode:1984Натура.312..724П. Дои:10.1038 / 312724a0. PMID 6392892. S2CID 4245957.
- ^ «Ген Entrez: LTA лимфотоксин альфа (суперсемейство TNF, член 1)».
- ^ Акирав Э., Ляо С., Раддл Н. (2008). «Глава 2: Лимфоидные ткани и органы». В Paul W (ред.). Фундаментальная иммунология (6-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. стр.27–55. ISBN 978-0-7817-6519-0.
- ^ Корнеев К.В., Атретханы К.Н., Друцкая М.С., Гривенников С.И., Купраш Д.В., Недоспасов С.А. (январь 2017). «TLR-сигнализация и провоспалительные цитокины как драйверы онкогенеза». Цитокин. 89: 127–135. Дои:10.1016 / j.cyto.2016.01.021. PMID 26854213.
- ^ а б c Мюллер-младший, Siebenlist U (апрель 2003 г.). «Рецептор лимфотоксина бета индуцирует последовательную активацию различных факторов NF-каппа B через отдельные сигнальные пути». Журнал биологической химии. 278 (14): 12006–12. Дои:10.1074 / jbc.M210768200. PMID 12556537.
- ^ Йилмаз З. Б., Вей Д. С., Сивакумар В., Вей Ф. (январь 2003 г.). «RelB необходим для разработки пластыря Пейера: дифференциальная регуляция p52-RelB лимфотоксином и TNF». Журнал EMBO. 22 (1): 121–30. Дои:10.1093 / emboj / cdg004. ЧВК 140043. PMID 12505990.
- ^ а б Browning JL, Miatkowski K, Sizing I, Griffiths D, Zafari M, Benjamin CD, Meier W, Mackay F (март 1996). «Передача сигналов через рецептор лимфотоксина бета вызывает гибель некоторых опухолевых линий аденокарциномы». Журнал экспериментальной медицины. 183 (3): 867–78. Дои:10.1084 / jem.183.3.867. ЧВК 2192357. PMID 8642291.
- ^ Лукашев М., Лепаж Д., Уилсон С., Байи В., Гарбер Е., Лукашин А. и др. (Октябрь 2006 г.). «Нацеливание на рецептор лимфотоксина-бета с помощью антител-агонистов в качестве потенциальной терапии рака». Исследования рака. 66 (19): 9617–24. Дои:10.1158 / 0008-5472.CAN-06-0217. PMID 17018619.
- ^ Фу YX, Чаплин Д.Д. (01.01.1999). «Развитие и созревание вторичных лимфоидных тканей». Ежегодный обзор иммунологии. 17: 399–433. Дои:10.1146 / annurev.immunol.17.1.399. PMID 10358764.
- ^ Рэндалл Т.Д., Каррагер Д.М., Ранжел-Морено Дж. (01.01.2008). «Развитие вторичных лимфоидных органов». Ежегодный обзор иммунологии. 26: 627–50. Дои:10.1146 / annurev.immunol.26.021607.090257. ЧВК 2590644. PMID 18370924.
- ^ Cornes JS (июнь 1965 г.). "Количество, размер и распределение пейеровых бляшек в тонком кишечнике человека: Часть I Развитие пейеровых бляшек". Кишечник. 6 (3): 225–9. Дои:10.1136 / гут.6.3.225. ЧВК 1552287. PMID 18668776.
- ^ Craig SW, Cebra JJ (июль 1971 г.). «Пейеровы пятна: обогащенный источник предшественников иммуноцитов, продуцирующих IgA, у кроликов». Журнал экспериментальной медицины. 134 (1): 188–200. Дои:10.1084 / jem.134.1.188. ЧВК 2139023. PMID 4934147.
- ^ Фэгэрасан С., Хондзё Т. (январь 2003 г.). «Синтез IgA в кишечнике: регуляция передовых защитных сил организма». Обзоры природы. Иммунология. 3 (1): 63–72. Дои:10.1038 / nri982. PMID 12511876. S2CID 2586305.
- ^ Уильямс Т.В., Грейнджер Г.А. (сентябрь 1968 г.). «Цитотоксичность лимфоцитов in vitro: лимфотоксины нескольких видов млекопитающих». Природа. 219 (5158): 1076–7. Bibcode:1968Натура 219.1076W. Дои:10.1038 / 2191076a0. PMID 5673378. S2CID 4171855.
- ^ Shalaby MR, Aggarwal BB, Rinderknecht E, Svedersky LP, Finkle BS, Palladino MA (сентябрь 1985 г.). «Активация функций полиморфно-ядерных нейтрофилов человека под действием гамма-интерферона и факторов некроза опухоли». Журнал иммунологии. 135 (3): 2069–73. PMID 3926894.
- ^ Browning JL, Ngam-ek A, Lawton P, DeMarinis J, Tizard R, Chow EP, Hession C, O'Brine-Greco B, Foley SF, Ware CF (март 1993). «Лимфотоксин бета, новый член семейства TNF, который образует гетеромерный комплекс с лимфотоксином на поверхности клетки». Клетка. 72 (6): 847–56. Дои:10.1016 / 0092-8674 (93) 90574-а. PMID 7916655. S2CID 28961163.
- ^ Кони П.А., Сакка Р., Лоутон П., Браунинг Дж. Л., Раддл Н.Х., Флавелл Р.А. (апрель 1997 г.). «Отчетливые роли в лимфоидном органогенезе лимфотоксинов альфа и бета выявлены у мышей с дефицитом лимфотоксина бета». Иммунитет. 6 (4): 491–500. Дои:10.1016 / с1074-7613 (00) 80292-7. PMID 9133428.
- ^ Уильямс-Эбботт Л., Уолтер Б.Н., Чунг Т.С., Го С.Р., Портер АГ, Уэр С.Ф. (август 1997 г.). «Субъединица лимфотоксина-альфа (LTalpha) необходима для сборки, но не для рецепторной специфичности, закрепленного на мембране гетеротримерного лиганда LTalpha1beta2». Журнал биологической химии. 272 (31): 19451–6. Дои:10.1074 / jbc.272.31.19451. PMID 9235946.
- ^ Browning JL, Sizing ID, Lawton P, Bourdon PR, Rennert PD, Majeau GR, Ambrose CM, Hession C, Miatkowski K, Griffiths DA, Ngam-ek A, Meier W, Benjamin CD, Hochman PS (октябрь 1997 г.). «Характеристика комплексов лимфотоксин-альфа бета на поверхности лимфоцитов мышей». Журнал иммунологии. 159 (7): 3288–98. PMID 9317127.
- ^ Браунинг Дж. Л., Дугас И., Нгам-эк А., Бурдон П. Р., Эренфельс Б. Н., Мятковски К., Зафари М., Ямпалья А. М., Лоутон П., Мейер В. (январь 1995 г.). «Характеристика поверхностных форм лимфотоксина. Использование специфических моноклональных антител и растворимых рецепторов». Журнал иммунологии. 154 (1): 33–46. PMID 7995952.
дальнейшее чтение
- Кёрнер Х., Седжвик Дж. Д. (октябрь 1996 г.). «Фактор некроза опухоли и лимфотоксин: молекулярные аспекты и роль в тканеспецифическом аутоиммунитете». Иммунология и клеточная биология. 74 (5): 465–72. Дои:10.1038 / icb.1996.77. PMID 8912010. S2CID 22305752.
- Ван Кью (май 2005 г.). «Молекулярная генетика ишемической болезни сердца». Текущее мнение в кардиологии. 20 (3): 182–8. Дои:10.1097 / 01.hco.0000160373.77190.f1. ЧВК 1579824. PMID 15861005.
- Коупленд К.Ф. (декабрь 2005 г.). «Модуляция транскрипции ВИЧ-1 цитокинами и хемокинами». Мини-обзоры по медицинской химии. 5 (12): 1093–101. Дои:10.2174/138955705774933383. PMID 16375755.
- Elewaut D, Ware CF (апрель 2007 г.). «Нетрадиционная роль LT-альфа-бета в дифференцировке Т-клеток». Тенденции в иммунологии. 28 (4): 169–75. Дои:10.1016 / j.it.2007.02.005. PMID 17336158.