WikiDer > Фактор роста эндотелия сосудов С
Фактор роста эндотелия сосудов С (VEGF-C) это белок это член фактор роста тромбоцитов / фактор роста эндотелия сосудов (PDGF / VEGF) семейство. Он кодируется у человека VEGFC ген, который расположен на хромосоме 4q34.[4]
Функции
Основная функция VEGF-C - способствовать росту лимфатические сосуды (лимфангиогенез). Он действует на лимфатический эндотелиальный клетки (LEC) в первую очередь через рецептор VEGFR-3 содействие выживанию, росту и миграции. Он был открыт в 1996 году в качестве лиганда орфанного рецептора VEGFR-3.[5] Вскоре после этого было показано, что он является специфическим фактором роста лимфатических сосудов в различных моделях.[6][7] Однако, помимо воздействия на лимфатические сосуды, он также может способствовать росту кровеносных сосудов и регулировать их проницаемость. Воздействие на кровеносные сосуды может быть опосредовано его первичным рецептором VEGFR-3.[8] или его вторичный рецептор VEGFR-2. Помимо сосудистых мишеней, VEGF-C также важен для развития нервной системы.[9] и регулирование артериального давления.[10] Было высказано предположение, что VEGFC является морфогеном, но не хемотаксическим фактором предшественников лимфатических эндотелиальных клеток.[11]
Было высказано предположение, что VEGFC может образовывать Паттерны Тьюринга регулировать лимфангиогенез в данио эмбрион, взаимодействуя с коллаген I и MMP2 .[12]
Биосинтез
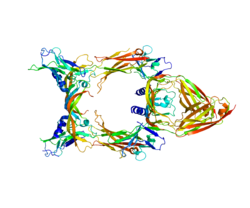
VEGF-C представляет собой димерный секретируемый белок, который подвергается сложному протеолитическому созреванию, что приводит к множественным процессинговым формам. После перевод, VEGF-C состоит из трех доменов: центрального гомологического домена VEGF (VHD), N-концевого домена (пропептид) и C-концевого домена (пропептида).[13] Он называется «нерасщепленный VEGF-C» и имеет размер приблизительно 58 кДа. Первое расщепление (которое происходит уже до секреции) происходит между VHD и C-концевым доменом и опосредуется пропротеин конвертазы.[14] Однако полученный белок по-прежнему удерживается дисульфидные связи и остается неактивным (хотя уже может связывать VEGFR-3).[15] Эта форма называется «промежуточной формой» или про-VEGF-C и состоит из двух полипептидных цепей 29 и 31 кДа. Чтобы активировать VEGF-C, должно произойти второе расщепление между N-концевым пропептидом и VHD. Это расщепление может быть выполнено либо ADAMTS3,[15] плазмин,[16] KLK3 /PSA или же катепсин D.[17] По мере прогрессирования созревания сродство VEGF-C как к VEGFR-2, так и к VEGFR-3 увеличивается, и только полностью обработанные зрелые формы VEGF-C обладают значительным сродством к VEGFR-2.[13]
Связь с VEGF-D
Ближайшим структурным и функциональным родственником VEGF-C является VEGF-D.[18] Однако, по крайней мере, у мышей VEGF-C абсолютно необходим для развития лимфатическая система,[19] тогда как в VEGF-D нет необходимости.[20] Верно ли это для людей, неизвестно, потому что существуют серьезные различия между человеческим и мышиным VEGF-D.[21]
Актуальность болезни
В меньшинстве лимфедема пациенты, состояние вызвано мутациями в гене VEGFC[22] и VEGF-C является потенциальным средством лечения лимфедема,[23][24] даже если основная молекулярная причина чаще появляется в VEGF-рецептор-3 вместо самого VEGF-C.[25] Потому что в Болезнь Милроя (Наследственная лимфедема I типа), мутирован только один аллель, не все молекулы VEGFR-3 нефункциональны, и считается, что большое количество VEGF-C может компенсировать мутированные нефункциональные рецепторы за счет увеличения уровней передачи сигналов оставшиеся функциональные рецепторы.[26] Поэтому VEGF-C разработан как лекарство от лимфедемы под названием лимфактин.[27] Также косвенно VEGF-C может быть ответственным за наследственную лимфедему. Синдром Хеннекама может быть результатом неспособности мутировавшего CCBE1 чтобы помочь ADAMTS3 протеаза в активации VEGF-C.[15] В то время как недостаток VEGF-C приводит к лимфедему, продукция VEGF-C участвует в лимфангиогенезе опухоли и метастаз. Экспрессия VEGF-C опухолями индуцирует пери-опухолевый и внутриопухолевый лимфангиогенез, что сильно способствует метастатическому распространению опухолевых клеток.[28][29] VEGF-C в первую очередь стимулирует лимфангиогенез, активируя VEGFR-3, но при определенных условиях он также может действовать непосредственно на кровеносные сосуды, способствуя ангиогенезу опухоли.[8][30]
Эволюция
В PDGF семейство настолько тесно связано с семейством VEGF, что их иногда объединяют в семейство PDGF / VEGF. У беспозвоночных молекулы из этого семейства нелегко отличить друг от друга и все вместе называются PVF (PDGF / VEGF-подобные факторы роста.[31] Сравнение человеческих VEGF с этими PVF позволяет сделать выводы о структуре предковых молекул, которые кажутся более близкими к сегодняшнему лимфангиогенному VEGF-C, чем к другим членам семейства VEGF, и, несмотря на их большое эволюционное расстояние, все еще могут взаимодействовать с рецепторы человеческого VEGF. ПВФ в Drosophila melanogaster есть функции для миграции гемоциты[32] и PVF в медузах Podocoryne carnea для развития щупалец и желудочно-сосудистого аппарата.[33] Однако функция PVF-1 нематоды Caenorhabditis elegans неизвестно[31]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000150630 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Паавонен К., Хорелли-Куйтунен Н., Чилов Д., Кукк Э., Пеннанен С., Каллиониеми О.П. и др. (Март 1996 г.). «Новые гены фактора роста эндотелия сосудов человека VEGF-B и VEGF-C локализуются в хромосомах 11q13 и 4q34 соответственно». Тираж. 93 (6): 1079–82. Дои:10.1161 / 01.CIR.93.6.1079. PMID 8653826.
- ^ Жуков В., Паюсола К., Кайпайнен А., Чилов Д., Лахтинен И., Кукк Е. и др. (Январь 1996 г.). «Новый фактор роста эндотелия сосудов, VEGF-C, является лигандом для тирозинкиназ рецепторов Flt4 (VEGFR-3) и KDR (VEGFR-2)». Журнал EMBO. 15 (2): 290–98. Дои:10.1002 / j.1460-2075.1996.tb00359.x. ЧВК 449944. PMID 8617204.
- ^ Oh SJ, Jeltsch MM, Birkenhäger R, McCarthy JE, Weich HA, Christ B, et al. (Август 1997 г.). «VEGF и VEGF-C: специфическая индукция ангиогенеза и лимфангиогенеза в дифференцированной хориоаллантоисной мембране птиц». Биология развития. 188 (1): 96–109. Дои:10.1006 / dbio.1997.8639. PMID 9245515.
- ^ Jeltsch M, Kaipainen A, Joukov V, Meng X, Lakso M, Rauvala H, et al. (Май 1997 г.). «Гиперплазия лимфатических сосудов у трансгенных мышей VEGF-C». Наука. 276 (5317): 1423–5. Дои:10.1126 / science.276.5317.1423. PMID 9162011. S2CID 21835142.
- ^ а б Таммела Т., Заркада Г., Валлгард Э., Муртомаки А., Сухтинг С., Вирзениус М. и др. (Июль 2008 г.). «Блокирование VEGFR-3 подавляет ангиогенное разрастание и образование сосудистой сети». Природа. 454 (7204): 656–60. Bibcode:2008Натура.454..656Т. Дои:10.1038 / природа07083. PMID 18594512. S2CID 2251527.
- ^ Ле Бра Б., Бараллобре М.Дж., Хомман-Людие Дж., Нью-Йорк А., Винс С., Таммела Т. и др. (Март 2006 г.). «VEGF-C является трофическим фактором для нейральных предшественников в эмбриональном мозге позвоночных». Природа Неврология. 9 (3): 340–8. Дои:10.1038 / nn1646. PMID 16462734. S2CID 24197350.
- ^ Махник А., Нойхофер В., Янч Дж., Дальманн А., Таммела Т., Махура К. и др. (Май 2009 г.). «Макрофаги регулируют зависящий от соли объем и кровяное давление с помощью механизма буферизации, зависимого от фактора роста С сосудистого эндотелия». Природа Медицина. 15 (5): 545–52. Дои:10,1038 / нм 1960. PMID 19412173. S2CID 10526891.
- ^ Вертхайм К.Ю., Рус Т. (апрель 2017 г.). «Математическая модель лимфангиогенеза в эмбрионе рыбок данио». Вестник математической биологии. 79 (4): 693–737. Дои:10.1007 / s11538-017-0248-7. ЧВК 5501200. PMID 28233173.
- ^ Вертхайм К.Ю., Рус Т. (апрель 2019 г.). "Может ли VEGFC формировать паттерны Тьюринга у эмбрионов рыбок данио?". Вестник математической биологии. 81 (4): 1201–1237. Дои:10.1007 / s11538-018-00560-2. ЧВК 6397306. PMID 30607882.
- ^ а б Жуков В., Сорса Т., Кумар В., Елч М., Клаессон-Уэлш Л., Цао Ю. и др. (Июль 1997 г.). «Протеолитический процессинг регулирует рецепторную специфичность и активность VEGF-C». Журнал EMBO. 16 (13): 3898–911. Дои:10.1093 / emboj / 16.13.3898. ЧВК 1170014. PMID 9233800.
- ^ Зигфрид Дж., Басак А., Кромлиш Дж. А., Бенджаннет С., Марцинкевич Дж., Кретьен М. и др. (Июнь 2003 г.). «Секреторный пропротеин конвертирует фурин, PC5 и PC7, активируя VEGF-C для индукции туморогенеза». Журнал клинических исследований. 111 (11): 1723–32. Дои:10.1172 / JCI17220. ЧВК 156106. PMID 12782675.
- ^ а б c Jeltsch M, Jha SK, Tvorogov D, Anisimov A, Leppänen VM, Holopainen T, et al. (Май 2014 г.). «CCBE1 усиливает лимфангиогенез через дезинтегрин A и металлопротеазу с опосредованной тромбоспондиновыми мотивами-3 активацией фактора роста эндотелия сосудов-C». Тираж. 129 (19): 1962–71. Дои:10.1161 / CIRCULATIONAHA.113.002779. PMID 24552833.
- ^ Макколл Б.К., Болдуин М.Э., Руфейл С., Фриман С., Мориц Р.Л., Симпсон Р.Дж. и др. (Сентябрь 2003 г.). «Плазмин активирует лимфангиогенные факторы роста VEGF-C и VEGF-D». Журнал экспериментальной медицины. 198 (6): 863–8. Дои:10.1084 / jem.20030361. ЧВК 2194198. PMID 12963694.
- ^ Jha SK, Rauniyar K, Chronowska E, Mattonet K, Maina EW, Koistinen H, et al. (Май 2019 г.). «KLK3 / PSA и катепсин D активируют VEGF-C и VEGF-D». eLife. 8: –44478. Дои:10.7554 / eLife.44478. ЧВК 6588350. PMID 31099754.
- ^ Ахен М.Г., Елч М., Кукк Э., Мякинен Т., Витали А., Уилкс А.Ф. и др. (Январь 1998 г.). «Фактор роста эндотелия сосудов D (VEGF-D) является лигандом тирозинкиназ, рецептор 2 VEGF (Flk1) и рецептор 3 VEGF (Flt4)». Труды Национальной академии наук Соединенных Штатов Америки. 95 (2): 548–53. Bibcode:1998ПНАС ... 95..548А. Дои:10.1073 / пнас.95.2.548. ЧВК 18457. PMID 9435229.
- ^ Карккайнен М.Дж., Хайко П., Сайнио К., Партанен Дж., Тайпале Дж., Петрова Т.В. и др. (Январь 2004 г.). «Фактор роста эндотелия сосудов С необходим для прорастания первых лимфатических сосудов из вен эмбриона». Иммунология природы. 5 (1): 74–80. Дои:10.1038 / ni1013. PMID 14634646. S2CID 22078757.
- ^ Болдуин М.Э., Халфорд М.М., Руфейл С., Уильямс Р.А., Хиббс М.Л., Грааль Д. и др. (Март 2005 г.). «Фактор роста эндотелия сосудов D необходим для развития лимфатической системы». Молекулярная и клеточная биология. 25 (6): 2441–9. Дои:10.1128 / MCB.25.6.2441-2449.2005. ЧВК 1061605. PMID 15743836.
- ^ Болдуин, ME, Catimel B, Nice EC, Roufail S, Hall NE, Stenvers KL, et al. (Июнь 2001 г.). «Специфичность связывания рецептора фактором роста эндотелия сосудов d у мышей и людей различна». Журнал биологической химии. 276 (22): 19166–71. Дои:10.1074 / jbc.M100097200. PMID 11279005. S2CID 41677159.
- ^ Бальбоа-Бельтран Э., Фернандес-Сеара М.Дж., Перес-Муньузури А., Лаго Р., Гарсия-Маган С., Коус М.Л. и др. (Июль 2014 г.). «Новая стоп-мутация в гене фактора роста эндотелия сосудов С (VEGFC) приводит к болезни Милроя». Журнал медицинской генетики. 51 (7): 475–8. Дои:10.1136 / jmedgenet-2013-102020. PMID 24744435. S2CID 6613861.
- ^ Энхольм Б., Карпанен Т., Йельч М., Кубо Х., Стенбак Ф., Прево Р. и др. (Март 2001 г.). «Аденовирусная экспрессия фактора роста эндотелия сосудов-С индуцирует лимфангиогенез в коже». Циркуляционные исследования. 88 (6): 623–9. Дои:10.1161 / 01.RES.88.6.623. PMID 11282897. S2CID 28806663.
- ^ Honkonen KM, Visuri MT, Tervala TV, Halonen PJ, Koivisto M, Lähteenvuo MT и др. (Май 2013). «Перенос лимфатических узлов и лечение перинодальным лимфатическим фактором роста лимфедемы». Анналы хирургии. 257 (5): 961–7. Дои:10.1097 / SLA.0b013e31826ed043. PMID 23013803. S2CID 2042145.
- ^ Бруйяр П., Бун Л., Виккула М. (март 2014 г.). «Генетика лимфатических аномалий». Журнал клинических исследований. 124 (3): 898–904. Дои:10.1172 / JCI71614. ЧВК 3938256. PMID 24590274.
- ^ Карккайнен М.Дж., Сааристо А., Юссила Л., Карила К.А., Лоуренс Е.К., Паюсола К. и др. (Октябрь 2001 г.). «Модель генной терапии наследственной лимфедемы человека». Труды Национальной академии наук Соединенных Штатов Америки. 98 (22): 12677–82. Bibcode:2001PNAS ... 9812677K. Дои:10.1073 / pnas.221449198. ЧВК 60113. PMID 11592985.
- ^ Herantis Pharma (21 июля 2014 г.). «Лимфактин® от лимфедемы». Отсутствует или пусто
| url =(помощь) - ^ Скобе М., Хавигорст Т., Джексон Д.Г., Прево Р., Джейнс Л., Веласко П. и др. (Февраль 2001 г.). «Индукция лимфангиогенеза опухоли с помощью VEGF-C способствует метастазированию рака груди». Природа Медицина. 7 (2): 192–8. Дои:10.1038/84643. PMID 11175850. S2CID 26090359.
- ^ Mandriota SJ, Jussila L, Jeltsch M, Compagni A, Baetens D, Prevo R и др. (Февраль 2001 г.). «Лимфангиогенез, опосредованный фактором роста эндотелия сосудов С, способствует метастазированию опухоли». Журнал EMBO. 20 (4): 672–82. Дои:10.1093 / emboj / 20.4.672. ЧВК 145430. PMID 11179212.
- ^ Творогов Д., Анисимов А., Чжэн В., Леппянен В.М., Таммела Т., Лауринавичюс С. и др. (Декабрь 2010 г.). «Эффективное подавление образования сосудистой сети за счет комбинации антител, блокирующих связывание лиганда VEGFR и димеризацию рецептора». Раковая клетка. 18 (6): 630–40. Дои:10.1016 / j.ccr.2010.11.001. PMID 21130043.
- ^ а б Tarsitano M, De Falco S, Colonna V, McGhee JD, Persico MG (февраль 2006 г.). «Ген pvf-1 C. elegans кодирует PDGF / VEGF-подобный фактор, способный связывать рецепторы VEGF млекопитающих и индуцировать ангиогенез». Журнал FASEB. 20 (2): 227–33. Дои:10.1096 / fj.05-4147com. PMID 16449794. S2CID 31963203.
- ^ Heino TI, Kärpänen T., Wahlström G, Pulkkinen M, Eriksson U, Alitalo K, Roos C (ноябрь 2001 г.). «Гомолог рецептора VEGF дрозофилы экспрессируется в гемоцитах». Механизмы развития. 109 (1): 69–77. Дои:10.1016 / S0925-4773 (01) 00510-X. PMID 11677054. S2CID 14074572.
- ^ Зайпель К., Эберхардт М., Мюллер П., Пеша Э., Янце Н., Шмид В. (октябрь 2004 г.). «Гомологи фактора роста и рецептора эндотелия сосудов, VEGF и VEGFR, у медузы Podocoryne carnea». Динамика развития. 231 (2): 303–12. Дои:10.1002 / dvdy.20139. PMID 15366007. S2CID 42930371.
дальнейшее чтение
- Раунияр К., Джа С.К., Йельч М. (февраль 2018 г.). «Биология фактора роста эндотелия сосудов С в морфогенезе лимфатических сосудов». Границы биоинженерии и биотехнологии. 6: 7. Дои:10.3389 / fbioe.2018.00007. ЧВК 5816233. PMID 29484295.
- Кребс Р., Йельч М. (июнь 2013 г.). «Лимфангиогенные факторы роста VEGF-C и VEGF-D. Часть 1: Основные принципы и эмбриональное развитие» (PDF). Лимфология в Forschung und Praxis. 17 (1): 30–37.
- Krebs R, Jeltsch M (декабрь 2013 г.). "Умрите лимфангиогенные факторы роста VEGF-C и VEGF-D. Часть 2: Роль VEGF-C и VEGF-D в заболеваниях лимфатической системы" (PDF). Лимфология в Forschung und Praxis. 17 (2): 96–104.
- Орпана А., Сальвен П. (февраль 2002 г.). «Ангиогенные и лимфангиогенные молекулы при гематологических злокачественных новообразованиях». Лейкемия и лимфома. 43 (2): 219–24. Дои:10.1080/10428190290005964. PMID 11999550. S2CID 21908151.
- Орпана А., Сальвен П. (февраль 2002 г.). «Ангиогенные и лимфангиогенные молекулы при гематологических злокачественных новообразованиях». Лейкемия и лимфома. 43 (2): 219–24. Дои:10.1080/10428190290005964. PMID 11999550. S2CID 21908151.
- Жуков В., Паюсола К., Кайпайнен А., Чилов Д., Лахтинен И., Кукк Е. и др. (Январь 1996 г.). «Новый фактор роста эндотелия сосудов, VEGF-C, является лигандом для тирозинкиназ рецепторов Flt4 (VEGFR-3) и KDR (VEGFR-2)». Журнал EMBO. 15 (2): 290–98. Дои:10.1002 / j.1460-2075.1996.tb00359.x. ЧВК 449944. PMID 8617204.
- Жуков В., Паюсола К., Кайпайнен А., Чилов Д., Лахтинен И., Кукк Е. и др. (Апрель 1996 г.). «Новый фактор роста эндотелия сосудов, VEGF-C, является лигандом для тирозинкиназ рецепторов Flt4 (VEGFR-3) и KDR (VEGFR-2)». Журнал EMBO. 15 (7): 1751. Дои:10.1002 / j.1460-2075.1996.tb00521.x. ЧВК 450088. PMID 8612600.
- Паавонен К., Хорелли-Куйтунен Н., Чилов Д., Кукк Э., Пеннанен С., Каллиониеми О.П. и др. (Март 1996 г.). «Новые гены фактора роста эндотелия сосудов человека VEGF-B и VEGF-C локализуются в хромосомах 11q13 и 4q34 соответственно». Тираж. 93 (6): 1079–82. Дои:10.1161 / 01.cir.93.6.1079. PMID 8653826.
- Ли Дж., Грей А., Юань Дж., Луох С.М., Авраам Х., Вуд В.И. (март 1996 г.). «Белок, связанный с фактором роста эндотелия сосудов: лиганд и специфический активатор рецептора тирозинкиназы Flt4». Труды Национальной академии наук Соединенных Штатов Америки. 93 (5): 1988–92. Bibcode:1996PNAS ... 93.1988L. Дои:10.1073 / пнас.93.5.1988. ЧВК 39896. PMID 8700872.
- Жуков В., Сорса Т., Кумар В., Елч М., Клаессон-Уэлш Л., Цао Ю. и др. (Июль 1997 г.). «Протеолитический процессинг регулирует рецепторную специфичность и активность VEGF-C». Журнал EMBO. 16 (13): 3898–911. Дои:10.1093 / emboj / 16.13.3898. ЧВК 1170014. PMID 9233800.
- Фитц Л.Дж., Моррис Дж. С., Таулер П., Лонг А., Берджесс П., Греко Р. и др. (Июль 1997 г.). «Характеристика мышиного лиганда Flt4 / VEGF-C». Онкоген. 15 (5): 613–8. Дои:10.1038 / sj.onc.1201191. PMID 9247316. S2CID 6795440.
- Дунк С., Ахмед А. (апрель 2001 г.). «Экспрессия VEGF-C и активация его рецепторов VEGFR-2 и VEGFR-3 в трофобласте». Гистология и гистопатология. 16 (2): 359–75. Дои:10.14670 / HH-16.359. PMID 11332691.
- Диас С., Чой М., Алитало К., Рафии С. (март 2002 г.). «Передача сигналов фактора роста эндотелия сосудов (VEGF) -C через FLT-4 (VEGFR-3) опосредует пролиферацию лейкозных клеток, выживаемость и устойчивость к химиотерапии». Кровь. 99 (6): 2179–84. Дои:10.1182 / blood.V99.6.2179. PMID 11877295.
- Ueda M, Terai Y, Yamashita Y, Kumagai K, Ueki K, Yamaguchi H, et al. (Март 2002 г.). «Корреляция между экспрессией фактора роста эндотелия С сосудов и фенотипом инвазии в карциномах шейки матки». Международный журнал рака. 98 (3): 335–43. Дои:10.1002 / ijc.10193. PMID 11920583. S2CID 10276013.
- Витте Д., Томас А., Али Н., Карлсон Н., Юнес М. (2002). «Экспрессия рецептора фактора роста эндотелия сосудов-3 (VEGFR-3) и его лиганда VEGF-C в колоректальной аденокарциноме человека». Противораковые исследования. 22 (3): 1463–6. PMID 12168824.
- Шоппманн С.Ф., Бирнер П., Штёкль Дж., Кальт Р., Ульрих Р., Каусиг С. и др. (Сентябрь 2002 г.). «Связанные с опухолью макрофаги экспрессируют факторы роста лимфатического эндотелия и связаны с перитуморальным лимфангиогенезом». Американский журнал патологии. 161 (3): 947–56. Дои:10.1016 / S0002-9440 (10) 64255-1. ЧВК 1867252. PMID 12213723.
- Shin HY, Smith ML, Toy KJ, Williams PM, Bizios R, Gerritsen ME (декабрь 2002 г.). «VEGF-C опосредует индуцированную циклическим давлением пролиферацию эндотелиальных клеток». Физиологическая геномика. 11 (3): 245–51. Дои:10.1152 / физиолгеномика.00068.2002. PMID 12388793. S2CID 14183060.
- Yu DH, Wen YM, Sun JD, Wei SL, Xie HP, Pang FH (март 2002 г.). «[Взаимосвязь между экспрессией фактора роста эндотелия сосудов-C (VEGF-C), ангиогенезом, лимфангиогенезом и лимфатическими метастазами при раке полости рта]». AI Zheng = Aizheng = Китайский журнал рака. 21 (3): 319–22. PMID 12452004.
- Накашима Т., Кондо С., Китох Х, Одзава Х, Окита С., Харада Т. и др. (Январь 2003 г.). «Экспрессия фактора роста эндотелия сосудов С при раке желчного пузыря человека и его связь с метастазами в лимфатические узлы». Международный журнал молекулярной медицины. 11 (1): 33–9. Дои:10.3892 / ijmm.11.1.33. PMID 12469214.
- Цай П.В., Шиа С.Г., Линь М.Т., Ву К.В., Куо М.Л. (февраль 2003 г.). «Повышение регуляции фактора роста эндотелия сосудов С в клетках рака молочной железы с помощью бета-1 херегулина. Критическая роль пути передачи сигналов p38 / ядерный фактор-каппа B». Журнал биологической химии. 278 (8): 5750–9. Дои:10.1074 / jbc.M204863200. PMID 12471041. S2CID 40780576.
- Масуд Р., Кундра А., Чжу С., Ся Дж., Скалия П., Смит Д.Л., Гилл П.С. (май 2003 г.). «Подавление роста злокачественной мезотелиомы агентами, которые нацелены на аутокринные петли VEGF и VEGF-C». Международный журнал рака. 104 (5): 603–10. Дои:10.1002 / ijc.10996. PMID 12594815. S2CID 23085374.
- Оно М., Накамура Т., Кунимото Ю., Нисимура К., Чунг-Канг С., Курода Ю. (2004). «Лимфагенез коррелирует с экспрессией фактора роста эндотелия сосудов С при колоректальном раке». Отчеты онкологии. 10 (4): 939–43. Дои:10.3892 / или 10.4.939. PMID 12792749.