WikiDer > Стероидный ингибитор ароматазы
Стероидный ингибиторы ароматазы являются классом наркотики которые в основном используются для лечения рак молочной железы в постменопаузальный женщины. Высокий уровень эстроген в ткани груди увеличивает риск развития рака груди и фермент ароматаза считается хорошим терапевтическая цель при лечении рака груди, поскольку он участвует в последней стадии выработки эстрогена биосинтетический путь, а также его ингибирование не повлияет на продукцию других стероиды. Ингибиторы ароматазы делятся на две категории в зависимости от их структуры: нестероидные и стероидные; последние напоминают структуру андростендион.[1] Стероидные ингибиторы ароматазы необратимо ингибируют фермент, ковалентно связываясь с участком связывания ароматазы, поэтому субстрат не может получить к нему доступ.[2]
История
Сотрудничество, ведущее к открытию
В 1944 г. Фонд Вустера для экспериментальной биологии (WFEB). Фонд был центром сотрудничества многих ученых, заинтересованных в репродукции. нейрофизиология и биохимия стероидов. Одной из фундаментальных работ было понимание механизма преобразования андрогены к эстрогены. Группа работала над пониманием биосинтез и метаболизм стероидов, производимых надпочечники, яички и яичники. Андре Мейер позже предположил, что ароматизация андростендион был ферментативным, и это было доказано в 1980-х годах при очистке ароматазы.[3] В начале 1970-х годов исследователи согласились с тем фактом, что ароматизации кольца А способствует цитохром P450-опосредованный фермент, доказанный блокадой аминоглутетимид (AG, как известно, блокирует ферменты, опосредованные P450.[3]
Гарри и Анжела Броди
Гарри Броди, химик, присоединился к группе WFEB и начал работать над пониманием стериохимии водород устранение в позиции C-1 во время ароматизации. Его механистические исследования привели его к признанию терапевтического потенциала нацеливания на ароматазу, и в начале 1970-х он начал разработку селективных ингибиторов ароматазы.[3] Сотрудничество с женой Анжела Броуди заставил их сообщить в 1973 году о первой серии этих соединений.[4] Они провели систематические исследования структуры / функций почти 100 стероидных ингибиторов ароматазы, которые привели к открытию 4-гидроксиандростендиона (4-OH-A), мощного селективного ингибитора ароматазы.[3]
Переход к лечению рака груди и клиническим испытаниям
После того, как Броди продемонстрировали снижение уровня эстрогена у грызунов и его биологическую эффективность с регресс Осенью 1981 года Анджела Броди поехала в Рим, чтобы рассказать о своем исследовании. На презентации был Чарльз Кумбс медицинский онколог который выразил заинтересованность в проведении клинических испытаний с 4-гидроксиандростендионом (4-OH-A) для лечения рака груди.[4] Сотрудничество Анжелы Броди и клинического онколога Чарльза Кумбса, Пол Госс клинический онголог и Митч Доусетт клинический химик и сделал это возможным. Дальнейшая клиническая разработка была проведена с помощью Ciba-Geigy (теперь Novartis), (4-OH-A) с новым названием. Форместан.[3] В 1993 году на рынке был представлен форместан как ленатрон с индикаторами распространенного рака у женщин в постменопозном периоде, первый селективный ингибитор ароматазы, который сделал это.[5]
Из-за неблагоприятных свойств 4-ОН-А плохое пероральное биодоступность и неблагоприятный метаболизм, группа под руководством Э. Ди Салле и П. Ломбарди в Фармиталия-Карло Эрба (часть Pfizer) начал работу над новым селективным ингибитором ароматазы. Группа разработала, синтезировала и оценила новый новый стероид, Экземестан. Экземестан прошел клинические испытания в 1990-х годах и получил FDA одобрение в 1999 году, продается как Aromasin. Показанием для применения экземестана является распространенный рак груди у женщин в постменопаузе, когда рак прогрессировал после терапии тамоксифеном. Экземестан - первый пероральный инактиватор ароматазы.[5]
Стероидные ингибиторы ароматазы сегодня
Клиническое использование стероидных ингибиторов ароматазы сегодня более или менее ограничено экземестаном. Использование форместана (лентарона) очень ограничено, и в некоторых странах он больше не используется. Форместан был заменен более новыми и лучшими ингибиторами с лучшей пероральной доступностью и меньшим количеством побочных эффектов, экземестаном и новым поколением препаратов. нестероидный ингибиторы ароматазы.[4]
Клиническое использование
Рак
Большинство видов рака молочной железы гормонально зависимы, и большинство из них выражаются либорецептор эстрогена и / или рецептор прогестерона.[6][7][8] Это причина того, что соединения, которые ингибируют биосинтез эстрогена, были исследованы и теперь являются стандартом. адъювантная терапия для рака груди в постменопаузальный женщины.[6][7] Было доказано, что рак груди у женщин в постменопаузе можно лечить или предотвращать путем регулирования эстрогенрецепторы или их лиганды, и поскольку ароматаза является частью заключительного этапа конверсии эстрогена, она является хорошей мишенью для медицины. Поскольку ароматаза катализирует финальный этап эстроген конверсия, подавляя ее, не оказывает никакого влияния на синтез других стероидов, кроме эстрогена.[7]
У женщин в постменопаузе выработка эстрогена в яичниках прекращена. Таким образом, основным источником эстрогенов является ароматизация андрогенов, вырабатываемых надпочечниками.[7] Продукция эстрогена у женщин в постменопаузе в основном происходит в периферической жировой ткани.[6] Мозг, кожа, жировая ткань, нормальныйткани молочной железы и рак молочной железы клетки содержат ароматазу, но эстроген, который синтезируется в ткани груди и вокруг раковых клеток, влияет на рост рака. Ингибиторы ароматазы останавливают это преобразование и снижают уровень эстрогена.[7]
Лечение рака груди с помощью ингибиторы ароматазы эффективен только у женщин в постменопаузе из-за высоких уровней лигандов ароматазы (субстрата) в яичниках женщин в пременопаузе. Подавляя ароматаза у женщин в пременопаузе уровень эстрогена снижается на короткое время, но это приводит к активации гипоталамус и ось гипофиза, которые способствуют гонадотропин секреция, вызывающая повышение эстроген уровни за счет стимуляции яичников.[2][7]
Исследование показало, что перекрестное сопротивление не всегда происходит между нестероидными ингибиторами ароматазы и стероидными ингибиторами ароматазы.[6][8] Если нестероидные ингибиторы ароматазы не работают или у пациентов наблюдается рецидив, тогда для получения лучших результатов можно будет применить стероидные ингибиторы ароматазы, прежде чем пациенты будут вынуждены переключиться с эндокринный терапия для цитотоксический химиотерапия и, следовательно, предотвращение или отсрочение побочных эффектов и осложнений последнего.[6]
Плодородие
Ингибиторы ароматазы использовались для сохранения фертильности путем стимуляции овуляции у переживших рак груди в пременопаузе. Ингибируя ароматазу у женщин в пременопаузе, эстроген уровни временно снижаются, что приводит к увеличению гонадотропин секреции и стимуляции яичников, что вызывает повышение эстроген уровни.[2][7]
Примеры агентов
1 и 2 поколения
Тестолактон и форместан являются ингибиторами ароматазы 1-го и 2-го поколения. Форместан был первым селективным ингибитором ароматазы, который использовался для лечения рака груди, но сегодня он не используется в клинической практике.[3][7]
3-е поколение
Экземестан является единственным стероидным ингибитором ароматазы 3-го поколения и имеет преимущество перед форместаном в том, что он более эффективен и может вводиться перорально. Клинические исследования показали, что 25 мг / день вызывают 97,9% подавление ароматазы.[2]
Механизм действия
Эстроген играет важную роль в стимуляции рак молочной железы пролиферация клеток при гормонозависимом раке груди. Высокие концентрации эстрогена, по-видимому, способствуют развитию рака груди. Следовательно, были разработаны два основных подхода к контролю и блокированию патологической активности эстрогенов.[9] Первый подход направлен на подавление действия эстрогенов антиэстрогенами, которые взаимодействуют с рецепторами эстрогенов. Второй направлен на прямое подавление выработки эстрогена путем ингибирования синтетазы эстрогена. ароматаза.[10] Ингибиторы стероидной ароматазы идентифицированы как ингибиторы типа I, которые взаимодействуют с сайтом связывания субстрата ароматазы. фермент.[11]
Фермент ароматаза
Ароматаза - это цитохром P450 который катализирует три последовательных гидроксилирование реакции, превращающие C19 андрогены до ароматического C18 эстрогены. Получив электроны от редуктазы НАДФН-цитохром Р450, ароматаза преобразует андростендион и тестостерон к эстрон и эстрадиол, соответственно. Ароматизация андрогена является конечной и ограничивающий шаг в синтезе эстрогенов. Недавние исследования были сосредоточены на определении области активного центра фермента ароматазы и оценке наиболее многообещающего механизма реакции. Также были созданы трехмерные модели активной области ароматазы, хотя точная природа структуры еще полностью не определена.[12]
Стероидная структура
Такие наркотики как Экземестан и другие стероидные ингибиторы ароматазы имеют стероидную структуру, которая конкурирует с природным субстратом ароматазы андростендион.[11] Ингибитор должен разделять важные структурные особенности с эндогенным субстратом, а также как особенности андрогены, позволяя им взаимодействовать с каталитическим сайтом ферментного белка. Это делает стероидные ингибиторы ароматазы по своей природе селективными.[13] Благодаря своему избирательному ингибированию он не влияет на выработку других стероиды в пути биосинтеза эстрогенов.[9]
Привязка к активному сайту
Лекарства, связанные с каталитическим сайтом, часто метаболизируются до промежуточных продуктов, которые имеют гораздо более высокое сродство к рецептору андрогенов. Связывание промежуточного метаболита 17-гидроэкземестана с рецептором андрогенов примерно в 100 раз больше, чем у исходного соединения, экземестана.[11] Когда метаболит прикрепляется к активному центру фермента, фермент инициирует свою типичную последовательность: гидроксилирование, но гидроксилирование дает неразрывную Ковалентная связь между ингибитором и ферментным белком. Даже если удалить все незакрепленные части ингибитора, ферментативная активность ароматаза может быть восстановлен только путем синтеза новых ферментов.[13] Таким образом, ингибитор блокирует активность фермента даже после того, как лекарство выводится из кровотока, оказывая таким образом длительный эффект. in vivo. Нет необходимости в постоянном присутствии препарата для поддержания ингибирования, что, в свою очередь, снижает вероятность токсического воздействия. побочные эффекты пациенту.[10] Из-за необратимого характера ингибирования стероидные ИИ часто продаются как инактиваторы или ингибиторы суицида.[9]
Отношения структура – деятельность (SAR)
Планарность кольца A очень важна для сродства соединений к ароматаза. Как видно на Таблица 1, где соединения 2 и 3 проявляют существенное ингибирование, а также имеют такие же стереохимический требования. Такой же эффект можно наблюдать с соединением 5, с ингибированием 34,6% и его 4-кетопроизводное, соединение 7, с ингибированием 83,3%. Эти различия в структуре AI показывают важность планарности кольца A для взаимодействия с активным центром ароматазы.[14]
Важным аспектом связывающих свойств соединений является стереохимия в секции C-5, где положение атома водорода может быть в альфа- или бета-положениях (направлено вверх или вниз). 5α-эпимеры проявляют гораздо более высокие связывающие свойства, чем их аналоги 5β, как это можно видеть с соединениями 3/4 и 5/6 в Таблица 1. Эти результаты указывают на важность правильного угла между соединением A и B-кольца для лучшего связывания с активным центром ароматазы.[14]
Замена D-образного кольца циклопентанон к шестичленному δ-лактон снижает связывающую способность соединений. Сложный 9 объединили D-образную структуру тестолактон и A-кольцевая структура форместан но имел значительно меньшее ингибирование ароматазы, чем форместан.[14]
Область C-4 важна для взаимодействия AI с областью связывания и гидрофильный облигации, такие как гидроксил или же карбонил связи в этом положении могут улучшить взаимодействие с ароматазой.[14]
Эксперименты с использованием 3-дезоксистероидов показали, что 4β, 19-диол имел наибольшее ингибирование ароматазы. Вероятно, это является причиной двух полярных аминокислот в активном центре и подчеркивает важность гидрофильных групп в стероидах для улучшения связывающих свойств.[15]
Синтез
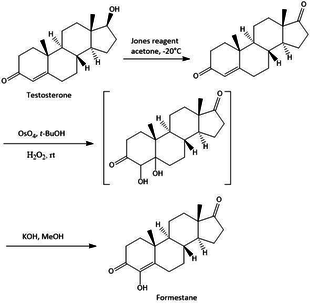
В синтез Изучение стероидных ингибиторов ароматазы осуществляется различными методами, все они имеют общее, что они синтезируются с исходной точки, которая является базовой структурой стероидов. При использовании различных методов существует различная отправная точка синтеза, например тестостерон, андростендион и другие варианты этих соединений. Синтез форместана из тестостерона представляет собой простой трехэтапный синтез, как показано на рисунке 2. Синтез дает общий выход форместана 23%. Первый шаг - это окисление тестостерона с Реактив Джонса чтобы получить андрост-4-ен-3,17-дион с выходом 73%. Стадия 2 представляет собой гидроксилирование андрост-4-ен-3,17-диона с помощью OsO4 с последующей стадией 3 с щелочной дегидратацией полученных диолов с образованием форместана.[16]
Синтез экземестана также состоит из трех этапов, как показано на рисунке 3. Во-первых, Реактив Вильсмайера-Хаака готовится кипячением с обратным холодильником параформальдегид и диметиламина гидрохлорид в изопентанол при температуре 131 ° C при удалении воды из изопентанола с помощью Сепаратор Дина-Старка. Затем внутренняя температура реагента понижается до 10–15 ° C перед добавлением коммерчески доступного болденона (андроста-1,4-диен-17β-ол-3-он). Затем реакционную смесь кипятят с обратным холодильником в течение 15 часов с получением 6-метиленового производного, 6-метиленандроста-1,4-диен-17β-ол-3-она. Впоследствии окисление производного по Джонсу в ацетоне при -10 ° C дает эксеместан с выходом 79% после перекристаллизации. Для процесса перекристаллизации используется смесь этанола и воды 65:35.[17]
Рекомендации
- ^ Ахмад, I .; Шагуфта (2015). «Последние разработки стероидных и нестероидных ингибиторов ароматазы для химиопрофилактики эстроген-зависимого рака груди». Европейский журнал медицинской химии. 102: 375–386. Дои:10.1016 / j.ejmech.2015.08.010. PMID 26301554.
- ^ а б c d Van Asten, K .; Neven, P .; Lintermans, A .; Wildiers, H .; Paridaens, R. (2014). «Ингибиторы ароматазы в клинике рака груди: акцент на экземестане». Эндокринный рак. 21 (1): R31 – R49. Дои:10.1530 / Erc-13-0269. PMID 24434719.
- ^ а б c d е ж Santen, R.J .; Brodie, H .; Simpson, E. R .; Siiteri, P.K .; Броди, А. (2009). «История ароматазы: сага о важном биологическом посреднике и терапевтической мишени». Эндокринные обзоры. 30 (4): 343–375. Дои:10.1210 / er.2008-0016. PMID 19389994.
- ^ а б c Chumsri, S .; Howes, T .; Bao, T .; Sabnis, G .; Броди, А. (2011). «Ароматаза, ингибиторы ароматазы и рак груди». Журнал стероидной биохимии и молекулярной биологии. 125 (1–2): 13–22. Дои:10.1016 / j.jsbmb.2011.02.001. ЧВК 3104073. PMID 21335088.
- ^ а б Ломбарди, П. (2002). «Экземестан, новый клинически значимый ингибитор стероидной ароматазы». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1587 (2–3): 326–337. Дои:10.1016 / S0925-4439 (02) 00096-0. PMID 12084475.
- ^ а б c d е Бересфорд, М .; Tumur, I .; Chakrabarti, J .; Barden, J .; Rao, N .; Макрис, А. (2011). «Качественный систематический обзор доказательной базы отсутствия перекрестной резистентности между стероидными и нестероидными ингибиторами ароматазы при метастатическом раке груди». Clin Oncol (R Coll Radiol). 23 (3): 209–215. Дои:10.1016 / j.clon.2010.11.005. PMID 21134732.
- ^ а б c d е ж грамм час Чумсри, S (2015). «Клиническое применение ингибиторов ароматазы при раке груди». Int J Женское здоровье. 7: 493–499. Дои:10.2147 / IJWH.S69907. ЧВК 4427607. PMID 26005359.
- ^ а б Miller, W. R .; Bartlett, J .; Brodie, A.MH .; Brueggemeier, R.W .; Di Salle, E .; Lonning, P.E .; Госс, П. Э. (2008). «Ингибиторы ароматазы: есть ли различия между стероидными и нестероидными ингибиторами ароматазы и имеют ли они значение?». Онколог. 13 (8): 829–837. Дои:10.1634 / теонколог.2008-0055. PMID 18695261.
- ^ а б c Ахмад, Иршад (18 сентября 2015 г.). «Последние разработки стероидных и нестероидных ингибиторов ароматазы для химиопрофилактики эстроген-зависимого рака груди». Европейский журнал медицинской химии. 102: 375–386. Дои:10.1016 / j.ejmech.2015.08.010. PMID 26301554.
- ^ а б Njar, V. C .; Броди, А. М. (1999-08-01). «Комплексная фармакология и клиническая эффективность ингибиторов ароматазы». Наркотики. 58 (2): 233–255. Дои:10.2165/00003495-199958020-00003. ISSN 0012-6667. PMID 10473018.
- ^ а б c Кампос, Сусана М. (2004-04-01). «Ингибиторы ароматазы при раке груди у женщин в постменопаузе». Онколог. 9 (2): 126–136. Дои:10.1634 / теонколог.9-2-126. ISSN 1083-7159. PMID 15047917.
- ^ Хонг, Яньян; Чен, Шиуань (01.11.2006). «Ингибиторы ароматазы». Летопись Нью-Йоркской академии наук. 1089 (1): 237–251. Дои:10.1196 / летопись.1386.022. ISSN 1749-6632. PMID 17261771.
- ^ а б Буздар, Аман У. (01.01.2003). «Фармакология и фармакокинетика ингибиторов ароматазы нового поколения». Клинические исследования рака. 9 (1): 468–472 с. ISSN 1078-0432.
- ^ а б c d Cepa, M. M .; Таварес; да Силва, Э. Дж .; Correia-da-Silva, G .; Ролейра, Ф. М .; Тейшейра, Н. А. (2005). «Взаимосвязь между структурой и активностью новых стероидов с модифицированным A, D-кольцом в качестве ингибиторов ароматазы: дизайн, синтез и оценка биологической активности» (PDF). J Med Chem. 48 (20): 6379–6385. Дои:10.1021 / jm050129p. HDL:10316/10522. PMID 16190763.
- ^ Numazawa, M .; Yamada, K .; Nitta, S .; Sasaki, C .; Кидокоро, К. (2001). «Роль гидрофильного взаимодействия в связывании гидроксилированных 3-дезокси-C19 стероидов с активным центром ароматазы». J Med Chem. 44 (24): 4277–4283. Дои:10.1021 / jm010282t. PMID 11708928.
- ^ Martin, G.D .; и другие. (2013). «Синтез и биоконверсии форместана». Джей Нат Прод. 76 (10): 1966–1969. Дои:10.1021 / np400585t. PMID 24074257.
- ^ Ли, Джи Джек (01.01.2007). Johnson, Douglas S .; Ли, Джи Джек (ред.). Ингибиторы ароматазы при раке груди: Экземестан (Аромазин), Анастрозол (Аримидекс) и Летрозол (Фемара). John Wiley & Sons, Inc., стр. 30–38. Дои:10.1002 / 9780470134979.ch3. ISBN 978-0-470-13497-9.