WikiDer > Флуоксиместерон
 | |
| Клинические данные | |
|---|---|
| Торговые наименования | Халотестин, Ора-Тестрил, Ультандрен, другие |
| Другие имена | Флуоксиместрон; Андрофлуорен; NSC-12165; 9α-фтор-11β-гидрокси-17α-метилтестостерон; 9α-фтор-17α-метиландрост-4-ен-11β, 17β-диол-3-он |
| AHFS/Drugs.com | Монография |
| MedlinePlus | a682690 |
| Беременность категория |
|
| Маршруты администрация | Устно[1] |
| Класс препарата | Андроген; Анаболический стероид |
| Код УВД | |
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Биодоступность | Устный: 80%[2] |
| Метаболизм | Печень (6β-гидроксилирование, 5α- и 5β-редукция, 3α- и 3β-кетоокисление, 11β-гидрокси-окисление)[3] |
| Метаболиты | • 5α ‑ дигидрофлуоксиместерон[3] • 11-оксофлуоксиместерон[3] |
| Устранение период полураспада | 9,2 часов[4][5] |
| Экскреция | Моча (<5% без изменений)[2][3] |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.000.875 |
| Химические и физические данные | |
| Формула | C20ЧАС29FО3 |
| Молярная масса | 336.447 г · моль−1 |
| 3D модель (JSmol) | |
| |
| |
| (проверять) | |
Флуоксиместерон, продается под торговыми марками Халотестин и Ultandren среди прочего, это андроген и анаболический стероид (AAS) лекарство, которое используется для лечения низкий уровень тестостерона у мужчин, задержка полового созревания у мальчиков, рак молочной железы у женщин, и анемия.[1] Принято устно.[1]
Побочные эффекты флуоксиместерона включают симптомы из маскулинизация подобно угревая сыпь, усиленный рост волос, голос меняется, и увеличил сексуальное желание.[1] Это также может вызвать повреждение печени и сердечно-сосудистый побочные эффекты, такие как высокое кровяное давление.[1][6][7] Препарат представляет собой синтетический андроген и анаболический стероид и, следовательно, агонист из рецептор андрогенов (AR), биологическая мишень андрогенов как тестостерон и дигидротестостерон (DHT).[1][8] Он имеет сильный андрогенный эффекты и умеренные анаболический эффекты, которые делают его полезным для производства маскулинизации.[1][9]
Флуоксиместерон был впервые описан в 1956 году и был введен для медицинского применения в 1957 году.[1][10] Помимо медицинского применения, флуоксиместерон используется для: улучшить телосложение и работоспособность.[1] Препарат представляет собой контролируемое вещество во многих странах немедицинское использование, как правило, незаконно.[1]
Медицинское использование
Флуоксиместерон применялся или использовался для лечения гипогонадизм, задержка полового созревания, и анемия у мужчин и лечение рак молочной железы у женщин.[1][11] Он специально одобрен в одной или нескольких странах для лечения гипогонадизма у мужчин, задержки полового созревания у мальчиков и рака груди у женщин.[12] Текущие рекомендации по назначению в Соединенные Штаты перечислить только лечение дефицит андрогенов у мужчин и рака груди у женщин в качестве показаний.[1]
Флуоксиместерон менее эффективен в индукции маскулинизации, чем тестостерон, но полезен для поддержания устоявшейся маскулинизации у взрослых.[13]
| Маршрут | Медикамент | Основные торговые марки | Форма | Дозировка |
|---|---|---|---|---|
| Устный | Тестостерона | – | Планшет | 400–800 мг / сут (в несколько приемов) |
| Ундеканоат тестостерона | Андриол, Джатензо | Капсула | 40–80 мг 2–4 раза в день (во время еды) | |
| Метилтестостеронб | Андроид, Метандрен, Testred | Планшет | 10-50 мг / день | |
| Флуоксиместеронб | Халотестин, Ора-Тестрил, Ультандрен | Планшет | 5-20 мг / день | |
| Метандиенонб | Дианабол | Планшет | 5-15 мг / день | |
| Местеролонб | Провирон | Планшет | 25–150 мг / день | |
| Буккальный | Тестостерон | Стриант | Планшет | 30 мг 2 раза в день |
| Метилтестостеронб | Метандрен, Оретон Метил | Планшет | 5-25 мг / день | |
| Сублингвальный | Тестостеронб | Тесторальный | Планшет | 5–10 мг 1–4 раза в день |
| Метилтестостеронб | Метандрен, Оретон Метил | Планшет | 10-30 мг / день | |
| Интраназальный | Тестостерон | Натесто | Назальный спрей | 11 мг 3 раза в день |
| Трансдермальный | Тестостерон | АндроГель, Тестим, Тестогель | Гель | 25–125 мг / день |
| Андродерм, AndroPatch, TestoPatch | Не мошоночный патч | 2,5-15 мг / день | ||
| Тестодерм | Пластырь мошонки | 4–6 мг / день | ||
| Axiron | Подмышечный раствор | 30–120 мг / день | ||
| Андростанолон (DHT) | Андрактим | Гель | 100–250 мг / день | |
| Ректальный | Тестостерон | Ректандрон, Тестостеронб | Суппозиторий | 40 мг 2–3 раза в день |
| Инъекция (Я или же SC) | Тестостерон | Андронак, Стеротат, Виростерон | Водная суспензия | 10–50 мг 2–3 раза в неделю |
| Тестостерона пропионатб | Тестовирон | Масляный раствор | 10–50 мг 2–3 раза в неделю | |
| Тестостерон энантат | Делатестрил | Масляный раствор | 50–250 мг 1 раз в 1–4 недели | |
| Xyosted | Автоинжектор | 50–100 мг 1 раз в неделю | ||
| Ципионат тестостерона | Депо-тестостерон | Масляный раствор | 50–250 мг 1 раз в 1–4 недели | |
| Изобутират тестостерона | Аговирин Депо | Водная суспензия | 50–100 мг 1 раз в 1-2 недели | |
| Фенилацетат тестостеронаб | Перандрен, Андроект | Масляный раствор | 50–200 мг 1 раз / 3–5 недель | |
| Смешанные эфиры тестостерона | Сустанон 100, Сустанон 250 | Масляный раствор | 50–250 мг 1 раз в 2–4 недели | |
| Ундеканоат тестостерона | Aveed, Небидо | Масляный раствор | 750–1000 мг 1 раз в 10–14 недель | |
| Буциклат тестостеронаа | – | Водная суспензия | 600–1000 мг 1 раз / 12–20 недель | |
| Имплант | Тестостерон | Testopel | Пеллет | 150–1200 мг / 3–6 месяцев |
| Примечания: Мужчины производят от 3 до 11 мг тестостерона в день (в среднем 7 мг / день у молодых мужчин). Сноски: а = Никогда не продавался. б = Больше не используется и / или больше не продается. Источники: См. Шаблон. | ||||
| Маршрут | Медикамент | Основные торговые марки | Форма | Дозировка |
|---|---|---|---|---|
| Устный | Ундеканоат тестостерона | Андриол, Джатензо | Капсула | 40–80 мг 1 раз в 1-2 дня |
| Метилтестостерон | Метандрен, Estratest | Планшет | 0,5–10 мг / день | |
| Флуоксиместерон | Халотестин | Планшет | 1–2,5 мг 1 раз / 1–2 дня | |
| Норметандрона | Гинекозид | Планшет | 5 мг / день | |
| Тиболон | Ливиал | Планшет | 1,25–2,5 мг / день | |
| Прастерон (DHEA)б | – | Планшет | 10–100 мг / день | |
| Сублингвальный | Метилтестостерон | Метандрен | Планшет | 0,25 мг / день |
| Трансдермальный | Тестостерон | Intrinsa | Пластырь | 150–300 мкг / день |
| АндроГель | Гель, крем | 1–10 мг / день | ||
| Вагинальный | Прастерон (DHEA) | Intrarosa | Вставлять | 6,5 мг / день |
| Инъекция | Тестостерона пропионата | Тестовирон | Масляный раствор | 25 мг 1 раз в 1-2 недели |
| Тестостерон энантат | Делатестрил, Primodian Depot | Масляный раствор | 25–100 мг 1 раз в 4–6 недель | |
| Ципионат тестостерона | Депо-тестостерон, депо-тестадиол | Масляный раствор | 25–100 мг 1 раз / 4–6 недель | |
| Изобутират тестостеронаа | Фемандрен М, Фоливирин | Водная суспензия | 25-50 мг 1x / 4-6 недель | |
| Смешанные эфиры тестостерона | Климактерона | Масляный раствор | 150 мг 1x / 4-8 недель | |
| Омнадрен, Сустанон | Масляный раствор | 50–100 мг 1 раз / 4–6 недель | ||
| Деканоат нандролона | Дека-дураболин | Масляный раствор | 25-50 мг 1 раз / 6-12 недель | |
| Прастерон энантата | Гинодиан Депо | Масляный раствор | 200 мг 1 раз / 4–6 недель | |
| Имплант | Тестостерон | Testopel | Пеллет | 50–100 мг 1 раз в 3–6 месяцев |
| Примечания: Пременопаузальный женщины производят около 230 ± 70 мкг тестостерон в день (6,4 ± 2,0 мг тестостерона за 4 недели) с диапазоном от 130 до 330 мкг в день (3,6–9,2 мг за 4 недели). Сноски: а = В основном снято с производства или недоступно. б = Без рецепта. Источники: См. Шаблон. | ||||
| Маршрут | Медикамент | Форма | Дозировка | |
|---|---|---|---|---|
| Устный | Метилтестостерон | Планшет | 30–200 мг / день | |
| Флуоксиместерон | Планшет | 10-40 мг 3 раза в день | ||
| Калустероне | Планшет | 40–80 мг 4 раза в день | ||
| Норметандрон | Планшет | 40 мг / день | ||
| Буккальный | Метилтестостерон | Планшет | 25–100 мг / день | |
| Инъекция (Я или же SC) | Тестостерона пропионат | Масляный раствор | 50–100 мг 3 раза в неделю | |
| Тестостерон энантат | Масляный раствор | 200–400 мг 1 раз в 2–4 недели | ||
| Ципионат тестостерона | Масляный раствор | 200–400 мг 1 раз в 2–4 недели | ||
| Смешанные эфиры тестостерона | Масляный раствор | 250 мг 1 раз в неделю | ||
| Метандриол | Водная суспензия | 100 мг 3 раза в неделю | ||
| Андростанолон (DHT) | Водная суспензия | 300 мг 3 раза в неделю | ||
| Дростанолона пропионат | Масляный раствор | 100 мг 1–3 раза в неделю | ||
| Метенолона энантат | Масляный раствор | 400 мг 3 раза в неделю | ||
| Деканоат нандролона | Масляный раствор | 50–100 мг 1 раз в 1–3 недели | ||
| Фенилпропионат нандролона | Масляный раствор | 50–100 мг / неделя | ||
| Примечание: Дозировки не обязательно эквивалентны. Источники: См. Шаблон. | ||||
Доступные формы
Флуоксиместерон доступен в форме 2, 5 и 10 мг. устный таблетки.[14]
Немедицинское использование
Флуоксиместерон используется для цели улучшения телосложения и производительности к конкурентный спортсмены, культуристы, и пауэрлифтеры.[1]
Побочные эффекты
Побочные эффекты которые были связаны с флуоксиместероном, включают угревая сыпь, отек, себорея/себорейный дерматит, алопеция, гирсутизм, голос становится громче, вирилизация в целом, промывание, гинекомастия, боль в груди, нарушения менструального цикла, гипогонадизм, атрофия яичек, увеличение клитора, увеличение полового члена, приапизм, повысился агрессивность, увеличение простаты, сердечно-сосудистая токсичность, и гепатотоксичность, среди прочего.[1][15]
Фармакология
Фармакодинамика
| Медикамент | Соотношениеа |
|---|---|
| Тестостерон | ~1:1 |
| Андростанолон (DHT) | ~1:1 |
| Метилтестостерон | ~1:1 |
| Метандриол | ~1:1 |
| Флуоксиместерон | 1:1–1:15 |
| Метандиенон | 1:1–1:8 |
| Дростанолон | 1:3–1:4 |
| Метенолон | 1:2–1:30 |
| Оксиметолон | 1:2–1:9 |
| Оксандролон | 1:3–1:13 |
| Станозолол | 1:1–1:30 |
| Нандролон | 1:3–1:16 |
| Этилэстренол | 1:2–1:19 |
| Норетандролон | 1:1–1:20 |
| Примечания: У грызунов. Сноски: а = Отношение андрогенной активности к анаболической. Источники: См. Шаблон. | |
Как ААС флуоксиместерон является агонист из рецептор андрогенов (AR), аналогично андрогены подобно тестостерон и DHT.[1][16] Это субстрат за 5α-редуктаза как тестостерон, и поэтому он потенцируется в так называемых "андрогенных" тканях, таких как кожа, волосяные фолликулы, и простата через трансформация в 5α-дигидрофлуоксиместерон.[1][16][3] Таким образом, флуоксиместерон имеет относительно низкое соотношение анаболический к андрогенный активность аналогична тестостерону и метилтестостерон.[1][16] Однако флуоксиместерон тем не менее пропорционально менее андроген и более анаболичен, чем метилтестостерон и тестостерон.[9]
Сообщается, что флуоксиместерон не оказываетароматизируемый из-за стерическое препятствие своим C11β гидроксильная группа,[17] и, следовательно, не считается склонным к производству эстрогенный эффекты, такие как гинекомастия или же задержка жидкости.[1][18] Однако, как это ни парадоксально, имеется сообщение о случаях тяжелой гинекомастии, вызванной флуоксиместероном, и о гинекомастии, связанной с флуоксиместероном, также сообщалось в других публикациях, хотя это может быть не из-за эстрогенной активности.[19] Считается, что флуоксиместерон практически не обладает прогестагенный Мероприятия.[1][16]
Из-за присутствия его 17α-метильной группы метаболизм флюоксиместерона затрудняется, в результате чего он перорально активный, хотя также гепатотоксичный.[1][16]
Ингибирование 11β-HSD
Было обнаружено, что флуоксиместерон действует как мощный ингибитор из 11β-гидроксистероид дегидрогеназа тип 2 (11β-HSD2) (IC50 = 60-630 нМ), с эффективностью, сопоставимой с эффективностью ингибитора 11β-HSD2. глицирретиновая кислота.[6][7] Это действие флуоксиместерона уникально среди ААС и, вероятно, связано с его 11β-гидроксильной группой.[6] 11β-HSD2 отвечает за инактивация из глюкокортикоиды кортизол и кортикостерон (в кортизон и 11-дегидрокортикостерон, соответственно).[6][7] Ингибирование 11β-HSD2 флуоксиместероном может привести к минералокортикоидный рецептор гиперактивация и связанные с ней побочные эффекты, такие как гипертония и задержка жидкости, и предполагается, что он участвует в сердечно-сосудистый и другие побочные эффекты флуоксиместерона.[6][7]
Глюкокортикоидная активность
В отличие от других ААС, флюоксиместерон имеет общие структурные особенности с кортикостероиды, в том числе его C9α фтор и C11β гидроксил группы.[20] В связи с этим он имеет слабую (микромолярный), но потенциально клинически значимый близость для рецептор глюкокортикоидов.[21]
Фармакокинетика
Флюоксиместерон имеет примерно 80% устный биодоступностьв отличие от тестостерона, поскольку C17α метильная группа флуоксиместерона подавляет метаболизм первого прохождения.[2][1] Очень низкий близость для человеческой сыворотки глобулин, связывающий половые гормоны (SHBG), менее 5% от тестостерона и менее 1% от DHT.[22] Препарат метаболизируется в печень, в основном 6β-гидроксилирование, 5α- и 5β-редукция, 3α- и 3β-кетоокисление, и 11β-гидрокси-окисление.[3] Это известено активные метаболиты включают 5α-дигидрофлуоксиместерон и 11-оксофлуоксиместерон.[3][6][23][9] Флюоксиместерон имеет период полувыведения примерно 9,2 часа, что больше, чем у тестостерона.[4] это устранен в моча, менее 5% выделенный без изменений.[2][3]
Химия
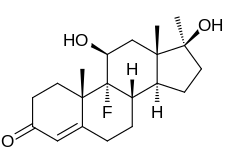
Флуоксиместерон, также известный как 9α-фтор-11β-гидрокси-17α-метилтестостерон или 9α-фтор-17α-метиландрост-4-ен-11β, 17β-диол-3-он, представляет собой синтетический андростан стероидный препарат и 17α-алкилированный производная из тестостерон (андрост-4-ен-17β-ол-3-он).[24][25] Это производное тестостерона с фтор атом в позиции C9α, a гидроксильная группа в позиции C11β, а метильная группа в позиции C17α.[24][25]
Синтез
Первый шаг: Первым шагом в синтезе флюоксиместерона является микробиологическое окисление коммерчески доступного андростендиона (1.11) к Актиномицеты; это вводит гидроксильную группу в 11α-позиция (1.12), который затем окисляется до кетона с помощью реактива Джонса, давая 3,11,17-трикетон, адреностерон (1.13). Затем пирролидин реагирует с образованием енамина (1.14) по реакции с 3α-кетогруппа, защищая ее от алкилирования на последующей стадии. Региоселективность пирролидина для реакции на 3α-положение происходит по своей сути в структуре адреностерона из-за положения стерически объемных метильных групп. На последующих стадиях алкилирование 17-кетогруппы (1.14) с помощью реактива Гриньяра добавление гидрида в положении 11 (1.15) и регенерация защищенной 3-кетогруппы дает исходный материал (1.16) для заключительных стадий синтеза флюоксиместерона. Это предполагает более стандартные синтетические преобразования.
Шаг второй: 11α-гидроксил исходного материала (1.16) сульфонилируется п-толуолсульфонилхлорид; добавление триметиламина (основания) депротонирует 11α-углерод, давая (E2) удаление тозилата (pkа - 5) дать олефин (1.17). Стереоспецифичность реакции олефина с бромистоводородной кислотой (HOBr) в основании, N-бромосукцинимид (NBS) определяется образованием промежуточного бромония; электрофильный катион бромония приближается к менее стерически затрудненному кольцу α-face и атакуется π-электронной плотностью алкена. Затем гидроксид-ион атакует сверху кольца (β-face) у 11-углерода, в результате чего получается структура (1.18) стереоспецифическим присоединением гидроксила и брома по двойной связи. Добавление гидроксида натрия приводит к депротонированию 11α-гидроксил, а последующая структура претерпевает внутримолекулярную SNОбразование 2 эпоксидных колец. Эпоксидное кольцо β-эпоксид (1.19) протонируется с образованием промежуточного иона оксирония. В согласованном процессе фтор атакует кольцо α- лицо снизу, так как одна из двух кислородно-углеродных связей разорвана на противоположной стороне; следовательно, регенерируя 11α-гидроксил транс к заместителю фтора. Полученная структура (1.20) представляет собой андрогенный стероид флуоксиместерон.
Обнаружение в биологических жидкостях
Обнаружение галотестина и других запрещенных анаболических стероидов в спорте достигается с помощью GS-MS идентификации анаболических стероидов, выделяемых с мочой, и их метаболитов. В тесте на галотестин сухой остаток, полученный из образца мочи, растворяют в диметилформамиде и комплексе триоксид серы-пиридин и нагревают с 1% -ным раствором карбоната калия. Галотестин и многие его метаболиты содержат две полярные гидроксильные группы, что приводит к образованию межмолекулярных водородных связей, повышающих их температуру кипения и снижающих летучесть. Для получения газообразного образца для ГХ-МС продукты гидролиза экстрагируют, растворяют в метаноле и дериватизируют с образованием летучих эфиров триметилсилила (ТМС) путем добавления N-метил-N-триметилсилил-трифторацетамид (MSTFA) и триметилсилилимидазол (TMSImi).[26]
История
Флуоксиместерон был впервые описан в 1956 году и был введен для медицинского применения в Соединенные Штаты в 1957 г.[1][10] Со временем использование флуоксиместерона становится все более противоречивым и ограниченным.[1]
Общество и культура
Родовые имена
Флуоксиместерон это родовое имя препарата и его ГОСТИНИЦА, USP, БАН, DCIT, и ЯНВАРЬ, пока флуоксиместерон это его DCF.[24][25][27][28]
Фирменные наименования
Торговые марки флуоксиместерона включают, среди прочих, Android-F, Androxy, Halotestin, Ora-Testryl и Ultandren.[24][25][27][28]
Доступность
Соединенные Штаты
Флуоксиместерон - один из немногих ААС, который остается доступным для медицинского применения в Соединенные Штаты.[29] Остальные (по состоянию на ноябрь 2017 г.) тестостерон, ципионат тестостерона, тестостерон энантат, ундеканоат тестостерона, метилтестостерон, оксандролон, и оксиметолон.[29]
Другие страны
Доступность флуоксиместерона за пределами США остается недостаточной, но он продается в некоторых других странах, таких как Мексика, Молдова, и Тайвань.[1][28]
Легальное положение
Флуоксиместерон, наряду с другими ААС, является график III контролируемое вещество в Соединенные Штаты под Закон о контролируемых веществах.[30]
Рекомендации
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс Уильям Ллевеллин (2011). Анаболики. Molecular Nutrition Llc. С. 500–508. ISBN 978-0-9828280-1-4.
- ^ а б c d Томас Л. Лемке; Дэвид А. Уильямс (24 января 2012 г.). Принципы медицинской химии Фуа. Липпинкотт Уильямс и Уилкинс. С. 1360–. ISBN 978-1-60913-345-0.
- ^ а б c d е ж грамм час Каммерер Р.К., Мердинк Д.Л., Ягельс М., Кэтлин Д.Х., Хуэй К.К. (1990). «Тестирование на введение человеку флуоксиместерона (галотестина): определение метаболитов в моче с помощью газовой хроматографии-масс-спектрометрии». J. Стероид Биохим. 36 (6): 659–66. Дои:10.1016 / 0022-4731 (90) 90185-у. PMID 2214783.
- ^ а б Сет Робертс (2009). Анаболическая фармакология.
- ^ Томас Л. Лемке; Дэвид А. Уильямс (2008). Принципы медицинской химии Фуа. Липпинкотт Уильямс и Уилкинс. стр. 1279–. ISBN 978-0-7817-6879-5.
- ^ а б c d е ж Fürstenberger C, Vuorinen A, Da Cunha T, Kratschmar DV, Saugy M, Schuster D, Odermatt A (2012). «Анаболический андрогенный стероид флуоксиместерон ингибирует 11β-гидроксистероиддегидрогеназу 2-зависимую инактивацию глюкокортикоидов». Toxicol. Наука. 126 (2): 353–61. Дои:10.1093 / toxsci / kfs022. PMID 22273746.
- ^ а б c d Джозеф Дж. Ф., Парр МК (2015). «Синтетические андрогены как дизайнерские добавки». Курр нейрофармакол. 13 (1): 89–100. Дои:10,2174 / 1570159X13666141210224756. ЧВК 4462045. PMID 26074745.
- ^ Кичман АТ (2008). «Фармакология анаболических стероидов». Br. J. Pharmacol. 154 (3): 502–21. Дои:10.1038 / bjp.2008.165. ЧВК 2439524. PMID 18500378.
- ^ а б c Чарльз Д. Кочакян (6 декабря 2012 г.). Анаболически-андрогенные стероиды. Springer Science & Business Media. С. 370, 374, 401, 454, 504–506. ISBN 978-3-642-66353-6.
- ^ а б Издательство William Andrew (22 октября 2013 г.). Энциклопедия фармацевтического производства, 3-е издание. Эльзевир. С. 1676–. ISBN 978-0-8155-1856-3.
- ^ Сьюзен М. Форд; Салли С. Роуч (7 октября 2013 г.). Вводная клиническая фармакология Роуча. Липпинкотт Уильямс и Уилкинс. С. 502–. ISBN 978-1-4698-3214-2.
- ^ http://adisinsight.springer.com/drugs/800012288
- ^ Джон А. Томас; Эдвард Дж. Кинан (6 декабря 2012 г.). Принципы эндокринной фармакологии. Springer Science & Business Media. С. 125–. ISBN 978-1-4684-5036-1.
- ^ Жак Лоррен (1994). Комплексное лечение менопаузы. Springer Science & Business Media. С. 301–. ISBN 978-0-387-97972-4.
- ^ Джером З. Литт; Нил Шир (17 декабря 2014 г.). Руководство Литта по лекарственным высыпаниям и реакциям, 19-е издание. CRC Press. С. 177–. ISBN 978-1-84214-599-9.
- ^ а б c d е Кичман, А Т (2008). «Фармакология анаболических стероидов». Британский журнал фармакологии. 154 (3): 502–521. Дои:10.1038 / bjp.2008.165. ЧВК 2439524. PMID 18500378.
- ^ Аттарди Б.Дж., Фам Т.К., Радлер Л.К., Бургенсон Дж., Хилд С.А., Рил-младший (2008). «Диметандролон (7альфа, 11бета-диметил-19-нортестостерон) и 11бета-метил-19-нортестостерон не превращаются в продукты ароматического A-кольца в присутствии рекомбинантной ароматазы человека». J. Steroid Biochem. Мол. Биол. 110 (3–5): 214–22. Дои:10.1016 / j.jsbmb.2007.11.009. ЧВК 2575079. PMID 18555683.
- ^ Норман Т. Адлер; Дональд Пфафф; Роберт В. Гой (6 декабря 2012 г.). Размножение. Springer Science & Business Media. стр. 630–. ISBN 978-1-4684-4832-0.
- ^ Lo TE, Andal ZC, Lantion-Ang FL (2015). «Флюоксиместерон-индуцированная гинекомастия у пациента с апластической анемией в детском возрасте». Представитель BMJ Case. 2015: bcr2014207474. Дои:10.1136 / bcr-2014-207474. ЧВК 4434366. PMID 25948845.
- ^ Киршбаум Дж (27 октября 1978 г.). Профили лекарственных веществ, вспомогательных веществ и соответствующие методики. Академическая пресса. С. 253–. ISBN 978-0-08-086102-9.
- ^ Майер М, Розен Ф (1975). «Взаимодействие анаболических стероидов с участками рецепторов глюкокортикоидов в цитозоле мышц крыс». Являюсь. J. Physiol. 229 (5): 1381–6. Дои:10.1152 / ajplegacy.1975.229.5.1381. PMID 173192.
- ^ Саарток Т., Дальберг Э, Густафссон Дж. А. (1984). «Относительное сродство связывания анаболических андрогенных стероидов: сравнение связывания с рецепторами андрогенов в скелетных мышцах и простате, а также с глобулином, связывающим половые гормоны». Эндокринология. 114 (6): 2100–6. Дои:10.1210 / эндо-114-6-2100. PMID 6539197.
- ^ Гордан, Г. С. (1976). «Рак в человеке». В Кочакяне, Чарльз Д. (ред.). Анаболически-андрогенные стероиды. С. 499–513. Дои:10.1007/978-3-642-66353-6_16. ISBN 978-3-642-66355-0.
- ^ а б c d Дж. Элкс (14 ноября 2014 г.). Словарь лекарственных средств: химические данные: химические данные, структуры и библиографии. Springer. С. 568–. ISBN 978-1-4757-2085-3.
- ^ а б c d Index Nominum 2000: Международный справочник лекарственных средств. Тейлор и Фрэнсис. Январь 2000. с. 461. ISBN 978-3-88763-075-1.
- ^ Шенцер, Вилли; Опферманн, Георг; Донике, Манфред (1992-11-01). «17-Эпимеризация 17α-метил анаболических стероидов в организме человека: метаболизм и синтез 17α-гидрокси-17β-метилстероидов». Стероиды. 57 (11): 537–550. Дои:10.1016 / 0039-128X (92) 90023-3. PMID 1448813. S2CID 54380880.
- ^ а б И.К. Мортон; Джудит М. Холл (6 декабря 2012 г.). Краткий словарь фармакологических агентов: свойства и синонимы. Springer Science & Business Media. стр. 123–. ISBN 978-94-011-4439-1.
- ^ а б c https://www.drugs.com/international/Fluoxymesterone.html
- ^ а б "Drugs @ FDA: одобренные FDA лекарственные препараты". Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Получено 17 декабря 2016.
- ^ Стивен Б. Карч (21 декабря 2006 г.). Справочник по злоупотреблению наркотиками, второе издание. CRC Press. С. 30–. ISBN 978-1-4200-0346-8.
