WikiDer > Убиквитин карбоксиконцевая гидролаза L1
Убиквитин карбоксиконцевая гидролаза L1 (EC 3.1.2.15, убиквитин C-концевая гидролаза, UCH-L1) это деубиквитинирующий фермент.
| Убиквитин карбоксиконцевая гидролаза L1 (UCH-L1) | |
|---|---|
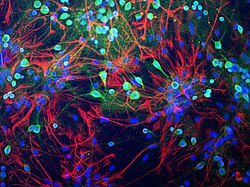 Нейроны из ткани мозга крысы, окрашенной в зеленый цвет антителом к убиквитин-С-концевой гидролазе L1 (UCH-L1), которая сильно выделяет тело клетки, а клеточные процессы более слабые. Астроциты окрашиваются в красный цвет антителами к белку GFAP, обнаруженным в цитоплазматических филаментах. Ядра всех типов клеток окрашены в синий цвет ДНК-связывающим красителем. Антитела, препарат клеток и изображение, созданное с помощью EnCor Biotechnology Inc. | |
| Анатомические термины микроанатомии |
Функция
UCH-L1 является членом семейства генов, продукты которого гидролизуют небольшие С-концевые аддукты убиквитина с образованием мономера убиквитина. Экспрессия UCH-L1 высокоспецифична для нейронов и клеток диффузной нейроэндокринной системы и их опухолей. Он широко присутствует во всех нейронах (составляет 1-2% от общего белка мозга), специфически экспрессируется в нейронах и семенниках / яичниках.[5][6]
Каталитическая триада UCH-L1 содержит цистеин в положении 90, аспартат в положении 176 и гистидин в положении 161, которые отвечают за его гидролазную активность.[7]
Актуальность для нейродегенеративных расстройств
А точечная мутация (I93M) в ген кодирование этого белка считается причиной болезнь Паркинсона в одной немецкой семье, хотя это открытие является спорным, поскольку других пациентов с болезнью Паркинсона с этой мутацией обнаружено не было.[8][9]
Кроме того, полиморфизм (S18Y) в этом гене связано со снижением риска болезни Паркинсона.[10] В частности, было показано, что этот полиморфизм обладает антиоксидантной активностью.[11]
Другой потенциально защитной функцией UCH-L1 является его способность стабилизировать моноубиквитин, важный компонент убиквитиновая протеасомная система. Считается, что, стабилизируя мономеры убиквитина и тем самым предотвращая их деградацию, UCH-L1 увеличивает доступный пул убиквитина, который должен быть помечен на белки, предназначенные для деградации протеасомой.[12]
Ген также связан с Болезнь Альцгеймера, и требуется для нормального синаптический и познавательный функция.[13] Потеря Uchl1 увеличивает восприимчивость бета-клеток поджелудочной железы к запрограммированной гибели клеток, что указывает на то, что этот белок играет защитную роль в нейроэндокринных клетках, и иллюстрирует связь между диабетом и нейродегенеративными заболеваниями.[14]
Пациенты с ранней нейродегенерацией, у которых мутация, являющаяся причиной мутации, была в гене UCHL1 (в частности, в связывающем домене убиквитина, E7A), демонстрируют слепоту, мозжечковую атаксию, нистагм, дисфункцию спинного столба и дисфункцию верхних мотонейронов.[15]
Внематочное выражение
Хотя экспрессия белка UCH-L1 специфична для нейроны и ткань яичка / яичника, было обнаружено, что он экспрессируется в определенных линиях клеток опухоли легких.[16] Эта аномальная экспрессия UCH-L1 связана с раком и привела к обозначению UCH-L1 как онкоген.[17]Более того, есть доказательства того, что UCH-L1 может играть роль в патогенезе мембранного гломерулонефрита, поскольку экспрессия UCH-L1 de novo в подоцитах наблюдалась в PHN, крысиной модели mGN человека.[18]Считается, что эта экспрессия UCH-L1 вызывает, по крайней мере, частичную гипертрофию подоцитов.[19]
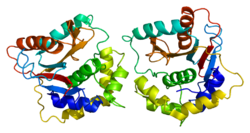
Белковая структура
Человеческий UCH-L1 и близкородственный белок УЧЛ3 иметь один из самых сложных морской узел структура, еще открытая для белка, с пятью узлами пересечения. Предполагается, что узелковая структура может повысить устойчивость белка к деградации в протеасома.[20][21]
Конформация белка UCH-L1 также может быть важным признаком нейропротекции или патологии. Например, было показано, что димер UCH-L1 проявляет потенциально патогенную лигазную активность и может приводить к вышеупомянутому увеличению агрегации α-синуклеина.[22] Было показано, что полиморфизм S18Y UCH-L1 менее склонен к димеризации.[12]
Взаимодействия
Было показано, что убиквитинкарбоксиконцевая гидролаза L1 взаимодействовать с Субъединица 5 конститутивного фотоморфогенного гомолога COP9.[23]
Также было показано, что UCH-L1 взаимодействует с α-синуклеин, другой белок, участвующий в патологии болезнь Паркинсона. Сообщается, что эта активность является результатом его активности убиквитиллигазы, которая может быть связана с патогенной мутацией I93M в гене.[22]
Совсем недавно было продемонстрировано, что UCH-L1 взаимодействует с лигазой E3, Паркин. Было продемонстрировано, что паркин связывает и убиквитинилирует UCH-L1, способствуя лизосомная деградация УЧ-Л1.[24]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000154277 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000029223 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Доран Дж. Ф., Джексон П., Кинох П. А., Томпсон Р. Дж. (Июнь 1983 г.). «Выделение PGP 9.5, нового человеческого нейрон-специфического белка, обнаруженного с помощью двумерного электрофореза высокого разрешения». Журнал нейрохимии. 40 (6): 1542–7. Дои:10.1111 / j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- ^ "Ген Entrez: UCHL1 убиквитинкарбоксил-концевая эстераза L1 (убиквитинтиолестераза)".
- ^ Das C, Hoang QQ, Kreinbring CA, Luchansky SJ, Meray RK, Ray SS, Lansbury PT, Ringe D, Petsko GA (март 2006 г.). «Структурная основа конформационной пластичности убиквитингидролазы UCH-L1, ассоциированной с болезнью Паркинсона». Труды Национальной академии наук Соединенных Штатов Америки. 103 (12): 4675–80. Дои:10.1073 / pnas.0510403103. ЧВК 1450230. PMID 16537382.
- ^ Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T., Dehejia A, Lavedan C, Gasser T., Steinbach PJ, Wilkinson KD, Polymeropoulos MH (октябрь 1998 г. ). «Путь убиквитина при болезни Паркинсона». Природа. 395 (6701): 451–2. Дои:10.1038/26652. PMID 9774100. S2CID 204997455.
- ^ Harhangi BS, Фаррер MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T., Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (июль 1999). «Мутация Ile93Met в гене убиквитинкарбоксиконцевой гидролазы-L1 не наблюдается в европейских случаях с семейной болезнью Паркинсона». Письма о неврологии. 270 (1): 1–4. Дои:10.1016 / с0304-3940 (99) 00465-6. PMID 10454131. S2CID 26352360.
- ^ Ван Дж., Чжао CY, Си Ю.М., Лю З.Л., Чен Б., ЮЛ (июль 2002 г.). «Полиморфизмы ACT и UCH-L1 при болезни Паркинсона и возрасте начала». Двигательные расстройства. 17 (4): 767–71. Дои:10.1002 / mds.10179. PMID 12210873. S2CID 23026015.
- ^ Кираци Э., Павлаки М., Стефанис Л. (июль 2008 г.). «Полиморфный вариант S18Y UCH-L1 придает антиоксидантную функцию нейронным клеткам». Молекулярная генетика человека. 17 (14): 2160–71. Дои:10.1093 / hmg / ddn115. PMID 18411255.
- ^ а б Osaka H, Wang YL, Takada K, Takizawa S, Setsuie R, Li H, Sato Y, Nishikawa K, Sun YJ, Sakurai M, Harada T, Hara Y, Kimura I, Chiba S, Namikawa K, Kiyama H, Noda M , Аоки С., Вада К. (август 2003 г.). «Убиквитин карбоксиконцевая гидролаза L1 связывается и стабилизирует моноубиквитин в нейроне». Молекулярная генетика человека. 12 (16): 1945–58. Дои:10.1093 / hmg / ddg211. PMID 12913066.
- ^ Гонг Б., Цао З., Чжэн П., Витоло О.В., Лю С., Станишевский А., Мулман Д., Чжан Х., Шелански М., Арансио О. (август 2006 г.). «Убиквитин гидролаза Uch-L1 спасает вызванное бета-амилоидом снижение синаптической функции и контекстной памяти». Клетка. 126 (4): 775–88. Дои:10.1016 / j.cell.2006.06.046. PMID 16923396. S2CID 10916274.
- ^ Чу К.Ю., Ли Х, Вада К., Джонсон Дж. Д. (январь 2012 г.). «Убиквитин C-концевая гидролаза L1 необходима для выживания и функционирования бета-клеток поджелудочной железы в липотоксических условиях». Диабетология. 55 (1): 128–40. Дои:10.1007 / s00125-011-2323-1. PMID 22038515.
- ^ Бильгувар К., Тяги Н.К., Озкара С., Туйсуз Б., Бакирджоглу М., Чой М., Делил С., Чаглаян А.О., Бараноски Дж. Ф., Эртурк О., Ялчинкая С., Каракорлу М., Динсер А, Джонсон М. Х., Мане С., Чандра СС, Луви А. , Боггон Т.Дж., Лифтон Р.П., Хорвич А.Л., Гунель М. (февраль 2013 г.). «Рецессивная потеря функции нейрональной убиквитин гидролазы UCHL1 приводит к раннему началу прогрессирующей нейродегенерации». Труды Национальной академии наук Соединенных Штатов Америки. 110 (9): 3489–94. Дои:10.1073 / pnas.1222732110. ЧВК 3587195. PMID 23359680.
- ^ Лю Ю., Лашуэль Х.А., Чой С., Син Х, Дело А, Ни Дж., Йе Л.А., Куни Г.Д., Стейн Р.Л., Лэнсбери, PT (сентябрь 2003 г.). «Открытие ингибиторов, которые выясняют роль активности UCH-L1 в линии клеток рака легкого H1299». Химия и биология. 10 (9): 837–46. Дои:10.1016 / j.chembiol.2003.08.010. PMID 14522054.
- ^ Хуссейн С., Форман О, Перкинс С.Л., Витциг Т.Э., Майлз Р.Р., ван Дерсен Дж., Галарди П.Дж. (сентябрь 2010 г.). «Деубиквитиназа UCH-L1 представляет собой онкоген, который стимулирует развитие лимфомы in vivo путем дерегуляции передачи сигналов PHLPP1 и Akt». Лейкемия. 24 (9): 1641–55. Дои:10.1038 / leu.2010.138. ЧВК 3236611. PMID 20574456.
- ^ Meyer-Schwesinger C, Meyer TN, Münster S, Klug P, Saleem M, Helmchen U, Stahl RA (февраль 2009 г.). «Новая роль нейрональной убиквитин С-концевой гидролазы-L1 (UCH-L1) в формировании отростков подоцитов и повреждении подоцитов при гломерулопатиях человека». Журнал патологии. 217 (3): 452–64. Дои:10.1002 / путь.2446. PMID 18985619. S2CID 23851206.
- ^ Ломанн Ф., Сакс М., Мейер Т.Н., Зиверт Х., Линденмейер М.Т., Вих Т., Коэн С.Д., Балабанов С., Шталь Р.А., Мейер-Швезингер С. (июль 2014 г.). «UCH-L1 вызывает гипертрофию подоцитов при мембранозной нефропатии за счет накопления белка». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1842 (7): 945–58. Дои:10.1016 / j.bbadis.2014.02.011. PMID 24583340.
- ^ Петерсон, Иварс (14 октября 2006 г.). «Узлы в белках». Новости науки. Архивировано из оригинал на 2008-04-21. Получено 2008-09-11.
- ^ Вирнау П., Мирный Л.А., Кардар М. (сентябрь 2006 г.). «Сложные узлы в белках: функции и эволюция». PLOS вычислительная биология. 2 (9): e122. Дои:10.1371 / journal.pcbi.0020122. ЧВК 1570178. PMID 16978047.
- ^ а б Лю Ю., Фаллон Л., Лашуэль Х.А., Лю З., Лэнсбери, PT (октябрь 2002 г.). «Ген UCH-L1 кодирует две противоположные ферментативные активности, которые влияют на деградацию альфа-синуклеина и восприимчивость к болезни Паркинсона». Клетка. 111 (2): 209–18. Дои:10.1016 / s0092-8674 (02) 01012-7. PMID 12408865. S2CID 6849108.
- ^ Кабальеро О.Л., Ресто В., Паттураджан М., Меерзаман Д., Гуо М.З., Энглес Дж., Йохем Р., Ратовицкий Е., Сидрански Д., Джен Дж. (Май 2002 г.). «Взаимодействие и совместная локализация PGP9.5 с JAB1 и p27 (Kip1)». Онкоген. 21 (19): 3003–10. Дои:10.1038 / sj.onc.1205390. PMID 12082530.
- ^ МакКеон Дж. Э., Ша Д., Ли Л., Чин Л. С. (май 2015 г.). «Паркин-опосредованное полиубиквитинирование K63 нацелено на С-концевую гидролазу L1 убиквитина для деградации системой аутофагия-лизосома». Клеточные и молекулярные науки о жизни. 72 (9): 1811–24. Дои:10.1007 / s00018-014-1781-2. ЧВК 4395523. PMID 25403879.
дальнейшее чтение
- Healy DG, Abou-Sleiman PM, Wood NW (октябрь 2004 г.). «Генетические причины болезни Паркинсона: УЧЛ-1». Исследования клеток и тканей. 318 (1): 189–94. Дои:10.1007 / s00441-004-0917-3. PMID 15221445. S2CID 22530636.
- Расмуссен Х. Х., ван Дамм Дж., Пуйпе М., Гессер Б., Селис Дж. Э., Вандекеркхов Дж. (Декабрь 1992 г.). «Микропоследовательности 145 белков, записанные в базе данных двумерных гелевых белков нормальных эпидермальных кератиноцитов человека». Электрофорез. 13 (12): 960–9. Дои:10.1002 / elps.11501301199. PMID 1286667. S2CID 41855774.
- Эдвардс Ю. Х., Фокс М. Ф., Пови С., Хинкс Л. Дж., Томпсон Р. Дж., День IN (октябрь 1991 г.). «Ген для нейрон-специфической убиквитин-С-концевой гидролазы (UCHL1, PGP9.5) картируется на хромосоме 4p14». Анналы генетики человека. 55 (Pt 4): 273–8. Дои:10.1111 / j.1469-1809.1991.tb00853.x. PMID 1840236. S2CID 25763146.
- Оноре Б., Расмуссен Х. Х., Вандекеркхов Дж., Селис Дж. Э. (март 1991 г.). «Продукт гена нейронального белка 9.5 (IEF SSP 6104) экспрессируется в культивируемых человеческих фибробластах MRC-5 нормального происхождения и сильно подавляется в их аналогах, трансформированных SV40». Письма FEBS. 280 (2): 235–40. Дои:10.1016 / 0014-5793 (91) 80300-П. PMID 1849484. S2CID 40473683.
- Day IN, Hinks LJ, Thompson RJ (июнь 1990 г.). «Структура человеческого гена, кодирующего белковый продукт гена 9.5 (PGP9.5), нейрон-специфичную С-концевую гидролазу убиквитин». Биохимический журнал. 268 (2): 521–4. Дои:10.1042 / bj2680521. ЧВК 1131465. PMID 2163617.
- Day IN, Thompson RJ (январь 1987 г.). «Молекулярное клонирование кДНК, кодирующей человеческий белок PGP 9.5. Новый цитоплазматический маркер нейронов и нейроэндокринных клеток». Письма FEBS. 210 (2): 157–60. Дои:10.1016/0014-5793(87)81327-3. PMID 2947814. S2CID 39218297.
- Доран Дж. Ф., Джексон П., Кинох П. А., Томпсон Р. Дж. (Июнь 1983 г.). «Выделение PGP 9.5, нового нейрон-специфического белка человека, обнаруженного с помощью двумерного электрофореза высокого разрешения». Журнал нейрохимии. 40 (6): 1542–7. Дои:10.1111 / j.1471-4159.1983.tb08124.x. PMID 6343558. S2CID 24386913.
- Онно М., Накамура Т., Мариаж-Самсон Р., Хиллова Дж., Хилл М. (март 1993 г.). «Онкоген TRE17 человека генерируется из семейства гомологичных полиморфных последовательностей путем изменения одного основания». ДНК и клеточная биология. 12 (2): 107–18. Дои:10.1089 / dna.1993.12.107. PMID 8471161.
- Ларсен С.Н., Прайс Дж.С., Уилкинсон К.Д. (май 1996 г.). «Связывание субстрата и катализ убиквитин С-концевыми гидролазами: идентификация двух остатков активного сайта». Биохимия. 35 (21): 6735–44. Дои:10.1021 / bi960099f. PMID 8639624.
- Best CL, Pudney J, Welch WR, Burger N, Hill JA (апрель 1996 г.). «Локализация и характеристика популяций лейкоцитов в яичнике человека на протяжении менструального цикла и менопаузы». Репродукция человека. 11 (4): 790–7. Дои:10.1093 / oxfordjournals.humrep.a019256. PMID 8671330.
- Д'Андреа В., Малиновский Л., Берни А., Бьянкари Ф., Биассони Л., Ди Маттео Ф. М., Корбеллини Л., Фалво Л., Сантони Ф., Спайроу М., Де Антони Э. (октябрь 1997 г.). «Иммунолокализация PGP 9,5 в нормальной почке и почечно-клеточной карциноме человека». Il Giornale di Chirurgia. 18 (10): 521–4. PMID 9435142.
- Ларсен К.Н., Кранц Б.А., Уилкинсон К.Д. (март 1998 г.). «Субстратная специфичность деубиквитинирующих ферментов: убиквитин C-концевые гидролазы». Биохимия. 37 (10): 3358–68. Дои:10.1021 / bi972274d. PMID 9521656.
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T., Dehejia A, Lavedan C, Gasser T., Steinbach PJ, Wilkinson KD, Polymeropoulos MH (октябрь 1998 г. ). «Путь убиквитина при болезни Паркинсона». Природа. 395 (6701): 451–2. Дои:10.1038/26652. PMID 9774100. S2CID 204997455.
- Вада Х., Кито К., Каски Л.С., Йе Э.Т., Камитани Т. (октябрь 1998 г.). «Расщепление C-конца NEDD8 посредством UCH-L3». Сообщения о биохимических и биофизических исследованиях. 251 (3): 688–92. Дои:10.1006 / bbrc.1998.9532. PMID 9790970.
- Лерой Э., Бойер Р., Полимеропулос М. Х. (декабрь 1998 г.). «Интрон-экзонная структура убиквитин с-концевой гидролазы-L1». ДНК исследования. 5 (6): 397–400. Дои:10.1093 / днарес / 5.6.397. PMID 10048490.
- Линкольн С., Воан Дж., Вуд Н., Бейкер М., Адамсон Дж., Гвинн-Харди К., Линч Т., Харди Дж., Фаррер М. (февраль 1999 г.). «Низкая частота патогенных мутаций в гене убиквитин карбоксиконцевой гидролазы при семейной болезни Паркинсона». NeuroReport. 10 (2): 427–9. Дои:10.1097/00001756-199902050-00040. PMID 10203348.
- Harhangi BS, Фаррер MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T., Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (июль 1999). «Мутация Ile93Met в гене убиквитинкарбоксиконцевой гидролазы-L1 не наблюдается в европейских случаях с семейной болезнью Паркинсона». Письма о неврологии. 270 (1): 1–4. Дои:10.1016 / S0304-3940 (99) 00465-6. PMID 10454131. S2CID 26352360.
- Сайго К., Ван Й.Л., Сух Дж. Г., Яманиши Т., Сакаи Й., Кийосава Х., Харада Т., Итихара Н., Вакана С., Кикучи Т., Вада К. (сентябрь 1999 г.). «Внутригенная делеция в гене, кодирующем убиквитинкарбоксиконцевую гидролазу у мышей gad». Природа Генетика. 23 (1): 47–51. Дои:10.1038/12647. PMID 10471497. S2CID 34253163.
- Меллик Г.Д., Зильбурн, Пенсильвания (октябрь 2000 г.). «Полиморфизм S18Y гена убиквитинкарбоксиконцевой гидролазы-L1 не обеспечивает защиты от идиопатической болезни Паркинсона». Письма о неврологии. 293 (2): 127–30. Дои:10.1016 / S0304-3940 (00) 01510-X. PMID 11027850. S2CID 25234210.
- Шарма Н., Маклин П.Дж., Кавамата Х., Иризарри М.С., Хайман Б.Т. (октябрь 2001 г.). «Альфа-синуклеин имеет измененную конформацию и демонстрирует тесное межмолекулярное взаимодействие с убиквитином в тельцах Леви». Acta Neuropathologica. 102 (4): 329–34. Дои:10.1007 / s004010100369. PMID 11603807. S2CID 33892290.
внешняя ссылка
- Убиквитин + карбокси-терминал + гидролаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Обзор всей структурной информации, доступной в PDB за UniProt: P09936 (Изофермент L1 убиквитинкарбоксил-концевой гидролазы) на PDBe-KB.