WikiDer > Зингибаин
| Зингибаин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
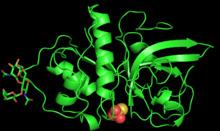 PYMOL сгенерировал трехмерную структуру мономера зингибаина | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.22.67 | ||||||||
| Количество CAS | 246044-91-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Зингибаин, зингипаин, или же протеаза имбиря (EC 3.4.22.67) это цистеиновая протеаза фермент нашел в имбирь (Зингибер лекарственный) корневища.[1][2][3] Это катализирует льготный расщепление из пептиды с пролин остаток в положении P2. Он имеет два различных формы, имбирь протеаза I (GP-I) и протеаза имбиря II (ГП-II).[4]
Как член семейства цистеиновых протеаз папаин, зингибаин имеет несколько структурных и функциональных сходств с более хорошо изученными ферментами, такими как папаин, бромелайн, и актинидин. Эти пептидазы содержат в своих центрах активный остаток цистеина, который катализирует гидролитическое расщепление пептидных связей. Зингибаин известен своей активностью как протеиназа и коллагеназа.[1]
Впервые он был выделен, очищен и опубликован в 1973 г. Ichikawa et al. в Японский женский университет.[5] Недавно было обнаружено, что зингибаин существует как два изоферменты, GP-I и GP-II, которые были выделены с помощью хроматографии, с молекулярной массой приблизительно 22 500 Да.[5]
Механизм
Зингибаин использует каталитическую триаду остатков Cys, His и Asn в своем активном центре для гидролитического расщепления пептидных связей. Присутствие Asn175 стабилизирует имидазол кольцо His, обеспечивая его оптимальное расположение для катализатора гидролиза.
Механизм начинается с передачи протона от Cys25 к His159.[6] Затем сульфид-анион атакует аминокислоту. альфа-углерод, вытесняя аминовая группа, который прикрепляется к His159.[6] Затем альфа-углерод стабилизированной аминокислоты подвергается атаке со стороны молекулы воды, которая замещает сульфид Cys25, превращая аминокислоту в карбоновая кислота, который высвобождается из активного центра фермента.[6]
Экспериментальное внедрение дитиотреитол, известный тиоловая группа Protector, улучшает протеолитическую активность, обеспечивая дополнительную проверку важности центрального остатка цистеина для ферментативной активности.[7]
Зингибаин демонстрирует максимальную скорость оборота при 60 ° C и быстро денатурирует при 70 ° C.[8] Во время приготовления с имбирем протеолиз в значительной степени не затруднен. Оптимальные температурные диапазоны папаина и фицина выше, чем у зингибаина, тогда как бромелайн действует в несколько более низких диапазонах.[7]
Максимальная протеолитическая активность зингибаина наблюдается при pH 6,0, хотя фермент все еще активен в диапазоне pH от 4,5 до 6,0 (оптимальный pH для маринады для мяса).[7]
GP-II, более кислый из двух изоферментов, проявляет число Пи 4,82, а GP-I показывает значения pI 5,05 или 5,16.[1] Эти множественные значения pI подтверждают теорию о том, что GP-I может быть смесью двух белков.
Структура
Зингибаин был впервые очищен и охарактеризован с помощью рентгеновской кристаллографии в 2000 году исследователями из Бостонский университет.[1]
Фермент состоит из 221 аминокислот и гликозилирован 2 N-связанный олигосахарид цепочки на Asn96 и Asn154.[3] Полипептидная цепь зингибаина складывается в два полярных домена примерно равного размера, разделенных центральной нейтральной щелью.[3] Первый домен содержит альфа спирали, а второй - антипараллельный бета-листы.[3] Такое разделение полярных и неполярных областей облегчает белок-белковые взаимодействия между ферментом и большим диапазоном субстратов.[3]
Активный центр зингибаина, расположенный в центральной щели, имеет глубину 5,5 Å и длину 9,5 Å.[3] Активный центр содержит каталитическую триаду Cys25, His159 и Asn175, которые совместно обеспечивают кислотно-щелочной катализ.
Зингибаин проявляет специфичность связывания с пептидными субстратами с пролином в положении P2.[1] Подсайт S2 зингибаина содержит аминокислотную цепь Trp67-Met68-Asn69-Thr133-Ala157, что делает этот сайт слишком компактным для размещения более крупных остатков гидрофобных ароматических субстратов, предпочитаемых другими ферментами семейства папаина.[1] Однако пролин стабилизируется за счет множественных нековалентных взаимодействий с этой областью.
Структура фермента стабилизирована водородные связи, а также сшивание сульфидные связи между тремя парами остатков цистеина (Cys22-Cys63, Cys56-Cys95 и Cys153-Cys200), аналогичные многим другим папаинам.[1]
Хотя фермент существует в растворе в виде мономера, кристаллизованный зингибаин образует тетрамерыили димеры димеров, связанных цепями гликозилирования на каждой субъединице. Зингибаин имеет N-связанные олигосахаридные цепи сложного типа на двух остатках.[1] Цепи имеют длину от 5 до 13 гликозильных единиц и состоят из N-ацетилглюкозамин, фукоза, манноза, и ксилоза. Последовательности сахаров зингибаина почти идентичны олигосахаридам, обнаруженным в лектинах из Японская пагода семена лаккаса а из платан клеток и S-гликопротеинов из Brassica campestris.[1]
Биологическое значение
В корневищах имбиря протеаза имбиря участвует в нескольких функциональных ролях, поддерживая и поддерживая клетки растений.
Зингибаин, как и большинство цистеиновых протеаз, синтезируется в виде 40-50 кДа. пропротеин в цитоплазматическом полисомы привязан к клеточные мембраны.[9] В рамках эндоплазматический ретикулумэти удлиненные цепи помечены значком KDEL Сигнал удержания ER и помещен в большой KDEL пузырьки которые переходят из ER в хранилище белка вакуоли в клеточные стенки.[9]
Зингибаин, вероятно, участвует в хранении белка (в семена или же ткань растения), но преимущественно разрушает и мобилизует запасные белки. Он также может реагировать на абиотический и биотический стрессы, такие как тепловой удар, низкие температуры и обезвоживание, чтобы исключить любые возникающие неправильно свернутые или денатурированный белки.[9]
Использует
Размягчитель мяса
Нравиться папаин из папайи и бромелайн из ананасы, он используется как мясорубка.[10][11]
Было доказано, что при добавлении к приготовлению мяса, обычно в составе сырого или сушеного имбиря, зингибаин увеличивает нежность мяса.[8][12] Размягчение мяса происходит из-за быстрого протеолиза зингибаином основных мышечных белков в мясе, особенно актомиозин и Коллаген I типа, который находится в мышечные суставы.[8]
В то время как другие ферменты папаина, включая папаин, фицин и бромелайн, чаще используются для смягчения мяса, зингибаин проявляет аналогичную или повышенную протеолитическую активность.[11] Фактически, зингибаин - единственная занесенная в каталог протеаза растений с коллагенолитической активностью. Зингибаин может быть предпочтительнее, чем папаин, из-за текстуры получаемого мяса. Хотя папаин может гидролизовать актомиозин, он также расщепляет другие основные тканевые белки, что приводит к мягкой текстуре мяса.[11] Специфичность связывания зингибаина обеспечивает преимущественный гидролиз актомиозина и коллагена I типа.
Зингибаин также используется для ароматизации колбасы и выпечка.[8]
Заменитель сычуга
В течение последних 100 лет протеаза имбиря традиционно использовалась для свертывания молоко создавать имбирный молочный творог, гелеобразный Кантонское блюдо из горячего молока и имбирный сок. Сворачиваемость молока и специфичность протеазы имбиря к протеолизу κ-казеин сделать фермент потенциальным овощем сычужный фермент заменять за производство сыра.
Коагуляция молока традиционно осуществляется путем коагуляции ферментов, извлеченных из таких источников, как сычужный фермент. В сычужном ферменте три химозин изоферменты гидролизуют κ-казеин, основную белковую фракцию молока, между Phe105 и Мет106. Гидрофильные подобласти κ-казеина отщепляются, оставляя в основном гидрофобный агрегат. Таким образом, ферменты дестабилизируют κ-казеин. мицеллы и способствовать слипанию гидрофобных остатков протеина, вызывая свертывание молока.
Основные промышленные недостатки сычужного фермента включают его ограниченное предложение и высокую стоимость, его недоступность для вегетарианцы и практикующие члены некоторых религиозные группы, а также недавние европейские национальные запреты на использование рекомбинантный сычужный фермент теленка.[13] Грибковые протеазы в значительной степени непригодны в качестве заменителей сычужного фермента, и было показано, что ферменты из многих растительных экстрактов дают низкий урожай, плохую консистенцию и горький вкус сыра.[13]
Коммерческие недостатки
Однако неочищенная протеаза имбиря, извлеченная из экстракта имбиря, нестабильна и период полураспада примерно 2 дня при 5 ° C, что затрудняет коммерческое использование.[14] Хотя период полураспада фермента не влияет на его эффективность во время приготовления, эта низкая стабильность при хранении требует улучшения для коммерциализации.
Коммерческие попытки стабилизировать фермент для крупномасштабного производства исследовали потенциальные методы инактивации свободных сульфгидрильная группа в активном центре фермента. Возможности механизма включают окисление сульфгидрила, его обмен на дисульфидные мостики, формируя хинон-тиоловые аддукты или связывание сульфгидрила с ион тяжелого металла.[14] 0.2% аскорбат натрия Было обнаружено, что зингибаин стабилизируется на срок до 14 дней при 5 ° C, тогда как сопоставимые концентрации EDTA и CaCl2 оказал минимальное влияние на стабильность.[14]
Было замечено, что Зингибаин деактивируется через автолиз, что можно предотвратить реакцией активной сульфгидрильной группы с цистин или ПКМБ.[14]
Ацетон порошки представляют собой жизнеспособный коммерческий метод стабилизации зингибаина. После гидрофобного растения полифенолы удаляются из сырого имбиря, ацетон в порошке вводится при низких температурах для обезвоживания мякоти корня.[14] Фермент стабилизируется за счет снижения активности воды, более низких концентраций растительных пигментов и более жестких трехмерных структур при более низких температурах.[14]
Смотрите также
Рекомендации
- ^ а б c d е ж грамм час я Чой К.Х., Лаурсен Р.А. (2000). «Аминокислотная последовательность и гликановые структуры цистеиновых протеаз со специфичностью к пролину из корневища имбиря Zingiber officinale». Евро. J. Biochem. 267 (5): 1516–26. Дои:10.1046 / j.1432-1327.2000.01152.x. PMID 10691991.
- ^ Оцуки К., Тагучи К., Сато К. и др. (1995). «Очистка протеаз имбиря с помощью DEAE-сефарозы и изоэлектрического фокусирования». Биохим. Биофиз. Acta. 1243 (2): 181–4. Дои:10.1016 / 0304-4165 (94) 00145-н. PMID 7873561.
- ^ а б c d е ж Чой К.Х., Лаурсен Р.А., Аллен К.Н. (1999). «2.1 Структура цистеиновой протеазы со специфичностью к пролину из корневища имбиря, Zingiber officinale». Биохимия. 38 (36): 11624–33. Дои:10.1021 / bi990651b. PMID 10512617.
- ^ Хуанг XW, Чен LJ, Луо YB и др. (2011). «Очистка, характеристика и коагулирующие свойства молока протеаз имбиря». J. Dairy Sci. 94 (5): 2259–69. Дои:10.3168 / jds.2010-4024. PMID 21524515.
- ^ а б 喜 美 代, 道;初 世, 佐 々;芳 江, 市 川 (1973). "シ ョ ウ ガ た ん 白 分解 酵素 の 分離 精製". 栄 養 と 食糧 (на японском языке). 26 (6): 377–383. Дои:10.4327 / jsnfs1949.26.377. ISSN 1883-8863.
- ^ а б c Rzychon M, Chmiel D, Stec-Niemczyk J (2004). «Способы ингибирования цистеиновых протеаз». Acta Biochimica Polonica. 51 (4): 861–73. PMID 15625558.
- ^ а б c Томпсон EH, Вольф ID, Аллен CE (1973). «Корневище имбиря: новый источник протеолитического фермента». J. Food Sci. 38 (4): 652–655. Дои:10.1111 / j.1365-2621.1973.tb02836.x.
- ^ а б c d Ли YB, Sehnert DJ, Эшмор CR (1986). «Размягчение мяса протеазой корневища имбиря». J. Food Sci. 51 (6): 1558–1559. Дои:10.1111 / j.1365-2621.1986.tb13860.x.
- ^ а б c Grudkowska M, Zagdańska B (2004). «Многофункциональная роль цистеиновых протеиназ растений». Acta Biochimica Polonica. 51 (3): 609–24. Дои:10.18388 / abp.2004_3547. PMID 15448724.
- ^ Ха М., Бехит А.Е., Карне А. и др. (2012). «Характеристика коммерческих препаратов протеазы папаина, бромелаина, актинидина и зингибаина и их активности в отношении белков мяса». Food Chem. 134 (1): 95–105. Дои:10.1016 / j.foodchem.2012.02.071.
- ^ а б c Ким М., Гамильтон С.Е., Гуддат Л.В. и др. (2007). «Растительная коллагеназа: уникальная коллагенолитическая активность цистеиновых протеаз имбиря». Биохим. Биофиз. Acta. 1770 (12): 1627–35. Дои:10.1016 / j.bbagen.2007.08.003. PMID 17920199.
- ^ Луна СС (2018). «Влияние протеолитических ферментов и экстракта имбиря на тендеризацию M. глубокая грудная мышца от голштинского руля ". Корейский журнал пищевых наук о животных ресурсах. 38 (1): 143–151. Дои:10.5851 / kosfa.2018.38.1.143. ЧВК 5932962. PMID 29725232.
- ^ а б Хашим М.М., Миншенг Д., Икбал М.Ф. и др. (2011). «Корневище имбиря как потенциальный источник коагулирующей цистеиновой протеазы молока». Фитохимия. 72 (6): 458–64. Дои:10.1016 / j.phytochem.2010.12.002. PMID 21353685.
- ^ а б c d е ж Адульятхам П., Овусу-Апентен Р. (2005). «Стабилизация и частичная очистка протеазы из корневища имбиря (Zingiber offinale Роско) ». J. Food Sci. 70 (3): C231 – C234. Дои:10.1111 / j.1365-2621.2005.tb07130.x.
внешняя ссылка
- Зингипаин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
