WikiDer > ДНКаза, активируемая каспазой
| Фактор фрагментации ДНК 40 кДа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
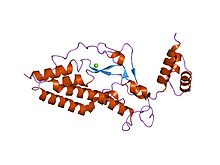 Кристаллическая структура ДНКазы, активируемой каспазой (CAD) | |||||||||
| Идентификаторы | |||||||||
| Символ | DFF40 | ||||||||
| Pfam | PF09230 | ||||||||
| ИнтерПро | IPR015311 | ||||||||
| SCOP2 | 1v0d / Объем / СУПФАМ | ||||||||
| |||||||||
ДНКаза, активируемая каспазой (CAD) или же Субъединица фактора фрагментации ДНК бета это белок что у людей кодируется DFFB ген.[5][6][7] Он расщепляет ДНК во время апоптоза и способствует дифференцировке клеток. Обычно это неактивный мономер, ингибируемый ICAD. Это расщепляется перед димеризацией.
Функция
Апоптоз - это процесс самоуничтожения клетки, который удаляет токсичные и / или бесполезные клетки во время развития млекопитающих и других жизненных процессов. Апоптотический процесс сопровождается сжатием и фрагментацией клеток и ядер и деградацией хромосомной ДНК на нуклеосомные единицы. Фактор фрагментации ДНК (DFF) представляет собой гетеродимерный белок 40 кДа (DFFB) и 45 кДа (DFFA) субъединицы. DFFA является субстратом для каспазы-3 и запускает фрагментацию ДНК во время апоптоза. DFF активируется, когда DFFA расщепляется каспазой-3. Расщепленные фрагменты DFFA диссоциируют от DFFB, активного компонента DFF. Было обнаружено, что DFFB запускает как фрагментацию ДНК, так и конденсацию хроматина во время апоптоза. Для этого гена было обнаружено множество альтернативно сплайсированных вариантов транскриптов, кодирующих различные изоформы, но биологическая ценность некоторых вариантов не была определена.[7]
Несмотря на то, что этот ген присутствует в каждой клетке, этот белок экспрессируется только в различных тканях и различных клетках, таких как поджелудочная железа, сердце, толстая кишка, лейкоциты, простата, яичник, плацента, почки, селезенка и тимус.[8]
Он также известен как нуклеаза, активируемая каспазой (CPAN), фактор фрагментации ДНК 40 (DFF-40), DFF2 и DFFB. Кроме того, существуют другие номенклатуры в результате объединения предыдущих.[8][9][10][11]
Структура
Этот гетеродимер - эндонуклеаза[9][12][13] с высоким содержанием цистеин остатки.[11] Он остается неактивным в растущих клетках, пока связан со своим ингибитором (ICAD, субъединица 45 кДа фактора фрагментации ДНК, DFFA или DFF45), что приводит к сложному ICAD-CAD.[8][9][11][12][14][15][16][17] Их диссоциация позволяет DFF40 олигомеризоваться с образованием большого функционального комплекса, который сам по себе является активной ДНКазой.[11][12][15][16][17]
Субблок DFF40 или CAD
Он весит 40 кДа. Более того, он содержит три домена, составляющих мономер CAD: C1 или N-концевой CAD; C2, которые соответствуют трем отдельным α-цепочкам, и, наконец, C3, которая является самой большой и функционально самой важной. Более того, объединение аминокислот C3 приводит к образованию 5 α-спиралей, 4 β-пластинок и петли на каталитическом C-конце, которые взаимодействуют друг с другом. Таким образом, образуется полость (активный центр), в которую может поместиться ДНК, даже несмотря на то, что существует еще одна связывающая область, ответственная за стабильный комплекс ДНК во время его фрагментации.[8][14][18]
Субблок DFF45 или ICAD
DFFA кодируется альтернативно зашифрованной мРНК, образующей две разные формы: короткую (ICAD-S) и длинную (ICAD-L), которые действуют как специфический шаперон, обеспечивающий правильное сворачивание CAD[10][11][17] Кроме того, он содержит два остатка аспарагиновой кислоты (Asp117 и Asp224), по которым идентифицируется CAD, и, следовательно, он остается связанным до тех пор, пока Каспаза-3 раскалывает этот союз.[10][14]
Процесс активации
Обычно в неапоптотических растущих клетках ДНК, активированная каспазой, находится под контролем и инактивирована в цитоплазме благодаря ассоциации с ее ингибитором, ингибитором ДНКазы, активируемой каспазой (ICAD), также известной как фактор фрагментации ДНК 45 кДа (DFF45).
ICAD кодируется альтернативно сплайсированными мРНК, которые генерируют длинные (ICAD-L) и короткие (ICAD-S) формы ICAD. Следовательно, ICAD выполняет двойную функцию; он действует как ингибитор CAD, а также как сопровождающий для синтеза CAD, способствующего правильной сборке белка.[19]
ICAD имеет два сайта распознавания каспаз в Asp117 и Asp224. Освобождение CAD от ингибирования ICAD достигается расщеплением ICAD по этим остаткам Asp с помощью каспаза-3.[20]
Каспаза-3 активируется в апоптотической клетке.[9] Активация каспазы-3 необходима клеткам на ранних стадиях дифференцировки скелетных миобластов. Его каталитический сайт включает сульфогидрильную группу Cys-285 и имидазольное кольцо его His-237. Caspase-3 His-237 стабилизирует целевой аспартат, вызывая разрыв ассоциации ICAD и CAD, оставляя эндонуклеазу CAD активной, позволяя ей разрушать хромосомную ДНК.
После высвобождения ингибитора и для правильного функционирования два мономера CAD должны объединиться, чтобы сформировать функциональный димер, обладающий вертикальной симметрией.
Взаимодействия
DFFB был показан взаимодействовать с DFFA.[21][22]
Дифференциация клеток
Caspase 3 отвечает за клеточная дифференциация, хотя неясно, как этот вид белка может способствовать клетке апоптоз. Сигналы каспазы, возникающие в результате активации нуклеазы CAD, указывают на то, что дифференцировка клеток происходит из-за модификации CAD в структуре хроматина.
CAD приводит к инициированию разрыва цепи ДНК, который происходит во время терминальной дифференцировки некоторых клеток, таких как клетки скелетных мышц. Нацеливание на промотор p21 отвечает за индукцию дифференцировки клеток, чему способствует изменение ядерного микроокружения ДНК.[23]
Разнообразие клеток возникает из-за дифференцировки клеток, которую связывают с активацией определенных факторов транскрипции. Это также зависит от активности белка или общего сигнала. Фактором, который, по-видимому, способствует большей дифференцировке клеток, является протеаза каспаза-3.[24] Это было идентифицировано как предпоследняя стадия пути апоптоза клетки.
Некоторые исследования показали, что эта дифференциация происходит из-за многих субстратов киназы CAD. Что касается примера скелетных клеток, их дифференцировка связана с расщеплением киназы MST1.[25]
Более того, было замечено, что CAD участвует в формировании генома, ДНК которого разрывается на ранних стадиях дифференцировки клеток. Кроме того, каспаза 3 индуцирует разрывы ДНК в промоторе фактора p21, и этот разрыв цепи связан с экспрессией гена p21.
Апоптотическая смерть клеток
Протеин-каспаза-ДНКаза - это эндонуклеаза, участвующая в процессе апоптоза клетки, которая способствует разрушению ДНК.[26] Апоптотическая смерть клетки - это процесс, выполняемый цистеин протеазы[27] что позволяет животным сохранять гомеостаз, также регулируется другими механизмами, такими как рост и дифференцировка клеток. Этот биологический ответ характеризуется хромосомным ДНКРаспад на крошечные фрагменты внутри ядра клетки.[28] После многих исследований и исследований удалось убедиться, что активируемая каспазой ДНКаза является основной причиной этого разрушения из-за длинного списка стимулов.
Один из экспериментов, проведенных исследователями с целью доказать, что теория основана на введении мутированной формы этого белка как внутрь человеческих клеток TF-1, так и Клетки Jurkat, которые уже прореагировали на обычную (не мутировавшую) форму эндонуклеазы, и они умерли от апоптоза. В результате эти клетки погибли с учетом этой генетической модификации, но не показали разрыва ДНК. Это было ключевым доказательством того, что CAD-форма участвует в этой части процесса, поскольку без ее участия фрагментация не происходила бы.[29]
Позже было обнаружено, что способ, которым этот белок индуцирует разрыв ДНК, объясняется его формами CAD и ICAD, которые облегчают как вход, так и выход в ядре клетки.[28]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000169598 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000029027 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Лю X, Zou H, Slaughter C, Ван X (апрель 1997 г.). «DFF, гетеродимерный белок, который функционирует ниже каспазы-3, чтобы вызвать фрагментацию ДНК во время апоптоза». Клетка. 89 (2): 175–84. Дои:10.1016 / S0092-8674 (00) 80197-X. PMID 9108473. S2CID 14800864.
- ^ Халенбек Р., Макдональд Х., Рулстон А., Чен Т. Т., Конрой Л., Уильямс Л. Т. (апрель 1998 г.). «CPAN, человеческая нуклеаза, регулируемая чувствительным к каспазе ингибитором DFF45». Текущая биология. 8 (9): 537–40. Дои:10.1016 / S0960-9822 (98) 79298-X. PMID 9560346. S2CID 9837862.
- ^ а б «Ген Entrez: фактор фрагментации ДНК DFFB, 40 кДа, бета-полипептид (ДНКаза, активируемая каспазой)».
- ^ а б c d Дэвидсон-колледж. «Дезоксирибонуклеаза, активированная каспазой (CAD)». Получено 21 янв 2016.
- ^ а б c d Юсте В.Дж., Санчес-Лопес И., Соле С., Мубарак Р.С., Баяскас Дж. Р., Дольче Х и др. (Октябрь 2005 г.). «Вклад фактора, вызывающего апоптоз, ДНКазы, активируемой каспазой, и ингибитора ДНКазы, активируемой каспазой, в ядерный фенотип и деградацию ДНК во время апоптоза». Журнал биологической химии. 280 (42): 35670–83. Дои:10.1074 / jbc.M504015200. PMID 16049016.
- ^ а б c Сакахира Х., Ивамацу А., Нагата С. (март 2000 г.). «Специфическая шапероноподобная активность ингибитора каспазо-активируемой ДНКазы для каспазо-активируемой ДНКазы». Журнал биологической химии. 275 (11): 8091–6. Дои:10.1074 / jbc.275.11.8091. PMID 10713130.
- ^ а б c d е Сакахира Х., Энари М., Нагата С. (май 1999 г.). «Функциональные различия двух форм ингибитора каспазо-активируемой ДНКазы, ICAD-L и ICAD-S». Журнал биологической химии. 274 (22): 15740–4. Дои:10.1074 / jbc.274.22.15740. PMID 10336474.
- ^ а б c Джог Н.Р., Фрисони Л., Ши К., Монестиер М., Эрнандес С., Крафт Дж., Прак ЕТ, Кариккио Р. (апрель 2012 г.). «Каспазо-активируемая ДНКаза необходима для поддержания толерантности к ядерным аутоантигенам волчанки». Артрит и ревматизм. 64 (4): 1247–56. Дои:10.1002 / арт.33448. ЧВК 3292632. PMID 22127758.
- ^ Видлак П., Ланушевска Дж., Кэри Р. Б., Гаррард В. Т. (июль 2003 г.). «Субъединичные структуры и стехиометрия белков фактора фрагментации ДНК человека до и после индукции апоптоза». Журнал биологической химии. 278 (29): 26915–22. Дои:10.1074 / jbc.M303807200. PMID 12748178.
- ^ а б c Reh S, Korn C, Gimadutdinow O, Meiss G (декабрь 2005 г.). «Структурная основа для образования стабильного комплекса ДНК с помощью каспазо-активируемой ДНКазы». Журнал биологической химии. 280 (50): 41707–15. Дои:10.1074 / jbc.m509133200. PMID 16236713.
- ^ а б Видлак П., Ли П., Ван Х, Гаррард В. Т. (март 2000 г.). «Предпочтение расщепления апоптотической эндонуклеазой DFF40 (ДНКаза или нуклеаза, активируемая каспазой) на голой ДНК и субстратах хроматина». Журнал биологической химии. 275 (11): 8226–32. Дои:10.1074 / jbc.275.11.8226. PMID 10713148.
- ^ а б Шариф-Аскари Е., Алам А., Реом Е., Бересфорд П. Дж., Скотто К., Шарма К., Ли Д., ДеВольф В. Е., Наттолл М. Е., Либерман Дж., Секали Р. П. (июнь 2001 г.). «Прямое расщепление фактора фрагментации ДНК человека-45 гранзимом В вызывает высвобождение активируемой каспазой ДНКазы и фрагментацию ДНК». Журнал EMBO. 20 (12): 3101–13. Дои:10.1093 / emboj / 20.12.3101. ЧВК 150191. PMID 11406587.
- ^ а б c Лю X, Zou H, Widlak P, Garrard W, Wang X (май 1999). «Активация апоптотической эндонуклеазы DFF40 (активируемая каспазой ДНКаза или нуклеаза). Олигомеризация и прямое взаимодействие с гистоном H1». Журнал биологической химии. 274 (20): 13836–40. Дои:10.1074 / jbc.274.20.13836. PMID 10318789.
- ^ Уэгаки К., Отомо Т., Сакахира Х., Симидзу М., Юмото Н., Кёгоку Ю., Нагата С., Ямадзаки Т. (апрель 2000 г.). «Структура домена CAD каспазо-активируемой ДНКазы и взаимодействие с доменом CAD ее ингибитора». Журнал молекулярной биологии. 297 (5): 1121–8. Дои:10.1006 / jmbi.2000.3643. PMID 10764577.
- ^ PDB: 1V0D; Woo EJ, Kim YG, Kim MS, Han WD, Shin S, Robinson H и др. (Май 2004 г.). «Структурный механизм инактивации и активации CAD / DFF40 в апоптотическом пути». Молекулярная клетка. 14 (4): 531–9. Дои:10.1016 / S1097-2765 (04) 00258-8. PMID 15149602.
- ^ «CASP3 каспаза 3 [Homo sapiens (человек)] - Ген - NCBI».
- ^ Юинг Р.М., Чу П., Элизма Ф., Ли Х., Тейлор П., Клими С. и др. (2007). «Крупномасштабное картирование белок-белковых взаимодействий человека с помощью масс-спектрометрии». Молекулярная системная биология. 3 (1): 89. Дои:10.1038 / msb4100134. ЧВК 1847948. PMID 17353931.
- ^ Маккарти Дж. С., Тох С. Ю., Ли П. (октябрь 1999 г.). «Изучение DFF45 в его роли шаперона и ингибитора: два независимых домена ингибирования нуклеазной активности DFF40». Сообщения о биохимических и биофизических исследованиях. 264 (1): 176–80. Дои:10.1006 / bbrc.1999.1497. PMID 10527860.
- ^ Ларсен Б.Д., Рампалли С., Бернс Л. Э., Брюнет С., Дилворт Ф. Дж., Мегени Л. А. (март 2010 г.). «Каспаза 3 / ДНКаза, активируемая каспазой, способствуют дифференцировке клеток, вызывая разрывы цепи ДНК». Труды Национальной академии наук Соединенных Штатов Америки. 107 (9): 4230–5. Bibcode:2010ПНАС..107.4230Л. Дои:10.1073 / pnas.0913089107. ЧВК 2840077. PMID 20160104.
- ^ Фернандо П., Мегени Л.А. (январь 2007 г.). «Является ли каспазозависимый апоптоз только клеточной дифференцировкой, доведенной до крайности?». Журнал FASEB. 21 (1): 8–17. Дои:10.1096 / fj.06-5912hyp. PMID 17093139.
- ^ Фернандо П., Келли Дж. Ф., Балажи К., Slack RS, Мегени Л.А. (август 2002 г.). «Активность каспазы 3 необходима для дифференциации скелетных мышц». Труды Национальной академии наук Соединенных Штатов Америки. 99 (17): 11025–30. Bibcode:2002PNAS ... 9911025F. Дои:10.1073 / pnas.162172899. ЧВК 123204. PMID 12177420.
- ^ Лай СК, Вонг CH, Ли Ю.П., Ли Хай (июнь 2011 г.). «Опосредованная каспазой-3 деградация конденсина Cap-H регулирует гибель митотических клеток». Гибель клеток и дифференциация. 18 (6): 996–1004. Дои:10.1038 / cdd.2010.165. ЧВК 3131938. PMID 21151026.
- ^ Марсден В.С., О'Коннор Л., О'Рейли Л.А., Силке Дж., Меткалф Д., Экерт П.Г., Хуанг Д.К., Чеккони Ф., Куида К., Томаселли К.Дж., Рой С., Николсон Д.В., Во Д.Л., Булье П., Адамс Дж.М., Штрассер А (октябрь 2002 г.). «Апоптоз, инициированный Bcl-2-регулируемой активацией каспазы независимо от апоптосомы цитохрома с / Apaf-1 / каспаза-9». Природа. 419 (6907): 634–7. Bibcode:2002Натура.419..634М. Дои:10.1038 / природа01101. PMID 12374983. S2CID 4415828.
- ^ а б Энари М., Сакахира Х., Йокояма Х., Окава К., Ивамацу А., Нагата С. (январь 1998 г.). «Активированная каспазой ДНКаза, которая разрушает ДНК во время апоптоза, и ее ингибитор ICAD». Природа. 391 (6662): 43–50. Bibcode:1998Натура 391 ... 43Э. Дои:10.1038/34112. PMID 9422506. S2CID 4407426.
- ^ Макилрой Д., Сакахира Х., Таланян Р. В., Нагата С. (август 1999 г.). «Участие активированной каспазой 3 ДНКазы в межнуклеосомном расщеплении ДНК, вызванном различными апоптотическими стимулами». Онкоген. 18 (31): 4401–8. Дои:10.1038 / sj.onc.1202868. PMID 10442630.
дальнейшее чтение
- Индукция апоптоза (Видео). Наука о гирляндах / YouTube. 2009. Из Мерфи К., Трэверс П., Уолдпорт М., Эренштейн М. (2008). Иммунобиология Laneway (7-е изд.). Нью-Йорк: Наука Гарланд. ISBN 978-0-8153-4123-9.
- Энари М., Сакахира Х., Йокояма Х., Окава К., Ивамацу А., Нагата С. (январь 1998 г.). «Активированная каспазой ДНКаза, которая разрушает ДНК во время апоптоза, и ее ингибитор ICAD». Природа. 391 (6662): 43–50. Bibcode:1998Натура 391 ... 43Э. Дои:10.1038/34112. PMID 9422506. S2CID 4407426.
- Лю X, Ли П, Видлак П, Цзоу Х, Ло Х, Гаррард В. Т., Ван X (июль 1998 г.). «Субъединица фактора фрагментации ДНК массой 40 кДа вызывает фрагментацию ДНК и конденсацию хроматина во время апоптоза». Труды Национальной академии наук Соединенных Штатов Америки. 95 (15): 8461–6. Bibcode:1998PNAS ... 95.8461L. Дои:10.1073 / пнас.95.15.8461. ЧВК 21098. PMID 9671700.
- Мукаэ Н., Энари М., Сакахира Х., Фукуда Й., Инадзава Дж., Тох Х., Нагата С. (август 1998 г.). «Молекулярное клонирование и характеристика ДНКазы, активируемой каспазой человека». Труды Национальной академии наук Соединенных Штатов Америки. 95 (16): 9123–8. Bibcode:1998ПНАС ... 95.9123М. Дои:10.1073 / пнас.95.16.9123. ЧВК 21302. PMID 9689044.
- Гу Дж, Донг Р.П., Чжан С., Маклафлин Д.Ф., Ву М.Х., Шлоссман С.Ф. (июль 1999 г.). «Функциональное взаимодействие DFF35 и DFF45 с нуклеазой фрагментации ДНК, активируемой каспазой, DFF40». Журнал биологической химии. 274 (30): 20759–62. Дои:10.1074 / jbc.274.30.20759. PMID 10409614.
- Маккарти Дж. С., Тох С. Ю., Ли П. (октябрь 1999 г.). «Изучение DFF45 в его роли шаперона и ингибитора: два независимых домена ингибирования нуклеазной активности DFF40». Сообщения о биохимических и биофизических исследованиях. 264 (1): 176–80. Дои:10.1006 / bbrc.1999.1497. PMID 10527860.
- Маккарти Дж. С., Тох С. Ю., Ли П. (октябрь 1999 г.). «Множественные домены DFF45 синергетически связываются с DFF40: роли в расщеплении каспазы и секвестрации активаторного домена DFF40». Сообщения о биохимических и биофизических исследованиях. 264 (1): 181–5. Дои:10.1006 / bbrc.1999.1498. PMID 10527861.
- Луговской А.А., Чжоу П., Чжоу Дж. Дж., Маккарти Дж. С., Ли П., Вагнер Г. (декабрь 1999 г.). «Структура раствора CIDE-N домена CIDE-B и модель взаимодействий CIDE-N / CIDE-N в пути фрагментации ДНК апоптоза». Клетка. 99 (7): 747–55. Дои:10.1016 / S0092-8674 (00) 81672-4. PMID 10619428.
- Джадсон Х., Ван Рой Н., Штамм L, Вандесомпеле Дж., Ван Геле М., Спелеман Ф., Бонтрон Д. Т. (апрель 2000 г.). «Анализ структуры и мутаций гена, кодирующего фактор фрагментации ДНК 40 (нуклеаза, активируемая каспазой), кандидатный ген-супрессор опухоли нейробластомы». Генетика человека. 106 (4): 406–13. Дои:10.1007 / s004390000257. PMID 10830907. S2CID 38271068.
- Отомо Т., Сакахира Х., Уэгаки К., Нагата С., Ямадзаки Т. (август 2000 г.). «Структура гетеродимерного комплекса между CAD-доменами CAD и ICAD». Структурная биология природы. 7 (8): 658–62. Дои:10.1038/77957. PMID 10932250. S2CID 12925074.
- Дурье Ф., Самеджима К., Форчун Дж. М., Канделс-Льюис С., Ошерофф Н., Эрншоу В. К. (2001). «ДНК-топоизомераза IIальфа взаимодействует с нуклеазой CAD и участвует в конденсации хроматина во время апоптоза». Текущая биология. 10 (15): 923–6. Дои:10.1016 / S0960-9822 (00) 00620-5. PMID 10959840. S2CID 17443069.
- Чжоу П., Луговской А.А., Маккарти Дж. С., Ли П., Вагнер Г. (май 2001 г.). «Структура раствора комплекса N-концевых доменов DFF40 и DFF45 и взаимная шаперонная активность DFF40 и DFF45». Труды Национальной академии наук Соединенных Штатов Америки. 98 (11): 6051–5. Bibcode:2001PNAS ... 98.6051Z. Дои:10.1073 / pnas.111145098. ЧВК 33420. PMID 11371636.
- Nie Z, Phenix BN, Lum JJ, Alam A, Lynch DH, Beckett B, Krammer PH, Sekaly RP, Badley AD (ноябрь 2002 г.). «Протеаза ВИЧ-1 обрабатывает прокаспазу 8, чтобы вызвать митохондриальное высвобождение цитохрома с, расщепление каспазы и фрагментацию ядра». Гибель клеток и дифференциация. 9 (11): 1172–84. Дои:10.1038 / sj.cdd.4401094. PMID 12404116. S2CID 38809690.
- Си Си, Лиау С.Ф., Ли С.Н., Се П.С., Лин К.Х., Чу С.М., Liaw YF (Январь 2003 г.). «Аберрантные транскрипты ДНКазы, активируемой каспазой (CAD), в клетках гепатомы человека». Британский журнал рака. 88 (2): 210–6. Дои:10.1038 / sj.bjc.6600695. ЧВК 2377037. PMID 12610505.
- Лю К.Л., Киши Х., Оцука К., Мурагути А. (сентябрь 2003 г.). «Белок теплового шока 70 связывает активированную каспазой ДНКазу и усиливает ее активность в Т-клетках, стимулированных TCR». Кровь. 102 (5): 1788–96. Дои:10.1182 / кровь-2002-11-3499. PMID 12738667.
- Видлак П., Ланушевска Дж., Кэри Р. Б., Гаррард В. Т. (июль 2003 г.). «Субъединичные структуры и стехиометрия белков фактора фрагментации ДНК человека до и после индукции апоптоза». Журнал биологической химии. 278 (29): 26915–22. Дои:10.1074 / jbc.M303807200. PMID 12748178.
- Hillman RT, Green RE, Brenner SE (2005). «Недооцененная роль надзора за РНК». Геномная биология. 5 (2): R8. Дои:10.1186 / gb-2004-5-2-r8. ЧВК 395752. PMID 14759258.
- Баяскас Дж. Р., Юсте В. Дж., Соле С., Санчес-Лопес И., Сегура М. Ф., Перера Р., Комелла Дж. Х (май 2004 г.). «Характеристика вариантов сплайсинга человеческой каспазно-активированной ДНКазы со структурой и функцией CIDE-N». Письма FEBS. 566 (1–3): 234–40. Дои:10.1016 / j.febslet.2004.04.050. PMID 15147901. S2CID 22464440.