WikiDer > Гефирин - Википедия
Гефирин это белок что у людей кодируется GPHN ген.[5][6][7][8][9]
Этот ген кодирует нейронную сборку белок что закрепляет тормозящее нейротрансмиттер рецепторов к постсинаптическому цитоскелету посредством связывания с высоким сродством с доменом субъединицы рецептора и тубулин димеры. В ненейрональных тканях кодируемый белок также необходим для молибден биосинтез кофактора. Мутации в этом гене могут быть связаны с неврологическим заболеванием. гиперекплексия а также привести к дефицит кофактора молибдена.
Ген
Описаны многочисленные альтернативно сплайсированные варианты транскриптов, кодирующие разные изоформы; однако полноразмерная природа всех вариантов транскриптов в настоящее время неизвестна.[8] Производство альтернативно соединенные варианты зависит от некодирование области внутри гена. Пара некодирующих последовательностей «инь-янь», охватывающая гефирин был идентифицирован.[10] Эти последовательности противоположны друг другу и состоят из сотен расходящихся нуклеотидных состояний. Оба этих паттерна уникальны для человека и быстро эволюционировали после отделения от паттерна ДНК своих предков. В гефирин Последовательности инь и янь распространены сегодня в популяциях, представляющих все основные предки человека.
Функция
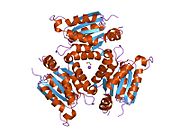
Гефирин - это многофункциональный белок это компонент постсинаптической белковой сети тормозные синапсы. Состоит из 3 домены: N-концевой G-домен, C-концевой E-домен и большой неструктурированный линкерный домен, который их соединяет. Хотя существуют структуры, доступные для тримерных G и димерных E доменов, нет структуры, доступной для полноразмерного белка, что может быть связано с большой неструктурированной областью, которая затрудняет кристаллизацию белка. Но недавнее исследование гефирина полной длины, проведенное малоугловое рассеяние рентгеновских лучей показывает, что он преимущественно образует тримеры и что из-за своей длинной линкерной области он может существовать либо в компактном состоянии, либо в одном из двух расширенных состояний.[11]
Положительный окрашивание антител для гефирина в синапсе большую часть времени согласуется с наличием глицин и / или ГАМКА рецепторы. Тем не менее, некоторые исключения могут возникать, например, в нейроны из Ганглии спинного корня где гефирин отсутствует, несмотря на наличие ГАМКА рецепторы.[9] Гефирин считается основным белком-каркасом в тормозных синапсах, аналогичным по своей функции функции PSD-95 в глутаматергические синапсы.[12][13] Гефирин был идентифицирован по его взаимодействию с рецептор глицина, главный рецепторный белок тормозных синапсов в спинном мозге и стволе мозга. В дополнение к его взаимодействию с рецептором глицина, недавние публикации показали, что гефирин также взаимодействует с внутриклеточной петлей между трансмембранными спиралями TM3 и TM4 альфа- и бета-субъединиц ГАМК.А рецептор.[14]
Гефирин вытесняет рецепторы ГАМК из ГАБАРАП/P130 комплекс, затем подводит рецепторы к синапсу.[15] Попадая в синапс, белок связывается с коллибистин[16] и нейролигин 2.[17] В клетках гефирин образует олигомеры не менее трех субъединиц. Несколько варианты стыковки были описаны, которые предотвращают эту олигомеризацию, не влияя на сродство к рецепторам. Тем не менее они влияют на состав тормозных синапсов и даже могут играть роль при таких заболеваниях, как эпилепсия.[18]
Белок гефирин также необходим для вставки молибден в молибдоптерин.[19]
Как упоминалось выше, гефирин также катализирует две конечные стадии биосинтеза Moco. На предпоследнем этапе N-концевой домен G аденилирует апо-форму молибдоптерина с образованием промежуточного аденилированного молибдоптерина. На терминальной стадии C-концевой E домен катализирует деаденилирование, а также механизм встраивания металла.
Клиническое значение
Люди с височная эпилепсия были обнаружены аномально низкие уровни гефирина в височных долях.[20] В моделях на животных полное отсутствие гефирина приводит к ригидности мышц и смерти сразу после рождения. Скованность в мышцах также является признаком пугающая болезнь, что может быть вызвано мутацией в гене гефирина. А если у человека вырабатываются аутоантитела против гефирина, это может даже привести к синдром скованного человека.[18]
Инь-янь последовательности
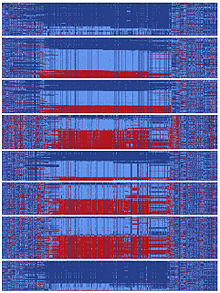
В какой-то момент истории человечества существовала последовательность ДНК, охватывающая гефирин этот раскол и пошел по двум расходящимся эволюционным путям.[10] Эти типы расщеплений могут возникать, когда две популяции становятся изолированными друг от друга или когда хромосомная область не испытывает рекомбинация События. Каждая из двух последовательностей, отделяющихся от предковой, приобрела более сотни мутаций, которые впоследствии стали обычным явлением. Это произошло за относительно короткое время в эволюционном масштабе, поскольку сотни мутаций были зафиксированы в различных последовательностях «инь» и «янь» до миграции человека в Азию. Сообщалось, что в настоящее время азиаты несут почти равное количество последовательностей инь и ян, а глобальные популяции, представляющие все основные предки человека, обладают последовательностями как инь, так и ян.[10] Существование этого массивного паттерна инь-ян предполагает, что два совершенно разных эволюционных пути быстро развивались в течение истории человечества, по-видимому, достигая общей цели усиления регуляции гефирин.
Взаимодействия
GPHN было показано взаимодействовать с Млекопитающие-мишени рапамицина[6] и ARHGEF9.[16]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000171723 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000047454 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Приор П., Шмитт Б., Греннингло Г., Прибилла И., Мультхауп Г., Бейройтер К., Маулет И., Вернер П., Лангош Д., Кирш Дж. (Июль 1992 г.). «Первичная структура и альтернативные варианты сплайсинга гефирина, предполагаемого линкерного белка рецептора глицина-тубулина». Нейрон. 8 (6): 1161–70. Дои:10.1016/0896-6273(92)90136-2. PMID 1319186.
- ^ а б Sabatini DM, Barrow RK, Blackshaw S, Burnett PE, Lai MM, Field ME, Bahr BA, Kirsch J, Betz H, Snyder SH (июнь 1999 г.). «Взаимодействие RAFT1 с гефирином, необходимое для передачи сигналов, чувствительных к рапамицину». Наука. 284 (5417): 1161–4. Дои:10.1126 / science.284.5417.1161. PMID 10325225.
- ^ Фритчи Дж. М., Харви Р. Дж., Шварц Г. (май 2008 г.). «Гефирин: где мы стоим, куда идем?». Тенденции Neurosci. 31 (5): 257–64. Дои:10.1016 / j.tins.2008.02.006. PMID 18403029.
- ^ а б "Entrez Gene: GPHN гефирин".
- ^ а б Лоренцо Л.Е., Годин А.Г., Ван Ф., Сент-Луис М., Карбонетто С., Уайзман П.В., Рибейро-да-Силва А., Де Конинк Ю. (июнь 2014 г.). «Кластеры гефирина отсутствуют в первичных афферентных окончаниях малого диаметра, несмотря на присутствие ГАМК.А Рецепторы ». J. Neurosci. 34 (24): 8300–17. Дои:10.1523 / JNEUROSCI.0159-14.2014. ЧВК 6608243. PMID 24920633.
- ^ а б c Климер С., Темплтон АР, Чжан В. (2015). «Человеческий гефирин заключен в гигантские функциональные некодирующие последовательности инь-янь». Nature Communications. 6: 6534. Дои:10.1038 / ncomms7534. ЧВК 4380243. PMID 25813846. Сложить резюме – ScienceDaily.
- ^ Сандер Б., Триа Г., Шкуматов А.В., Ким Е.Ю., Гроссманн Дж. Г., Тессмер И., Свергун Д. И., Шинделин Х. (октябрь 2013 г.). «Структурная характеристика гефирина с помощью АСМ и МУРР показывает смесь компактного и протяженного состояний». Acta Crystallographica Раздел D. 69 (Pt 10): 2050–60. Дои:10.1107 / S0907444913018714. PMID 24100323.
- ^ Giesemann T, Schwarz G, Nawrotzki R, Berhörster K, Rothkegel M, Schlüter K, Schrader N, Schindelin H, Mendel RR, Kirsch J, Jockusch BM (сентябрь 2003 г.). «Формирование комплекса между постсинаптическим каркасным белком гефирином, профилином и Mena: возможная связь с системой микрофиламентов». J. Neurosci. 23 (23): 8330–9. Дои:10.1523 / JNEUROSCI.23-23-08330.2003. ЧВК 6740687. PMID 12967995.
- ^ Эренспергер М.В., Ханус С., Ванье С., Триллер А., Дахан М. (май 2007 г.). «Множественные состояния ассоциации между рецепторами глицина и гефирином, идентифицированные с помощью анализа SPT». Биофиз. J. 92 (10): 3706–18. Дои:10.1529 / biophysj.106.095596. ЧВК 1853151. PMID 17293395.
- ^ Марич Х.М., Мукерджи Дж., Треттер В., Мосс С.Дж., Шинделин Х. (декабрь 2011 г.). «Опосредованная гефирином γ-аминомасляная кислота типа А и кластеризация рецепторов глицина основаны на общем сайте связывания». J. Biol. Chem. 286 (49): 42105–14. Дои:10.1074 / jbc.M111.303412. ЧВК 3234978. PMID 22006921.
- ^ Тириет, Марк (2013). Медиаторы внутриклеточной сигнализации в системах кровообращения и вентиляции. Нью-Йорк, штат Нью-Йорк: Springer New York. п. 605. ISBN 978-1-4614-4370-4.
- ^ а б Кинс С., Бец Х, Кирш Дж (январь 2000 г.). «Коллибистин, недавно идентифицированный специфический для мозга GEF, вызывает субмембранную кластеризацию гефирина». Nat. Неврологи. 3 (1): 22–9. Дои:10.1038/71096. PMID 10607391.
- ^ Пулопулос А., Арамуни Г., Мейер Дж., Сойкан Т., Хун М., Пападопулос Т., Чжан М., Паарманн И., Фукс К., Харви К., Джедлика П., Шварзахер С.В., Бец Х., Харви Р.Дж., Брозе Н., Чжан В., Вароко Ф. (Сентябрь 2009 г.). «Нейролигин 2 управляет постсинаптической сборкой в перисоматических тормозных синапсах посредством гефирина и коллибистина». Нейрон. 63 (5): 628–42. Дои:10.1016 / j.neuron.2009.08.023. PMID 19755106.
- ^ а б Треттер В., Мукерджи Дж., Марик Х.М., Шинделин Х., Сигарт В., Мосс С.Дж. (2012). «Гефирин, загадочный организатор ГАМКергических синапсов». Front Cell Neurosci. 6: 23. Дои:10.3389 / fncel.2012.00023. ЧВК 3351755. PMID 22615685.
- ^ Рейсс Дж., Джонсон Дж. Л. (июнь 2003 г.). «Мутации в генах биосинтеза молибденового кофактора MOCS1, MOCS2 и GEPH». Гм. Мутат. 21 (6): 569–76. Дои:10.1002 / humu.10223. PMID 12754701.
- ^ Фанг М., Шен Л., Инь Х, Пань Ю. М., Ван Л., Чен Д., Си Цз.и., Сяо З., Ван XF, Чжоу С.Н. (октябрь 2011 г.). «Подавление гефирина в нейронах височной эпилепсии у людей и крысиной модели». Синапс. 65 (10): 1006–14. Дои:10.1002 / син.20928. PMID 21404332.
дальнейшее чтение
- Sassoè-Pognetto M, Fritschy JM (2000). «Мини-обзор: гефирин, главный постсинаптический белок ГАМКергических синапсов». Евро. J. Neurosci. 12 (7): 2205–10. Дои:10.1046 / j.1460-9568.2000.00106.x. PMID 10947798.
- Рейсс Дж., Джонсон Дж. Л. (2003). «Мутации в генах биосинтеза молибденового кофактора MOCS1, MOCS2 и GEPH». Гм. Мутат. 21 (6): 569–76. Дои:10.1002 / humu.10223. PMID 12754701.
- Кирш Дж, Лангош Д., Прайор П., Литтауэр У.З., Шмитт Б., Бец Х. (1991). «Белок, связанный с рецептором глицина 93 кДа, связывается с тубулином». J. Biol. Chem. 266 (33): 22242–5. PMID 1657993.
- Лоренцо Л.Е., Барбе А, Бра Х (март 2004 г.). «Картирование и количественный анализ путей переноса цитоплазмы гефирина в мотонейронах с использованием оптимизированной процедуры трансмиссионной электронной микроскопии с цветным изображением (TEMCI)». Журнал нейроцитологии. 33 (2): 241–9. Дои:10.1023 / B: NEUR.0000030699.74642.7d. PMID 15322382.
- Мейер Г, Кирш Дж, Бец Х, Лангош Д. (1995). «Идентификация гефирин-связывающего мотива на бета-субъединице глицинового рецептора». Нейрон. 15 (3): 563–72. Дои:10.1016/0896-6273(95)90145-0. PMID 7546736.
- Маммото А., Сасаки Т., Асакура Т., Хотта И., Имамура Н., Такахаши К., Мацуура Ю., Ширао Т., Такай Ю. (1998). «Взаимодействие дребрина и гефирина с профилином». Biochem. Биофиз. Res. Сообщество. 243 (1): 86–9. Дои:10.1006 / bbrc.1997.8068. PMID 9473484.
- Kneussel M, Hermann A, Kirsch J, Betz H (1999). «Гидрофобные взаимодействия опосредуют связывание бета-субъединицы глицинового рецептора с гефирином». J. Neurochem. 72 (3): 1323–6. Дои:10.1046 / j.1471-4159.1999.0721323.x. PMID 10037506.
- Кинс С., Бец Х, Кирш Дж (2000). «Коллибистин, недавно идентифицированный специфический для мозга GEF, вызывает субмембранную кластеризацию гефирина». Nat. Неврологи. 3 (1): 22–9. Дои:10.1038/71096. PMID 10607391.
- Нагасе Т., Кикуно Р., Исикава К.И., Хиросава М., Охара О. (2000). «Прогнозирование кодирующих последовательностей неидентифицированных генов человека. XVI. Полные последовательности 150 новых клонов кДНК из мозга, которые кодируют большие белки in vitro». ДНК Res. 7 (1): 65–73. Дои:10.1093 / днарес / 7.1.65. PMID 10718198.
- Батлер М.Х., Хаяси А., Окоши Н., Виллманн С., Беккер С.М., Фенг Г., Де Камилли П., Солимена М. (2000). «Аутоиммунитет к гефирину при синдроме Жесткого человека». Нейрон. 26 (2): 307–12. Дои:10.1016 / S0896-6273 (00) 81165-4. PMID 10839351.
- Kneussel M, Haverkamp S, Fuhrmann JC, Wang H, Wässle H, Olsen RW, Betz H (2000). «Белок, ассоциированный с рецептором γ-аминомасляной кислоты типа A (GABAAR), GABARAP взаимодействует с гефирином, но не участвует в закреплении рецептора в синапсе». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 97 (15): 8594–9. Дои:10.1073 / пнас.97.15.8594. ЧВК 26993. PMID 10900017.
- Reiss J, Gross-Hardt S, Christensen E, Schmidt P, Mendel RR, Schwarz G (2001). «Мутация в гене рецептора нейротрансмиттера - кластеризованного белка гефирина вызывает новую форму дефицита кофактора молибдена». Являюсь. J. Hum. Genet. 68 (1): 208–13. Дои:10.1086/316941. ЧВК 1234914. PMID 11095995.
- Дэвид-Уотин Б (2001). «Ген гефирина человека (GPHN): структура, хромосомная локализация и экспрессия в ненейрональных клетках». Ген. 271 (2): 239–45. Дои:10.1016 / S0378-1119 (01) 00511-X. PMID 11418245.
- Шварц Г., Шредер Н., Мендель Р. Р., Хехт Г. Дж., Шинделин Н. (2001). «Кристаллические структуры человеческого гефирина и растительных Cnx1 G доменов: сравнительный анализ и функциональное значение». J. Mol. Биол. 312 (2): 405–18. Дои:10.1006 / jmbi.2001.4952. PMID 11554796.
- Grosskreutz Y, Hermann A, Kins S, Fuhrmann JC, Betz H, Kneussel M (2002). «Идентификация гефирин-связывающего мотива в коллибистине фактора обмена GDP / GTP». Биол. Chem. 382 (10): 1455–62. Дои:10.1515 / BC.2001.179. PMID 11727829.
- Fuhrmann JC, Kins S, Rostaing P, El Far O, Kirsch J, Sheng M, Triller A, Betz H, Kneussel M (2002). «Гефирин взаимодействует с легкими цепями 1 и 2 динеина, составляющими комплексы моторных белков». J. Neurosci. 22 (13): 5393–402. Дои:10.1523 / JNEUROSCI.22-13-05393.2002. ЧВК 6758200. PMID 12097491.
- Strausberg RL, Feingold EA, Grouse LH, Derge JG, Klausner RD, Collins FS, Wagner L, Shenmen CM, Schuler GD, Altschul SF, Zeeberg B, Buetow KH, Schaefer CF, Bhat NK, Hopkins RF, Jordan H, Moore T. , Макс С.И., Ван Дж., Се Ф., Дьяченко Л., Марусина К., Фармер А.А., Рубин Г.М., Хонг Л., Стэплтон М., Соарес М.Б., Боналдо М.Ф., Казавант Т.Л., Шитц Т.Е., Браунштейн М.Дж., Усдин Т.Б., Тошиюки С., Карнинчи П., Прейндж С., Раха С.С., Локеллано Н.А., Петерс Г.Дж., Абрамсон Р.Д., Муллахи С.Дж., Босак С.А., МакЭван П.Дж., МакКернан К.Дж., Малек Дж.А., Гунаратне П.Х., Ричардс С., Уорли К.С., Хейл С., Гарсия А.М., Гей Л.Дж., Hulyk SW, Villalon DK, Muzny DM, Sodergren EJ, Lu X, Gibbs RA, Fahey J, Helton E, Ketteman M, Madan A, Rodrigues S, Sanchez A, Whiting M, Madan A, Young AC, Shevchenko Y, Bouffard GG , Blakesley RW, Touchman JW, Green ED, Dickson MC, Rodriguez AC, Grimwood J, Schmutz J, Myers RM, Butterfield YS, Krzywinski MI, Skalska U, Smailus DE, Schnerch A, Schein JE, Jones SJ, Marra MA (2003 ). «Создание и первоначальный анализ более 15 000 полноразмерных последовательностей кДНК человека и мыши». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 99 (26): 16899–903. Дои:10.1073 / pnas.242603899. ЧВК 139241. PMID 12477932.
- Waldvogel HJ, Baer K, Snell RG, Во время MJ, Faull RL, Rees MI (2003). «Распределение гефирина в головном мозге человека: иммуногистохимический анализ». Неврология. 116 (1): 145–56. Дои:10.1016 / S0306-4522 (02) 00550-X. PMID 12535948.
внешняя ссылка
- GPHN расположение человеческого гена в Браузер генома UCSC.
- GPHN детали человеческого гена в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB за UniProt: Q9NQX3 (Гефирин) в PDBe-KB.