WikiDer > Дисферлин
Дисферлин также известный как связанный с дистрофией фер-1-подобный белок это белок что у людей кодируется DYSF ген.[5]
Дисферлин связан с скелетные мышцы ремонт.[6] Дефект в гене DYSF, расположенный на хромосома 2p12-14, приводит к нескольким типам мышечная дистрофия; включая Миопатия миёси (ММ), Мышечная дистрофия конечностей тип 2B (LGMD2B) и дистальная миопатия (DM). Снижение или отсутствие дисферлина, называемое дисферлинопатия, обычно проявляется в третьем или четвертом десятилетии жизни и характеризуется слабостью и истощением различных произвольных скелетные мышцы.[7]
Структура
| Семья Ферлин | |
|---|---|
| Идентификаторы | |
| Символ | Дисферлин |
| OPM суперсемейство | 452 |
| Белок OPM | 4ча |
| Мембранома | 205 |
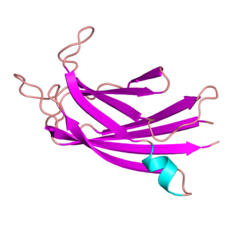
Белок дисферлин человека представляет собой трансмембранный белок типа II массой 237 килодальтон.[8][9][10][11][12] Он содержит большой внутриклеточный цитоплазматический N-концевой домен, крайний C-концевой трансмембранный домен и короткий C-концевой внеклеточный домен. Цитозольный домен дисферлина состоит из семи высококонсервативных C2 домены (C2A-G), которые консервативны в нескольких белках внутри семья Ферлин, включая гомолог дисферлина миоферлин.[13][14][9] Фактически, домен C2 в любом данном положении больше похож на домен C2 в соответствующем положении внутри других членов семейства ферлинов, чем соседний домен C2 в том же самом белке. Это говорит о том, что каждый отдельный домен C2 может фактически играть определенную роль в функции дисферлина. Кристаллическая структура домена C2A дисферлина человека была решена и показывает, что домен C2A изменяет конформацию при взаимодействии с ионами кальция,[9] что согласуется с растущим количеством доказательств, предполагающих, что домен C2A играет роль в кальций-зависимом связывании липидов.[15] В дополнение к доменам C2 дисферлин также содержит домены «FerA» и «DysF». Мутации как в FerA[16] и DysF[17] может вызвать мышечные дистрофии. Домен DysF имеет интересную структуру, поскольку он содержит один домен DysF в другом домене DysF в результате дупликации гена; однако функция этого домена в настоящее время неизвестна.[17] Домен FerA является консервативным среди всех членов семейства белков ферлина. Было обнаружено две точечных мутации в домене дисферлина FerA, которые были связаны с мышечной дистрофией. Домен FerA представляет собой пучок из четырех спиралей, и он может взаимодействовать с мембраной, как правило, кальций-зависимым образом.[16]
Функция
Наиболее интенсивно изучается роль дисферлина в клеточном процессе, называемом восстановлением мембраны. Восстановление мембраны - важнейший механизм, с помощью которого клетки способны заделывать драматические раны плазматической мембраной. Считается, что мышцы особенно подвержены ранениям мембран, учитывая, что мышечные клетки передают большую силу и подвергаются циклам сокращения. Дисферлин высоко экспрессируется в мышцах и гомологичен белкам семейства ферлинов, которые, как считается, регулируют слияние мембран у самых разных видов и типов клеток.[18] Несколько линий доказательств предполагают, что дисферлин может участвовать в восстановлении мембран в мышцах. Во-первых, мышечные волокна с дефицитом дисферлина демонстрируют накопление везикул (которые имеют решающее значение для восстановления мембраны в немышечных клетках) возле повреждений мембраны, что указывает на то, что дисферлин может потребоваться для слияния восстанавливающих пузырьков с плазматической мембраной. Кроме того, мышечные волокна с дефицитом дисферлина поглощают внеклеточные красители в большей степени, чем мышечные волокна дикого типа, после лазерно-индуцированного ранения in vitro.[19] Дисферлин также заметно обогащен при поражении мембран несколькими дополнительными белками, которые, как считается, участвуют в повторном закрытии мембраны, включая аннексин и MG53.[20] Неясно, как именно дисферлин способствует повторному закрытию мембран, но биохимические данные указывают на то, что дисферлин может связывать липиды кальций-зависимым образом, что согласуется с ролью дисферлина в регулировании слияния репарационных везикул с сарколеммой во время восстановления мембраны.[21] Более того, визуализация живых клеток мышечных трубок, экспрессирующих дисферлин-eGFP, показывает, что дисферлин локализуется в клеточном компартменте, который реагирует на повреждение путем образования больших дисферлин-содержащих пузырьков, и образование этих пузырьков может способствовать заживлению ран.[22] Дисферлин также может участвовать в патогенезе болезни Альцгеймера.[23]
Взаимодействия
Было показано, что дисферлин взаимодействовать с Кавеолин 3 в скелетных мышцах,[24] и это взаимодействие, как полагают, удерживает дисферлин внутри плазматической мембраны.[25] Дисферлин также взаимодействует с MG53, и считается, что функциональное взаимодействие между дисферлином, кавеолином-3 и MG53 имеет решающее значение для восстановления мембран в скелетных мышцах.[26]
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000135636 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000033788 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Пассос-Буэно М.Р., Ричард I, Вайнзоф М., Фужерус Ф., Вайссенбах Дж., Бру О, Коэн Д., Акияма Дж., Мари С.К., Карвалью А.А. (май 1993 г.). «Доказательства генетической гетерогенности аутосомно-рецессивных взрослых форм мышечной дистрофии конечностей и пояса после анализа сцепления с зондами 15q в бразильских семьях». Журнал медицинской генетики. 30 (5): 385–7. Дои:10.1136 / jmg.30.5.385. ЧВК 1016373. PMID 8320700.
- ^ «Ген Энтреза: DYSF дисферлин, мышечная дистрофия пояса конечностей 2B (аутосомно-рецессивный)».
- ^ Медицинский центр Лейденского университета, Центр человеческой и клинической генетики - Дисферлин Проверено 21 июня 2007 года.
- ^ Кавахара, Генри; Серафини, Питер Р .; Майерс, Дженнифер А .; Александр, Мэтью С .; Кункель, Луис М. (23 сентября 2011 г.). «Характеристика дисферлина рыбок данио с помощью морфолино нокдауна». Сообщения о биохимических и биофизических исследованиях. 413 (2): 358–363. Дои:10.1016 / j.bbrc.2011.08.105. ISSN 1090-2104. ЧВК 4526276. PMID 21893049.
- ^ а б c Фусон, Керри; Райс, Энн; Маллинг, Райан; Снег, Адам; Наяк, Камакши; Шанбхоге, Праджня; Мейер, Остин Дж .; Редпат, Грегори М. И .; Хиндерлитер, Энн (07.01.2014). «Альтернативный сплайсинг дисферлина C2A обеспечивает Ca²-зависимое и Ca²-независимое связывание для восстановления мембраны». Структура. 22 (1): 104–115. Дои:10.1016 / j.str.2013.10.001. ISSN 1878-4186. ЧВК 5993433. PMID 24239457.
- ^ Demonbreun, Alexis R .; Аллен, Мэдисон V .; Уорнер, Джеймс Л .; Бэрфилд, Дэвид Ю.; Кришнан, Свати; Swanson, Kaitlin E .; Эрли, Джуди У .; МакНелли, Элизабет М. (июнь 2016 г.). «Усиленная мышечная дистрофия из-за потери дисферлина сопровождается нарушением транслокации аннексина A6 после разрушения сарколеммы». Американский журнал патологии. 186 (6): 1610–1622. Дои:10.1016 / j.ajpath.2016.02.005. ISSN 1525-2191. ЧВК 4901136. PMID 27070822.
- ^ Каччоттоло, Мафальда; Нумитон, Гельсомина; Аурино, Стефания; Казерта, Имма Розария; Фанин, Марина; Политано, Луиза; Минетти, Карло; Риччи, Энцо; Пилузо, Джулио (сентябрь 2011 г.). «Мышечная дистрофия с выраженным дефицитом дисферлина постоянно вызывается первичными мутациями гена дисферлина». Европейский журнал генетики человека. 19 (9): 974–980. Дои:10.1038 / ejhg.2011.70. ISSN 1476-5438. ЧВК 3179367. PMID 21522182.
- ^ Мацуда, Чи; Киёсуэ, Казуюки; Нишино, Ичизо; Гото, Юичи; Хаяси, Юкико К. (2015-10-29). «Дисферлинопатические фибробласты являются дефектными при ремонте плазматической мембраны». PLOS токи. 7. Дои:10.1371 / currents.md.5865add2d766f39a0e0411d38a7ba09c. ISSN 2157-3999. ЧВК 4639325. PMID 26579332.
- ^ Вафиадаки Э., Рейс А., Кеерс С., Харрисон Р., Андерсон Л. В., Раффельсбергер Т., Иванова С., Хогер Х., Биттнер Р. Э., Бушби К., Башир Р. (2001). «Клонирование гена дисферлина мыши и геномная характеристика мутации SJL-Dysf». NeuroReport. 12 (3): 625–9. Дои:10.1097/00001756-200103050-00039. PMID 11234777. S2CID 22800606.
- ^ Абдулла Назиш; Падманараяна, Муругеш; Марти, Наоми Дж .; Джонсон, Колин П. (21 января 2014 г.). «Количественное определение свойств связывания кальция и мембран С2-доменов дисферлина». Биофизический журнал. 106 (2): 382–389. Bibcode:2014BpJ ... 106..382A. Дои:10.1016 / j.bpj.2013.11.4492. ISSN 1542-0086. ЧВК 3907215. PMID 24461013.
- ^ Терриен С., Ди Фульвио С., Пиклз С., Синнрайх М. (2009). «Характеристика специфичности связывания липидов C2-доменов дисферлина выявляет новые взаимодействия с фосфоинозитидами». Биохимия. 48 (11): 2377–84. Дои:10.1021 / bi802242r. PMID 19253956.
- ^ а б Harsini, Faraz M .; Чебролу, Суканья; Fuson, Kerry L .; Белый, Марка А .; Райс, Энн М .; Саттон, Р. Брайан (19.07.2018). «FerA представляет собой связывающий мембрану домен с четырьмя спиралями в семействе Ferlin белков слияния мембран». Научные отчеты. 8 (1): 10949. Bibcode:2018НатСР ... 810949H. Дои:10.1038 / s41598-018-29184-1. ISSN 2045-2322. ЧВК 6053371. PMID 30026467.
- ^ а б Сула, Алтын; Cole, Ambrose R .; Йейтс, Корин; Оренго, Кристина; Keep, Николас Х. (17 января 2014 г.). "Кристаллические структуры внутреннего домена DysF человеческого дисферлина". BMC Структурная биология. 14: 3. Дои:10.1186/1472-6807-14-3. ISSN 1472-6807. ЧВК 3898210. PMID 24438169.
- ^ Башир Р., Бриттон С., Страчан Т., Кеерс С., Вафиадаки Е., Лако М., Ричард I, Маршан С., Бург Н., Аргов З., Садех М., Махджне И., Маркони Г., Пассос-Буэно М.Р., Морейра Эде С., Зац М. , Бекманн Дж. С., Бушби К. (1998). «Ген, связанный с фактором сперматогенеза Caenorhabditis elegans fer-1, мутирован при мышечной дистрофии конечностей типа 2B». Nat. Genet. 20 (1): 37–42. Дои:10.1038/1689. PMID 9731527. S2CID 24234676.
- ^ Bansal D, Miyake K, Vogel SS, Groh S, Chen CC, Williamson R, McNeil PL, Campbell KP (2003). «Восстановление дефектной мембраны при мышечной дистрофии с дефицитом дисферлина». Природа. 423 (6936): 168–72. Bibcode:2003Натура.423..168Б. Дои:10.1038 / природа01573. PMID 12736685. S2CID 4402938.
- ^ Roostalu U, Strähle U (2012). «Визуализация in vivo молекулярных взаимодействий в поврежденной сарколемме». Dev. Клетка. 22 (3): 515–29. Дои:10.1016 / j.devcel.2011.12.008. PMID 22421042.
- ^ Абдулла Н., Падманараяна М., Марти Н.Дж., Джонсон С.П. (2014). «Количественное определение свойств связывания кальция и мембран С2-доменов дисферлина». Биофиз. J. 106 (2): 382–9. Bibcode:2014BpJ ... 106..382A. Дои:10.1016 / j.bpj.2013.11.4492. ЧВК 3907215. PMID 24461013.
- ^ Макдэйд-младший, Мишель Д.Е. (2014). "Слияние везикул-везикул, вызванное повреждением мембраны, дисферлин-содержащих везикул в мышечных клетках требует микротрубочек и кинезина". Гм. Мол. Genet. 23 (7): 1677–86. Дои:10.1093 / hmg / ddt557. ЧВК 3943514. PMID 24203699.
- ^ Chen JA, Wang Q, Davis-Turak J, et al. (Апрель 2015 г.). «Мультианцестральное исследование экзомного массива по всему геному болезни Альцгеймера, лобно-височной деменции и прогрессирующего надъядерного паралича». JAMA Неврология. 72 (4): 414–22. Дои:10.1001 / jamaneurol.2014.4040. ЧВК 4397175. PMID 25706306.
- ^ Мацуда С., Хаяси Ю.К., Огава М., Аоки М., Мураяма К., Нишино И., Нонака И., Арахата К., Браун Р.Х. (август 2001 г.). «Белки сарколеммы дисферлин и кавеолин-3 взаимодействуют в скелетных мышцах». Гм. Мол. Genet. 10 (17): 1761–6. Дои:10.1093 / hmg / 10.17.1761. PMID 11532985.
- ^ Эрнандес-Девьес DJ, Howes MT, Laval SH, Bushby K, Hancock JF, Parton RG (2008). «Кавеолин регулирует эндоцитоз белка восстановления мышц дисферлина» (PDF). J. Biol. Chem. 283 (10): 6476–88. Дои:10.1074 / jbc.M708776200. PMID 18096699. S2CID 8337318.
- ^ Цай К., Вайследер Н., Ко Дж. К., Комадзаки С., Сунада Й., Ниси М., Такешима Х., Ма Дж. (2009). «Дефекты восстановления мембраны при мышечной дистрофии связаны с изменением взаимодействия между MG53, кавеолином-3 и дисферлином». J. Biol. Chem. 284 (23): 15894–902. Дои:10.1074 / jbc.M109.009589. ЧВК 2708885. PMID 19380584.
дальнейшее чтение
- Беджауи К., Хирабаяши К., Хентати Ф., Хейнс Дж. Л., Бен Хамида С., Белал С., Миллер Р. Г., Маккенна-Ясек Д., Вайссенбах Дж., Роуленд Л. П. (1995). «Связывание локуса миопатии Миёси (дистальная аутосомно-рецессивная мышечная дистрофия) с хромосомой 2p12-14». Неврология. 45 (4): 768–72. Дои:10.1212 / wnl.45.4.768. PMID 7723968. S2CID 31029040.
- Башир Р., Страчан Т., Кеерс С., Стивенсон А., Махджне И., Маркони Г., Нашеф Л., Бушби К.М. (1994). «Ген аутосомно-рецессивной мышечной дистрофии конечностей-пояса отображается на хромосоме 2р». Гм. Мол. Genet. 3 (3): 455–7. Дои:10,1093 / чмг / 3.3.455. PMID 8012357.
- Лю Дж., Аоки М., Илла И., Ву К., Фардо М., Анджелини К., Серрано К., Уртизберея Дж. А., Хентати Ф., Хамида М.Б., Боглега С., Калпер Э.Дж., Амато А.А., Босси К., Олтьен Дж., Бежауи К., Маккенна- Ясек Д., Хослер Б.А., Шурр Э., Арахата К., де Йонг П.Дж., Браун Р.Х. (1998). «Дисферлин, новый ген скелетных мышц, мутировал при миопатии Миёси и мышечной дистрофии пояса конечностей». Nat. Genet. 20 (1): 31–6. Дои:10.1038/1682. PMID 9731526. S2CID 12018395.
- Башир Р., Бриттон С., Страчан Т., Кеерс С., Вафиадаки Е., Лако М., Ричард I, Маршан С., Бург Н., Аргов З., Садех М., Махджне И., Маркони Г., Пассос-Буэно М.Р., Морейра Эде С., Зац М. , Бекманн Дж. С., Бушби К. (1998). «Ген, связанный с фактором сперматогенеза Caenorhabditis elegans fer-1, мутирован при мышечной дистрофии конечностей типа 2B». Nat. Genet. 20 (1): 37–42. Дои:10.1038/1689. PMID 9731527. S2CID 24234676.
- Андерсон Л.В., Дэвисон К., Мосс Дж. А., Янг К., Каллен М. Дж., Уолш Дж., Джонсон М. А., Башир Р., Бриттон С., Кеерс С., Аргов З., Махнех И., Фужерусс Ф., Бекманн Дж. С., Бушби К. М. (1999). «Дисферлин представляет собой белок плазматической мембраны и экспрессируется на ранних этапах развития человека». Гм. Мол. Genet. 8 (5): 855–61. Дои:10,1093 / hmg / 8,5,855. PMID 10196375.
- Вейлер Т., Башир Р., Андерсон Л. В., Дэвисон К., Мосс Дж. А., Бриттон С., Найлен Е., Кеерс С., Вафиадаки Е., Гринберг С. Р., Бушби С. Р., Врогеманн К. (1999). «Идентичная мутация у пациентов с мышечной дистрофией пояса конечностей типа 2B или миопатией Миёси предполагает роль гена (ов) модификатора». Гм. Мол. Genet. 8 (5): 871–7. Дои:10,1093 / hmg / 8,5,871. PMID 10196377.
- Мацуда К., Аоки М., Хаяси Ю.К., Хо М.Ф., Арахата К., Браун Р.Х. (1999). «Дисферлин - это поверхностный мембранно-ассоциированный белок, который отсутствует при миопатии Миёси». Неврология. 53 (5): 1119–22. Дои:10.1212 / wnl.53.5.1119. PMID 10496277. S2CID 6068681.
- Илла I, Серрано-Мунуэра С., Галлардо Э., Ласа А., Рохас-Гарсия Р., Палмер Дж., Галлано П., Байгет М., Мацуда С., Браун Р. Х. (2001). «Дистальная миопатия переднего компартмента: мутация дисферлина, вызывающая новый фенотип мышечной дистрофии». Анна. Neurol. 49 (1): 130–4. Дои:10.1002 / 1531-8249 (200101) 49: 1 <130 :: AID-ANA22> 3.0.CO; 2-0. PMID 11198284.
- Aoki M, Liu J, Richard I, Bashir R, Britton S, Keers SM, Oeltjen J, Brown HE, Marchand S, Bourg N, Beley C, McKenna-Yasek D, Arahata K, Bohlega S, Cupler E, Illa I, Majneh I, Barohn RJ, Urtizberea JA, Fardeau M, Amato A, Angelini C, Bushby K, Beckmann JS, Brown RH (2001). «Геномная организация гена дисферлина и новые мутации в миопатии Миёси». Неврология. 57 (2): 271–8. Дои:10.1212 / wnl.57.2.271. PMID 11468312. S2CID 31959549.
- Мацуда С., Хаяси Ю.К., Огава М., Аоки М., Мураяма К., Нишино И., Нонака И., Арахата К., Браун Р.Х. (2001). «Белки сарколеммы дисферлин и кавеолин-3 взаимодействуют в скелетных мышцах». Гм. Мол. Genet. 10 (17): 1761–6. Дои:10.1093 / hmg / 10.17.1761. PMID 11532985.
- Икезоэ К., Фуруя Х, Охьяги Й, Осоэгава М., Нишино И., Нонака И., Кира Дж. (2003). «Экспрессия дисферлина в тубулярных агрегатах: их возможное отношение к стрессу эндоплазматического ретикулума». Acta Neuropathol. 105 (6): 603–9. Дои:10.1007 / s00401-003-0686-1. PMID 12664320. S2CID 7734282.
- фон Телль Д., Брудер С.Е., Андерсон Л.В., Анврет М., Альберг Г. (2003). «Уточненное картирование области дистальной миопатии Веландера на хромосоме 2p13 позиционирует новую область-кандидат теломерную локус DYSF». Нейрогенетика. 4 (4): 173–7. Дои:10.1007 / s10048-003-0154-z. PMID 12836053. S2CID 27539044.
- Леннон NJ, Kho A, Bacskai BJ, Perlmutter SL, Hyman BT, Brown RH (2003). «Дисферлин взаимодействует с аннексинами A1 и A2 и опосредует заживление сарколеммальных ран». J. Biol. Chem. 278 (50): 50466–73. Дои:10.1074 / jbc.M307247200. PMID 14506282.
- Кац Дж.С., Рандо Т.А., Барон Р.Дж., Саперштейн Д.С., Джексон К.Э., Виклунд М., Амато А.А. (2003). «Поздняя дистальная мышечная дистрофия, поражающая задние икры». Мышечный нерв. 28 (4): 443–8. Дои:10.1002 / mus.10458. PMID 14506716. S2CID 29825709.
- Конфалониери П., Олива Л., Андреетта Ф., Лоренцони Р., Дасси П., Мариани Э., Моранди Л., Мора М., Корнелио Ф., Мантегацца Р. (2003). «Воспаление мышц и повышающая регуляция класса I MHC при мышечной дистрофии с недостатком дисферлина: иммунопатологическое исследование». J. Neuroimmunol. 142 (1–2): 130–6. Дои:10.1016 / S0165-5728 (03) 00255-8. PMID 14512171. S2CID 37727809.
- Фокстон Р.М., Лаваль С.Х., Бушби К.М. (2004). «Характеристика промотора дисферлина скелетных мышц». Евро. J. Hum. Genet. 12 (2): 127–31. Дои:10.1038 / sj.ejhg.5201092. PMID 14560310.
- Cagliani R, Fortunato F, Giorda R, Rodolico C, Bonaglia MC, Sironi M, D'Angelo MG, Prelle A, Locatelli F, Toscano A, Bresolin N, Comi GP (2003). «Молекулярный анализ пациентов с LGMD-2B и MM: идентификация новых мутаций DYSF и возможный эффект основателя в итальянской популяции». Neuromuscul. Disord. 13 (10): 788–95. Дои:10.1016 / S0960-8966 (03) 00133-0. PMID 14678801. S2CID 23179310.
- Капанни С., Сабателли П., Маттиоли Е., Огнибене А., Колумбаро М., Латтанци Г., Мерлини Л., Минетти С., Маральди Н. М., Squarzoni S (2003). «Дисферлин у пациента с гиперэктомией с мутацией кавеолина 3 и в клетках C2C12 после ингибирования киназы p38 MAP». Exp. Мол. Med. 35 (6): 538–44. Дои:10.1038 / emm.2003.70. PMID 14749532.
- Брюсс М., Хоманн Дж., Молдерингс Дж. Дж. (2004). «[Дисферлинопатия как внепеченочная причина повышения сывороточных трансаминаз]». Med. Клин. (Мюнхен). 99 (6): 326–9. Дои:10.1007 / s00063-004-1046-1. PMID 15221058. S2CID 30657667.
- Хуанг Y, де Морре А., ван Ремортер А., Бушби К., Франц Р. Р., ден Даннен Дж. Т., ван дер Маарель С. М. (2008). «Кальпаин 3 является модулятором белкового комплекса дисферлина в скелетных мышцах». Гм. Мол. Genet. 17 (12): 1855–66. Дои:10.1093 / hmg / ddn081. ЧВК 2900895. PMID 18334579.