WikiDer > Тропонин I
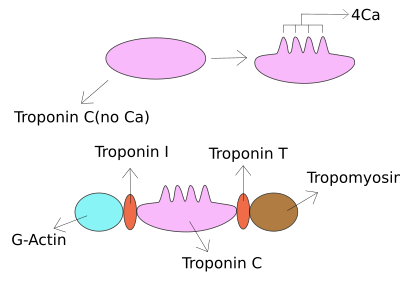
Тропонин I это сердечная и скелетная мышца белковая семья. Это часть тропонин белковый комплекс, где он связывается с актин в тонком миофиламенты удерживать на месте актин-тропомиозиновый комплекс. Тропонин I предотвращает миозин от связывания с актином в расслабленной мышце. Когда кальций связывается с тропонином С, он вызывает конформационные изменения, которые приводят к смещению тропонина I. После этого тропомиозин покидает место связывания миозина на актине, что приводит к сокращению мышцы. Письмо я дается из-за его ингибирующего характера. Это полезный маркер при лабораторной диагностике сердечного приступа.[1] Это происходит при другой концентрации в плазме, но при тех же обстоятельствах, что и тропонин Т - любой тест может быть выполнен для подтверждения повреждения сердечной мышцы, и лаборатории обычно предлагают тот или иной тест.[2]
Три паралоги с уникальными тканеспецифическими паттернами экспрессии у людей, перечисленных ниже с указанием их местоположения и OMIM присоединения:
- Изоформа тропонина I в медленно сокращающихся скелетных мышцах, TNNI1 (1q31.3, 191042)
- Изоформа тропонина I быстро сокращающихся скелетных мышц, TNNI2 (11п15.5, 191043)
- Сердечный тропонин I, TNNI3 (19q13.4, 191044)
cTnI
Сердечный тропонин I, часто обозначаемый как cTnI, представлен в ткани сердечной мышцы одной изоформой с молекулярной массой 23,9 кДа. Он состоит из 209 аминокислотных остатков. Теоретический pI cTnI составляет 9,05.[3] cTnI отличается от других тропонинов своим N-концевым удлинением из 26 аминокислот. Это расширение содержит два серина, остатки 23 и 24, которые фосфорилируются протеинкиназа А в ответ на бета-адренергическую стимуляцию и важен для увеличения инотропного ответа.[4] Фосфорилирование cTnI изменяет конформацию белка и модифицирует его взаимодействие с другими тропонинами, а также взаимодействие с антителами против TnI. Эти изменения изменяют ответ миофиламентов на кальций и представляют интерес для лечения сердечной недостаточности. Мониторинг множественных реакций cTnI человека показал, что существует 14 участков фосфорилирования, и наблюдаемый паттерн фосфорилирования этих участков изменяется в ответ на заболевание.[5] Было показано, что cTnI фосфорилируется протеинкиназой A, протеинкиназа C, протеинкиназа G, и p21-активированная киназа 3.[6] Значительная часть cTnI, попадающая в кровоток пациента, фосфорилируется.[7] Уже более 15 лет cTnI известен как надежный маркер повреждения ткани сердечной мышцы. Он считается более чувствительным и значительно более специфичным при диагностике инфаркта миокарда, чем «золотой маркер«последних десятилетий - СК-МБ, а также всего креатинкиназа, миоглобин и лактатдегидрогеназа изоферменты.
Тропонин I не совсем специфичен для вторичного повреждения миокарда после инфаркта. Другие причины повышенного уровня тропонина I включают: хроническая почечная недостаточность, сердечная недостаточность, субарахноидальное кровотечение и легочная эмболия.[8][9]
В ветеринарии отмечалось повышение cTnI в результате повреждения миокарда после токсического действия ионофоров у крупного рогатого скота.[10]
Смотрите также
внешняя ссылка
- Тропонин + I в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
Рекомендации
- ^ «Тропонин». лаборатория.
- ^ «Тропонин». labtestsonline.org/. 2019-01-09. Получено 2019-07-16.
- ^ Козловский, Л.П. (21 октября 2016 г.). «IPC - Калькулятор изоэлектрической точки». Биология Директ. 11 (1): 55. Дои:10.1186 / s13062-016-0159-9. ЧВК 5075173. PMID 27769290.
- ^ Соларо Р.Дж., Мойр А.Дж., Перри С.В. (1976). «Фосфорилирование тропонина I и инотропный эффект адреналина в перфузируемом сердце кролика». Природа. 262 (5569): 615–616. Дои:10.1038 / 262615a0. PMID 958429.
- ^ Чжан П., Кирк, Дж. А., Джи В., Дос Ремедиос К. Г., Касс Д. А., Ван Эйк Дж. Э., Мерфи А. М. (2012). «Мониторинг множественных реакций для определения сайт-специфичных фосфорилированных остатков тропонина I в сердце человека с нарушением нормального функционирования». Тираж. 126 (15): 1828–1837. Дои:10.1161 / cycleaha.112.096388. ЧВК 3733556. PMID 22972900.CS1 maint: несколько имен: список авторов (связь)
- ^ Layland J, Solaro RJ, Shah AM (2005). «Регулирование сократительной функции сердца за счет фосфорилирования тропонина I». Сердечно-сосудистые исследования. 66 (1): 12–21. Дои:10.1016 / j.cardiores.2004.12.022. PMID 15769444.
- ^ Labugger R, Organ L, Collier C, Atar D, Van Eyk JE (2000). «Обширная модификация тропонина I и Т, обнаруженная в сыворотке крови пациентов с острым инфарктом миокарда». Тираж. 102 (11): 1221–1226. Дои:10.1161 / 01.cir.102.11.1221. PMID 10982534.
- ^ Манну Г.С., Несердечное использование и значение сердечных тропонинов. Scott Med J, 2014. 59 (3): стр. 172-8.
- ^ Танинди, Асил; Джемри, Мустафа (2011). «Повышение уровня тропонина при состояниях, отличных от острых коронарных синдромов». Здоровье сосудов и управление рисками. 7: 597–603. Дои:10.2147 / VHRM.S24509. ЧВК 3212425. PMID 22102783.
- ^ https://www.frontiersin.org/articles/10.3389/fvets.2020.00531/abstract