WikiDer > Фосфолипаза D
| Фосфолипаза D | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | PLDc | ||||||||
| Pfam | PF03009 | ||||||||
| ИнтерПро | IPR001736 | ||||||||
| УМНАЯ | SM00155 | ||||||||
| PROSITE | PDOC50035 | ||||||||
| SCOP2 | 1быр / Объем / СУПФАМ | ||||||||
| OPM суперсемейство | 118 | ||||||||
| Белок OPM | 3rlh | ||||||||
| CDD | cd00138 | ||||||||
| Мембранома | 306 | ||||||||
| |||||||||
| фосфолипаза D | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.1.4.4 | ||||||||
| Количество CAS | 9001-87-0 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Фосфолипаза D (EC 3.1.4.4, липофосфодиэстераза II, лецитиназа D, холинфосфатаза) (PLD) является фермент из фосфолипаза надсемейство. Фосфолипазы широко распространены и могут быть обнаружены в широком спектре организмов, включая бактерии, дрожжи, растения, животных и вирусы.[1][2] Главный фосфолипаза D субстрат является фосфатидилхолин, что это гидролизует производить сигнал молекула фосфатидная кислота (PA), и растворимый холин. Растения содержат множество генов, кодирующих различные PLD. изоферменты, с молекулярная масса от 90 до 125 кДа.[3] Клетки млекопитающих кодируют две изоформы фосфолипазы D: PLD1 и PLD2.[4] Фосфолипаза D играет важную роль во многих физиологический процессы, в том числе мембранная торговля, цитоскелет реорганизация рецептор-опосредованного эндоцитоза, экзоцитоз, и миграция клеток.[5] Благодаря этим процессам, он был дополнительно вовлечен в патофизиология из нескольких болезни: в частности, прогрессирование Болезнь Паркинсона и Болезнь Альцгеймера, а также различные раки.[3][5] PLD также может помочь установить порог чувствительности к анестезии и механической силе.[6][7]
Открытие
PLD-типа Мероприятия впервые было сообщено в 1947 году Дональдом Дж. Ханаханом и И.Л. Чайков.[1] Однако только в 1975 г. гидролитический механизм действия был выяснен в млекопитающее клетки. Растение изоформы PLD были первыми очищенный из капусты и клещевина; PLDα в конечном итоге клонированный и характеризуется из множества растений, включая рис, кукурузу и помидоры.[1] PLD растений были клонированы в трех изоформах: PLDα, PLDβ, и PLDγ.[8]Более полувековые биохимические исследования показали, что фосфолипаза D и PA деятельность в широком диапазоне физиологические процессы и болезни, включая воспаление, сахарный диабет, фагоцитоз, нейронный & сердечный сигнализация, и онкогенез.[9]
Функция
Строго говоря, фосфолипаза D представляет собой трансфосфатидилаза: он опосредует обмен полярными головными группами, ковалентно прикрепленными к мембранные липиды. Использование воды в качестве нуклеофил, этот фермент катализирует расщепление из фосфодиэфирная связь в структурных фосфолипиды Такие как фосфатидилхолин и фосфатидилэтаноламин.[3] Продукция этого гидролиз мембранные липид фосфатидная кислота (PA), и холин, который распространяется в цитозоль. В качестве холин мало второй посланник активность, деятельность PLD в основном преобразованный по производству ПА.[5][10] PA активно участвует в внутриклеточный преобразование сигнала.[11] Кроме того, некоторые члены PLD надсемейство может нанять первичные спирты Такие как этиловый спирт или же 1-бутанол в расщеплении фосфолипид, эффективно катализируя обмен полярный липидная группа.[3][8] Другие члены этой семьи умеют гидролизовать другие фосфолипидные субстраты, такие как кардиолипин, или даже фосфодиэфирная связь составляя основу ДНК.[4]
Фосфатидная кислота
Многие из фосфолипазы D клеточные функции опосредованы его основным продуктом, фосфатидная кислота (ПА). PA это отрицательно заряженный фосфолипид, чей маленький головная группа продвигает кривизна мембраны.[4] Таким образом, считается, что это облегчает мембрана-слияние пузырьков и деление аналогично клатрин-опосредованный эндоцитоз.[4] PA можно также набирать белки которые содержат соответствующие связывающий домен, а область, край был характеризован базовый аминокислота-богатые регионы. Кроме того, PA может быть преобразован в ряд других липиды, Такие как лизофосфатидная кислота (лизо-ПА) или диацилглицерин, сигнальные молекулы которые оказывают множество эффектов на вниз по течению клеточные пути.[8]PA и это липид производные вовлечены в бесчисленное множество процессы которые включают внутриклеточный торговля пузырьками, эндоцитоз, экзоцитоз, актин динамика цитоскелета, распространение клеток дифференциация, и миграция.[4]

Млекопитающее PLD напрямую взаимодействует с киназы подобно PKC, ERK, TYK и контролирует передачу сигналов, указывающую, что PLD активируется этими киназами.[12] В качестве холин очень распространен в клетке, активность PLD существенно не влияет на уровень холина, и холин вряд ли играет какую-либо роль в передаче сигналов.
Фосфатидная кислота это сигнальная молекула и действует по набору SK1 к мембраны. PA чрезвычайно недолговечен и быстро гидролизованный ферментом фосфатидатфосфатаза формировать диацилглицерин (DAG). DAG также может быть преобразован в PA с помощью Киназа DAG. Хотя PA и DAG взаимно конвертируемы, они не действуют в одном и том же пути. Стимулы который активировать PLD не активируют ферменты вниз по течению DAG и наоборот.
Вполне возможно, что, хотя PA и DAG взаимно конвертируемы, отдельные пулы сигнализации и несигнализации липиды может быть сохранен. Исследования показали, что передача сигналов DAG опосредуется полиненасыщенный DAG, в то время как PA, производный от PLD, мононенасыщенный или же насыщенный. Таким образом, функциональный насыщенный / мононенасыщенный PA может быть разложен путем его гидролиза с образованием нефункционального насыщенного / мононенасыщенного DAG, в то время как функциональный полиненасыщенный DAG может быть разложен путем преобразования его в нефункциональный полиненасыщенный PA.[13][14][15]
Лизофосфолипаза D называется аутотаксин недавно было определено, что он играет важную роль в пролиферации клеток через свой продукт,лизофосфатидная кислота (LPA).
Структура
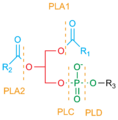
PLD для растений и животных имеют постоянную молекулярная структура, был характеризован сайты катализа окруженный ассортиментом регуляторные последовательности.[3] В активный сайт PLD состоит из четырех высокоэффективных консервированный аминокислота последовательности (I-IV), из них мотивы II и IV особенно консервативны. Эти структурные области содержат отличительные каталитические последовательность HxKxxxxD (HKD), где ЧАС, K, и D аминокислоты гистидин (ЧАС), лизин (К), аспарагиновая кислота (D), а x представляет неконсервативную аминокислоты.[3][4] Эти два HKD мотивы совещаться гидролитический активности PLD, и имеют решающее значение для его ферментативной активности как in vitro и in vivo.[4][9] Гидролиз из фосфодиэфирная связь возникает, когда эти последовательности HKD находятся в правильном близость.
Белки человека, содержащие этот мотив, включают:
ПК-гидролизирующий PLD представляет собой гомолог из кардиолипинсинтаза,[16][17] фосфатидилсерин синтаза, бактериальный PLD и вирусные белки. Кажется, что каждый из них обладает дублирование домена что видно по наличию двух HKD мотивы содержащий хорошо-консервированный гистидин, лизин, и аспарагин остатки что может способствовать активный сайт аспарагиновая кислота. An кишечная палочка эндонуклеаза (nuc) и подобные белки, по-видимому, являются PLD гомологи но обладают только одним из этих мотивов.[18][19][20][21]
PLD гены дополнительно кодировать высококонсервативный регулирующий домены: the консенсусная последовательность phox (PX), то домен гомологии плекстрина (PH), и сайт связывания для фосфатидилинозитол-4,5-бисфосфат (PIP2).[2]
Механизм катализа
PLD-катализированный гидролиз было предложено происходить в два этапа через "настольный теннис"механизм. В этой схеме гистидин остатки каждого мотива HKD последовательно атака то фосфолипид субстрат. Действуя как нуклеофилы, составляющая имидазол части из гистидины переходная форма ковалентные связи с фосфолипид, производя недолговечный средний это может быть легко гидролизованный водой в последующем шаг.[3][11]
Механизм активации
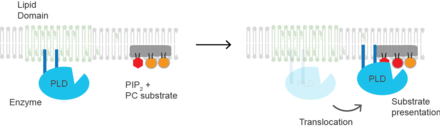
Презентация субстрата Для PLD2 млекопитающих молекулярной основой активации является презентация субстрата. Фермент неактивен в липидных микродоменах, богатых сфингомиелином и лишенных субстрата ПК.[22] Увеличение PIP2 или снижение холестерина заставляет фермент перемещаться в микродомены PIP2 рядом с его субстратом PC. Следовательно, PLD может в первую очередь активируется локализацией внутри плазматической мембраны, а не конформационным изменением белка. Нарушение липидных доменов анестетиками.[23] или механическая сила[22]. Белок также может претерпевать конформационные изменения при связывании PIP2, но это не было показано экспериментально и могло бы составлять механизм активации, отличный от представления субстрата.
Изоформы
Два основных изоформы фосфолипазы D был идентифицирован в млекопитающее клетки: PLD1 и PLD2 (53% гомология последовательностей),[24] каждый закодирован разными гены.[4] Активность PLD, по-видимому, присутствует в большинстве типы клеток, за возможными исключениями периферические лейкоциты и другие лимфоциты.[9] Обе изоформы PLD требуют PIP2 как кофактор за Мероприятия.[4] PLD1 и PLD2 выставлять разные субклеточные локализации которые динамически меняются в процессе преобразование сигнала. Активность PLD наблюдалась в плазматическая мембрана, цитозоль, ER, и аппарат Гольджи.[9]
PLD1
PLD1 представляет собой белок массой 120 кДа, который в основном расположен на внутренние оболочки ячеек. Он в основном присутствует в аппарат Гольджи, эндосомы, лизосомы, и секреторные гранулы.[4] На привязка из внеклеточный стимул PLD1 является транспортируется к плазматическая мембрана. Однако базальная активность PLD1 низкая, и преобразовывать внеклеточный сигнал, сначала он должен быть активирован к белки Такие как Арф, Ро, Rac, и протеинкиназа C.[4][5][10]
PLD2Напротив, PLD2 - это 106 кДа белок, который в первую очередь локализует к плазматическая мембрана, находящиеся в легкой мембране липидные рафты.[3][5] Он обладает высокой собственной каталитической активностью и лишь слабо активируется указанными выше молекулами.[3] |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Регулирование
Активность фосфолипазы D широко регулируемый к гормоны, нейротрансмиттеры, липиды, малые мономерные GTPases, и другие небольшие молекулы, которые связывать к их соответствующим домены на фермент.[3] В большинстве случаев, преобразование сигнала опосредуется производством фосфатидная кислота, который функционирует как вторичный посланник.[3]
Специфический фосфолипиды являются регуляторами активности PLD в клетках растений и животных.[1][3] Большинство PLD требуют фосфатидилинозитол-4,5-бисфосфат (PIP2), как кофакторы активности.[2][3] PIP2 и другие фосфоинозитиды являются важными модификаторами цитоскелет динамика и мембранный транспорт и может передавать PLD на свой ПК-основание.[25] PLD, регулируемые этими фосфолипиды обычно участвуют в внутриклеточный преобразование сигнала.[3] Их Мероприятия зависит от связывания этих фосфоинозитиды недалеко от активный сайт.[3] У растений и животных этот сайт связывания характеризуется наличием консервативная последовательность из базовый и ароматный аминокислоты.[3][11] В таких растениях, как Arabidopsis thaliana, это последовательность состоит из RxxxxxKxR мотив вместе с его перевернутый повтор, куда р является аргинин и K является лизин. Его близость к активный сайт обеспечивает высокий уровень PLD1 и PLD2 деятельности, и продвигает перемещение из PLD1 в цель мембраны в ответ на внеклеточный сигналы.[3]
C2 домен
Кальций действует как кофактор в PLD изоформы которые содержат C2 домен. Связывание Ca2+ к C2 домен приводит к конформационные изменения в ферменте, который укрепляет фермент-субстрат связывание, ослабляя ассоциация с фосфоинозитиды. На каком-то заводе изоферменты, Такие как PLDβ, Ca2+ может напрямую связываться с активный сайт, косвенно увеличивая ее близость для субстрат за счет усиления связывания активатора PIP2.[3]
PX домен
В консенсусная последовательность pbox (PX) считается, что опосредует связывание дополнительных фосфатидилинозитолфосфатов, в частности, фосфатидилинозитол 5-фосфат (PtdIns5P), липид, необходимый для эндоцитоз, может способствовать реинтернализации PLD1 от плазматическая мембрана.[1]
Домен PH
Сильно сохраненный Домен гомологии плекстрина (PH) это структурная область примерно 120 аминокислоты в длину. Это связывает фосфатидилинозитиды Такие как фосфатидилинозит (3,4,5) -трисфосфат (PIP3) и фосфатидилинозитол (4,5) -бисфосфат (PIP2). Он также может связывать гетеротримерные G-белки через их βγ-субъединица. Привязка к этому домен также считается, что облегчает реинтернализация белка за счет увеличения его близость к эндоцитозный липидные рафты.[1]
Взаимодействие с малыми GTPases
В животное клетки, мелкий белок факторы важны дополнительные регуляторы деятельности PLD. Эти малые мономерные GTPases находятся члены из Ро и АРФ семьи Рас надсемейство. Некоторые из этих белков, например Rac1, Cdc42, и RhoA, аллостерически активировать PLD1 млекопитающих, напрямую увеличивая свою активность. В частности, перемещение из цитозольный Фактор АДФ-рибозилирования (АРФ) в плазматическая мембрана необходим для активации PLD.[1][3]
Физиологические и патофизиологические роли
Алкогольное опьянение
Фосфолипаза D превращает этанол в фосфатидилэтанол (PEtOH) в процессе, называемом трансфосфатидилированием. Используя генетику мух, было показано, что PEtOH опосредует гиперактивную реакцию на алкоголь у плодовых мух.[26] Также было показано, что трансфосфатидилирование этанола активировано у алкоголиков и членов их семей.[27] Этот механизм трансфосфатидилирования этанола недавно появился в качестве альтернативной теории воздействия алкоголя на ионные каналы. Многие ионные каналы регулируются анионными липидами.[28] и считается, что конкуренция PEtOH с эндогенными сигнальными липидами опосредует действие этанола на ионные каналы в некоторых случаях, а не прямое связывание свободного этанола с каналом.[26]
При раке
Фосфолипаза D является регулятором нескольких критических клеточных процессов, в том числе транспорт везикул, эндоцитоз, экзоцитоз, миграция клеток, и митоз.[5] Нарушение регуляции из этих процессы это обычное дело в канцерогенез,[5] и, в свою очередь, аномалии в PLD выражение были замешаны в прогресс из нескольких типы рак.[2][4] А мутация драйвера повышение активности PLD2 наблюдалось в нескольких злокачественный рак груди.[4] Повышенная экспрессия PLD также коррелировала с размер опухоли в колоректальная карцинома, рак желудка, и рак почек.[4][5] Тем не менее молекулярные пути Остается неясным, посредством чего PLD способствует прогрессированию рака.[4] Один потенциал гипотеза играет важную роль фосфолипазы D в активации mTOR, подавитель раковая клетка апоптоз.[4] Способность PLD подавлять апоптоз в камерах с повышенным тирозинкиназа активность делает его кандидатом онкоген в раки где такие выражение типично.[5]
При нейродегенеративных заболеваниях
Фосфолипаза D также может играть важную роль патофизиологический роль в прогресс из нейродегенеративные заболевания, прежде всего благодаря своей способности преобразователь сигнала в незаменимых клеточные процессы подобно реорганизация цитоскелета и торговля пузырьками.[24] Нарушение регуляции PLD белком α-синуклеин было показано, что приводит к конкретной потере дофаминергический нейроны в млекопитающие. α-синуклеин является основным структурным компонентом Тела Леви, белковые агрегаты это отличительные черты болезнь Паркинсона.[4] Подавление PLD с помощью α-синуклеин может способствовать Болезнь Паркинсона вредный фенотип.[4]
Аномальная активность PLD также подозревалась в Болезнь Альцгеймера, где было замечено взаимодействие с пресенилин 1 (PS-1), главный компонент γ-секретаза сложный ответственный за ферментативное расщепление из белок-предшественник амилоида (ПРИЛОЖЕНИЕ). Внеклеточный бляшки продукта β-амилоид являются определяющими особенность из Болезнь Альцгеймера мозги.[4] Действие PLD1 на PS-1 влияет на внутриклеточный трафик из предшественник амилоида к этому сложный.[4][24] Фосфолипаза D3 (PLD3), неклассический и плохо охарактеризованный член PLD надсемейство, также был связан с патогенез этой болезни.[29]
Галерея
Рекомендации
- ^ а б c d е ж грамм Дженкинс GM, Фроман MA (октябрь 2005 г.). «Фосфолипаза D: обзор липидов». Клеточные и молекулярные науки о жизни. 62 (19–20): 2305–16. Дои:10.1007 / s00018-005-5195-z. PMID 16143829. S2CID 26447185.
- ^ а б c d Экстон Дж. Х. (2002). «Структура, регуляция и функция фосфолипазы D». Обзоры физиологии, биохимии и фармакологии. 144: 1–94. Дои:10.1007 / BFb0116585. ISBN 978-3-540-42814-5. PMID 11987824.
- ^ а б c d е ж грамм час я j k л м п о п q р s Колесников Ю.С., Нохрина К.П., Кретынин С.В., Волотовский И.Д., Мартинец Дж., Романов Г.А., Кравец В.С. (январь 2012 г.). «Молекулярная структура фосфолипазы D и механизмы регуляции ее активности в клетках растений и животных». Биохимия. Биохимия. 77 (1): 1–14. Дои:10.1134 / S0006297912010014. PMID 22339628. S2CID 14815405.
- ^ а б c d е ж грамм час я j k л м п о п q р s т Peng X, Frohman MA (февраль 2012 г.). «Физиологические и патологические роли фосфолипазы D млекопитающих». Acta Physiologica. 204 (2): 219–26. Дои:10.1111 / j.1748-1716.2011.02298.x. ЧВК 3137737. PMID 21447092.
- ^ а б c d е ж грамм час я Фостер Д.А., Сюй Л. (сентябрь 2003 г.). «Фосфолипаза D при пролиферации клеток и раке». Молекулярные исследования рака. 1 (11): 789–800. PMID 14517341.
- ^ Петерсен Э. Н., Гудети М., Павел М. А., Мерфи К. Р., Джа В. В., Йоргенсен Э. М., Хансен С. Б. (5 сентября 2019 г.). «Фосфолипаза D преобразует силу в каналы TREK-1 в биологической мембране». bioRxiv: 758896. Дои:10.1101/758896.
- ^ Павел М.А., Петерсен Е.Н., Ван Х., Лернер Р.А., Хансен С.Б. (19 июня 2019 г.). «Исследования механизма мембранно-опосредованной общей анестезии». bioRxiv: 313973. Дои:10.1101/313973.
- ^ а б c Banno Y (март 2002 г.). «Регулирование и возможная роль фосфолипазы D млекопитающих в клеточных функциях». Журнал биохимии. 131 (3): 301–6. Дои:10.1093 / oxfordjournals.jbchem.a003103. PMID 11872157. S2CID 24389113.
- ^ а б c d Макдермотт М., Вакелам М.Дж., Моррис А.Дж. (февраль 2004 г.). «Фосфолипаза D». Биохимия и клеточная биология. 82 (1): 225–53. Дои:10.1139 / o03-079. PMID 15052340.
- ^ а б Бальбоа М.А., Файрестайн Б.Л., Годсон С., Белл К.С., Инсел, Пенсильвания (апрель 1994 г.). «Протеинкиназа C альфа опосредует активацию фосфолипазы D нуклеотидами и сложным эфиром форбола в клетках почек собак Madin-Darby. Стимуляция фосфолипазы D не зависит от активации полифосфоинозитид-специфической фосфолипазы C и фосфолипазы A2». Журнал биологической химии. 269 (14): 10511–6. PMID 8144636.
- ^ а б c Лейрос I, Секундо Ф, Замбонелли С., Серви С., Хью Е. (июнь 2000 г.). «Первая кристаллическая структура фосфолипазы D». Структура. 8 (6): 655–67. Дои:10.1016 / S0969-2126 (00) 00150-7. PMID 10873862.
- ^ Паруч С., Эль-Бенна Дж., Джерджоури Б., Марулло С., Периан А. (январь 2006 г.). «Роль митоген-активируемых протеинкиназ p44 / 42 в опосредованной формилпептидным рецептором активности фосфолипазы D и продукции оксидантов». Журнал FASEB. 20 (1): 142–4. Дои:10.1096 / fj.05-3881fje. PMID 16253958. S2CID 28348537.
- ^ Бочкино С.Б., Блэкмор П.Ф., Уилсон П.Б., Экстон Дж. Х. (ноябрь 1987 г.). «Накопление фосфатидата в гепатоцитах, обработанных гормонами, по механизму фосфолипазы D». Журнал биологической химии. 262 (31): 15309–15. PMID 3117799.
- ^ Бочкино С.Б., Уилсон ПБ, Экстон Дж. Х. (декабрь 1987 г.). «Ca2 + -мобилизирующие гормоны вызывают накопление фосфатидилэтанола через активацию фосфолипазы D». Письма FEBS. 225 (1–2): 201–4. Дои:10.1016/0014-5793(87)81157-2. PMID 3319693. S2CID 10674790.
- ^ Ходжкин М.Н., Петитт Т.Р., Мартин А., Мичелл Р.Х., Пембертон А.Дж., Вакелам М.Дж. (июнь 1998 г.). «Диацилглицерины и фосфатидаты: какие виды молекул являются внутриклеточными посредниками?». Тенденции в биохимических науках. 23 (6): 200–4. Дои:10.1016 / S0968-0004 (98) 01200-6. PMID 9644971.
- ^ Новицки М, Мюллер Ф, Френтцен М (апрель 2005 г.). «Кардиолипинсинтаза Arabidopsis thaliana». Письма FEBS. 579 (10): 2161–5. Дои:10.1016 / j.febslet.2005.03.007. PMID 15811335. S2CID 21937549.
- ^ Новицки М (2006). Характеристика кардиолипинсинтазы Arabidopsis thaliana (Кандидатская диссертация). RWTH-Aachen University. Архивировано из оригинал на 2011-10-05. Получено 2011-07-11.
- ^ Ponting CP, Kerr ID (май 1996 г.). «Новое семейство гомологов фосфолипазы D, которое включает фосфолипидсинтазы и предполагаемые эндонуклеазы: идентификация дублированных повторов и потенциальных остатков активного сайта». Белковая наука. 5 (5): 914–22. Дои:10.1002 / pro.5560050513. ЧВК 2143407. PMID 8732763.
- ^ Кунин Е.В. (июль 1996 г.). «Дублированный каталитический мотив в новом суперсемействе фосфогидролаз и фосфолипидсинтаз, которое включает белки оболочки поксвируса». Тенденции в биохимических науках. 21 (7): 242–3. Дои:10.1016/0968-0004(96)30024-8. PMID 8755242.
- ^ Ван X, Сюй Л., Чжэн Л. (август 1994 г.). «Клонирование и экспрессия фосфатидилхолин-гидролизующей фосфолипазы D из Ricinus communis L». Журнал биологической химии. 269 (32): 20312–7. PMID 8051126.
- ^ Певец WD, Brown HA, Sternweis PC (1997). «Регулирование эукариотической фосфатидилинозитол-специфической фосфолипазы C и фосфолипазы D». Ежегодный обзор биохимии. 66: 475–509. Дои:10.1146 / annurev.biochem.66.1.475. PMID 9242915.
- ^ а б Петерсен Э. Н., Чунг Х. В., Наебосадри А., Хансен С. Б. (декабрь 2016 г.). «Кинетическое разрушение липидных рафтов - механосенсор фосфолипазы D». Nature Communications. 7 (13873): 13873. Bibcode:2016НатКо ... 713873P. Дои:10.1038 / ncomms13873. ЧВК 5171650. PMID 27976674.
- ^ Павел М.А., Петерсен EN, Ван Х., Лернер Р.А., Хансен С.Б. (4 мая 2018 г.). «Исследования механизма общей анестезии». bioRxiv: 313973. Дои:10.1101/313973. PMID 32467161.
- ^ а б c Линдсли CW, Браун HA (январь 2012 г.). «Фосфолипаза D как терапевтическая мишень при заболеваниях головного мозга». Нейропсихофармакология. 37 (1): 301–2. Дои:10.1038 / npp.2011.178. ЧВК 3238067. PMID 22157867.
- ^ Петерсен Э. Н., Чунг Х. В., Наебосадри А., Хансен С. Б. (декабрь 2016 г.). «Кинетическое разрушение липидных рафтов - механосенсор фосфолипазы D». Nature Communications. 7: 13873. Bibcode:2016НатКо ... 713873P. Дои:10.1038 / ncomms13873. ЧВК 5171650. PMID 27976674.
- ^ а б Чунг Х.В., Петерсен Э.Н., Кабанос С., Мерфи К.Р., Павел М.А., Хансен А.С. и др. (Январь 2019). «Молекулярная мишень для отсечения длины спиртовой цепи». Журнал молекулярной биологии. 431 (2): 196–209. Дои:10.1016 / j.jmb.2018.11.028. ЧВК 6360937. PMID 30529033.
- ^ Mueller GC, Fleming MF, LeMahieu MA, Lybrand GS, Barry KJ (декабрь 1988 г.). «Синтез фосфатидилэтанола - потенциального маркера для взрослых мужчин, подверженных риску алкоголизма». Труды Национальной академии наук Соединенных Штатов Америки. 85 (24): 9778–82. Bibcode:1988ПНАС ... 85.9778М. Дои:10.1073 / пнас.85.24.9778. ЧВК 282864. PMID 3200856.
- ^ Хансен С.Б. (май 2015 г.). «Липидный агонизм: парадигма PIP2 лиганд-управляемых ионных каналов». Biochimica et Biophysica Acta (BBA) - молекулярная и клеточная биология липидов. 1851 (5): 620–8. Дои:10.1016 / j.bbalip.2015.01.011. ЧВК 4540326. PMID 25633344.
- ^ Cruchaga C, Karch CM, Jin SC, Benitez BA, Cai Y, Guerreiro R, et al. (Январь 2014). «Редкие варианты кодирования гена фосфолипазы D3 создают риск болезни Альцгеймера». Природа. 505 (7484): 550–554. Bibcode:2014Натура.505..550.. Дои:10.1038 / природа12825. ЧВК 4050701. PMID 24336208.
внешняя ссылка
- Фосфолипаза + D в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)