WikiDer > Аргинин
 | |
| Имена | |
|---|---|
| Другие имена 2-амино-5-гуанидинопентановая кислота | |
| Идентификаторы | |
3D модель (JSmol) |
|
| 3DMet | |
| 1725411, 1725412 р, 1725413 S | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.738 |
| Номер ЕС |
|
| 364938 р | |
| КЕГГ | |
| MeSH | Аргинин |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Свойства | |
| C6ЧАС14N4О2 | |
| Молярная масса | 174.204 г · моль−1 |
| Внешность | Белые кристаллы |
| Запах | Без запаха |
| Температура плавления | 260 ° С; 500 ° F; 533 К |
| Точка кипения | 368 ° С (694 ° F, 641 К) |
| 14,87 г / 100 мл (20 ° С) | |
| Растворимость | слабо растворим в этиловый спирт не растворим в этиловый эфир |
| журнал п | −1.652 |
| Кислотность (пKа) | 2,18 (карбоксил), 9,09 (амино), 13,2 (гуанидино) |
| Термохимия | |
Теплоемкость (C) | 232,8 Дж · К−1 моль−1 (при 23,7 ° C) |
Стандартный моляр энтропия (S | 250,6 Дж · К−1 моль−1 |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −624,9–−622,3 кДж моль−1 |
Станд. Энтальпия горение (ΔcЧАС⦵298) | −3,7396–−3,7370 МДж моль−1 |
| Фармакология | |
| B05XB01 (КТО) S | |
| Опасности | |
| Паспорт безопасности | Увидеть: страница данных www.sigmaaldrich.com |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Предупреждение |
| H319 | |
| P305 + 351 + 338 | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 5110 мг / кг (крыса, перорально) |
| Родственные соединения | |
Родственные алкановые кислоты | |
Родственные соединения | |
| Страница дополнительных данных | |
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ |
| УФ, ИК, ЯМР, РС | |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
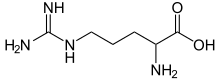
Аргинин, также известен как л-аргинин (символ Arg или р),[1] является α-аминокислота который используется в биосинтезе белки.[2] Он содержит α-амино- группа, α-карбоновая кислота группа, и боковая цепь, состоящая из 3-углеродной алифатический прямая цепочка, оканчивающаяся на гуанидино группа. При физиологическом pH карбоновая кислота депротонируется (-COO−) аминогруппа протонирована (-NH3+), и гуанидиногруппа также протонируется с образованием гуанидиниевой формы (-C- (NH2)2+), превращая аргинин в заряженную алифатическую аминокислоту.[3] Это предшественник для биосинтеза оксид азота. это закодированный посредством кодоны CGU, CGC, CGA, CGG, AGA и AGG.
Аргинин классифицируется как полусущественный или условно незаменимая аминокислотав зависимости от стадии развития и состояния здоровья человека.[4] Недоношенные дети не могут синтезировать или вырабатывать аргинин внутри организма, что делает аминокислоту необходимой для них в питании.[5] Большинству здоровых людей не нужно принимать добавки с аргинином, потому что он входит в состав всех белковосодержащих продуктов.[6] и может синтезироваться в организме из глутамин через цитруллин.[7]
История
Аргинин был впервые выделен в 1886 году из желтый люпин саженцы немецкого химика Эрнст Шульце и его помощник Эрнст Штайгер.[8][9] Он назвал это от греческого Аргирос (ἄργυρος) означает «серебро» из-за серебристо-белого цвета кристаллов нитрата аргинина.[10] В 1897 году Шульце и Эрнст Винтерштейн (1865–1949) определили структуру аргинина.[11] Шульце и Винтерштейн синтезировали аргинин из орнитин и цианамид в 1899 г.,[12] но некоторые сомнения в структуре аргинина остались[13] до тех пор Соренсена синтез 1910 г.[14]
Источники
Производство
Его традиционно получают путем гидролиза различных дешевых источников белка, таких как желатин.[15] Его получают в промышленных масштабах путем ферментации. Таким образом можно производить 25-35 г / л, используя глюкозу в качестве источника углерода.[16]
Диетические источники
Аргинин - это условно незаменимая аминокислота для человека и грызунов,[17] поскольку это может потребоваться в зависимости от состояния здоровья или жизненного цикла человека. Например, в то время как здоровые взрослые люди могут обеспечивать свою потребность в аргинине, незрелые и быстрорастущие люди нуждаются в аргинине в своем рационе,[18] а также это важно при физиологическом стрессе, например, при восстановлении после ожогов, травм и сепсиса,[18] или когда тонкий кишечник и почки, которые являются основными участками биосинтеза аргинина, были повреждены.[17] Однако это незаменимая аминокислота для птиц, поскольку у них нет цикл мочевины.[19] Для некоторых хищников, например кошек, собак[20] и хорькам важен аргинин,[17] потому что после еды их высокоэффективные катаболизм белков производит большое количество аммиак которые необходимо обрабатывать в цикле мочевины, и если аргинина недостаточно, токсичность аммиака может быть смертельной.[21] На практике это не проблема, потому что мясо содержит достаточно аргинина, чтобы избежать такой ситуации.[21]
Животные источники аргинина включают мясо, молочные продукты и яйца,[22][23] а растительные источники включают семена всех типов, например зерна, бобы и орехи.[23]
Биосинтез
Аргинин синтезируется из цитруллин в метаболизм аргинина и пролина последовательным действием цитозольных ферментов аргининосукцинатсинтетаза и аргининосукцинатлиаза. Это энергетически затратный процесс, потому что для каждой молекулы аргининосукцинат синтезируется одна молекула аденозинтрифосфат (АТФ) гидролизуется до аденозинмонофосфат (AMP), потребляя два эквивалента АТФ.
Цитруллин может быть получен из нескольких источников:
- из самого аргинина через синтаза оксида азота, как побочный продукт производства оксида азота для сигнализация цели
- от орнитин через распад пролин или глутамин/глутамат
- от асимметричный диметиларгинин через DDAH
Пути, связывающие аргинин, глутамин, и пролин двунаправленные. Таким образом, чистое использование или производство этих аминокислот сильно зависит от типа клетки и стадии развития.
Во всем организме синтез аргинина происходит в основном через кишечно-почечную ось: эпителиальные клетки из тонкий кишечник производят цитруллин, в основном из глутамин и глутамат, который переносится с кровотоком в клетки проксимальных канальцев из почка, которые извлекают цитруллин из кровотока и превращают его в аргинин, который возвращается в кровоток. Это означает, что нарушение функции тонкой кишки или почек может снизить синтез аргинина, увеличивая потребность в питании.
Синтез аргинина из цитруллина также происходит на низком уровне во многих других клетках, и клеточная способность к синтезу аргинина может быть заметно увеличена в обстоятельствах, которые увеличивают производство индуцибельная БДУ. Это позволяет цитруллину, побочному продукту катализированного NOS производства оксида азота, быть рециклированным в аргинин по пути, известному как путь цитруллин-NO или аргинин-цитруллин. Это демонстрируется тем фактом, что во многих типах клеток синтез NO может в некоторой степени поддерживаться цитруллином, а не только аргинином. Однако эта рециркуляция не является количественной, поскольку цитруллин накапливается в NO-продуцирующих клетках вместе с нитрат и нитрит, стабильные конечные продукты NO распада.[24]
Функция
Аргинин играет важную роль в деление клеток, лечение раны, выводя аммиак из организма, иммунная функция,[25] и выброс гормонов.[4][26][27] Это предшественник синтеза оксид азота (НЕТ),[28] делая это важным в регулировании артериальное давление.[29][30][31]
Белки
Боковая цепь аргинина амфипатический, потому что при физиологическом pH он содержит положительно заряженную группу гуанидиния, которая является высокополярной, на конце гидрофобной алифатический углеводородная цепь. Поскольку глобулярные белки имеют гидрофобную внутреннюю часть и гидрофильные поверхности,[32] аргинин обычно находится снаружи белка, где гидрофильная головная группа может взаимодействовать с полярным окружением, например, принимая участие в водородная связь и соляные мостики.[33] По этой причине он часто находится на границе между двумя белками.[34] Алифатическая часть боковой цепи иногда остается ниже поверхности белка.[33]
Остатки аргинина в белках могут быть уменьшены ферментами PAD с образованием цитруллина в посттрансляционная модификация процесс называется цитруллинированиеЭто важно для развития плода, является частью нормального иммунного процесса, а также для контроля экспрессии генов, но также важно для аутоиммунные заболевания.[35]:275 Другая посттрансляционная модификация аргинина включает: метилирование белком метилтрансферазы.[35]:176
Предшественник
Аргинин является непосредственным предшественником NO, важной сигнальной молекулы, которая может действовать как второй посланник, а также межклеточный мессенджер, который регулирует расширение сосудов, а также играет роль в реакции иммунной системы на инфекцию.
Аргинин также является предшественником мочевина, орнитин, и агматин; необходим для синтеза креатин; а также может быть использован для синтеза полиамины (в основном через орнитин и в меньшей степени через агматин, цитруллин и глутамат). асимметричный диметиларгинин (ADMA), близкий родственник, подавляет реакцию оксида азота; поэтому ADMA считается маркером для сосудистое заболевание, как только L-аргинин считается признаком здорового эндотелий.
Структура
В аминокислота боковая цепь аргинина состоит из 3 атомов углерода алифатический прямая цепочка, на дистальном конце которой находится гуанидиний группа, имеющая пKа 12,48, и поэтому всегда протонирован и положительно заряжен при физиологическом pH. Из-за спряжение между двойной связью и азотом одинокие пары, положительный заряд делокализован, что делает возможным образование нескольких водородные связи.
Исследование
Гормон роста
Аргинин, вводимый внутривенно, используется в тестах на стимуляцию гормона роста.[36] потому что он стимулирует секрецию гормон роста.[37] Обзор клинических испытаний показал, что пероральный аргинин увеличивает выработку гормона роста, но снижает секрецию гормона роста, которая обычно связана с физическими упражнениями.[38] Однако более недавнее исследование показало, что, хотя пероральный аргинин увеличивает плазменные уровни L-аргинин не вызывал повышения гормона роста.[39]
Повышенное артериальное давление
Мета-анализ показал, что L-аргинин снижает артериальное давление с объединенными оценками 5,4 мм рт. ст. для систолического артериального давления и 2,7 мм рт. ст. для диастолического артериального давления.[31]
Дополнение с л-аргинин снижает диастолическое артериальное давление и удлиняет беременность у женщин с гестационная гипертензия, включая женщин с повышенным артериальным давлением как часть преэклампсия. Он не снизил систолическое артериальное давление и не улучшил вес при рождении.[40]
Шизофрения
Как жидкостная хроматография, так и жидкостная хроматография / масс-спектрометрические анализы показали, что ткань мозга умершего шизофреники показывает измененный метаболизм аргинина. Анализы также подтвердили значительно сниженные уровни γ-аминомасляной кислоты (ГАМК), но повышенные. агматинконцентрация и соотношение глутамат / ГАМК в случаях шизофрении. Регрессионный анализ показал положительную корреляцию между активностью аргиназы и возрастом начала заболевания, а также между уровнем L-орнитина и продолжительностью заболевания. Более того, кластерный анализ показал, что L-аргинин и его основные метаболиты L-цитруллин, L-орнитин и агматин образуют отдельные группы, которые были изменены в группе шизофрении. Несмотря на это, биологическая основа шизофрении все еще плохо изучена, ряд факторов, таких как гиперфункция дофамина, глутаматергическая гипофункция, ГАМКергический дефицит, дисфункция холинергической системы, стрессовая уязвимость и нарушения нервного развития, были связаны с этиологией и / или патофизиологией болезнь.[41]
Смотрите также
- Глютамат аргинина
- AAKG
- Канаванин и канал токсичны аналоги аргинина и орнитина.
Безопасность
L-аргинин признан безопасным (GRAS-статус) при потреблении до 20 граммов в день.[42]
использованная литература
- ^ «Номенклатура и символика аминокислот и пептидов». Совместная комиссия IUPAC-IUB по биохимической номенклатуре. 1983. Архивировано с оригинал 9 октября 2008 г.. Получено 5 марта 2018.
- ^ Совместная комиссия IUPAC-IUBMB по биохимической номенклатуре. «Номенклатура и символика аминокислот и пептидов». Рекомендации по органической и биохимической номенклатуре, символам и терминологии и т. Д.. В архиве из оригинала 29 мая 2007 г.. Получено 2007-05-17.
- ^ Глазель Дж. А., Deutscher MP (1995-11-20). Введение в биофизические методы исследования белков и нуклеиновых кислот. Академическая пресса. п. 456. ISBN 978-0-08-053498-5.
- ^ а б Tapiero H, Mathé G, Couvreur P, Tew KD (ноябрь 2002 г.). «L-аргинин». (обзор). Биомедицина и фармакотерапия. 56 (9): 439–445. Дои:10.1016 / s0753-3322 (02) 00284-6. PMID 12481980.
- ^ Ву Джи, Джагер Л.А., Базер Ф.В., Роадс Дж.М. (август 2004 г.). «Дефицит аргинина у недоношенных детей: биохимические механизмы и последствия для питания». (обзор). Журнал пищевой биохимии. 15 (8): 442–51. Дои:10.1016 / j.jnutbio.2003.11.010. PMID 15302078.
- ^ «Лекарства и добавки Аргинин». Получено 15 января 2015.
- ^ Шкипер, Анналинн (1998). Справочник диетолога по энтеральному и парентеральному питанию. Джонс и Бартлетт Обучение. п. 76. ISBN 978-0-8342-0920-6.
- ^ Апель Ф (июль 2015 г.). "Биография фон Эрнста Шульце" (PDF). Получено 2017-11-06.
- ^ Шульце Э, Штайгер Э (1887). "Убер дас Аргинин" [Об аргинине]. Zeitschrift für Physiologische Chemie. 11 (1–2): 43–65.
- ^ «БИОЭТИМОЛОГИЯ: ПРОИСХОЖДЕНИЕ В БИО-МЕДИЦИНСКИХ ТЕРМИНАХ: аргинин (Arg R)». Получено 25 июля 2019.
- ^ Шульце Э, Винтерштейн Э (сентябрь 1897 г.). "Ueber ein Spaltungs-product des Arginins" [О продукте расщепления аргинина]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 30 (3): 2879–2882. Дои:10.1002 / cber.18970300389. Структура аргинина представлена на стр. 2882.
- ^ Шульце Э, Винтерштейн Э (октябрь 1899 г.). "Ueber die Construction des Arginins" [О строении аргинина]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 32 (3): 3191–3194. Дои:10.1002 / cber.18990320385.
- ^ Коэн JB (1919). Органическая химия для продвинутых студентов, часть 3 (2-е изд.). Нью-Йорк, Нью-Йорк, США: Longmans, Green & Co. p. 140.
- ^ Зельренсен С.П. (январь 1910 г.). "Über die Synthese des дл-Аргинины (α-амино-δ-гуанидо-п-valeriansäure) и изомеры α-гуанидо-δ-амино-п-valeriansäure " [О синтезе рацемического аргинина (α-амино-δ-гуанидо-п-валериановая кислота) и изомерного α-гуанидо-δ-амино-п-валериановая кислота]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 43 (1): 643–651. Дои:10.1002 / cber.191004301109.
- ^ Бренд, E .; Сандберг, М. (1932). «d-аргинин гидрохлорид». Орг. Синтезатор. 12: 4. Дои:10.15227 / orgsyn.012.0004.
- ^ Драуз, Карлхайнц; Грейсон, Ян; Климанн, Аксель; Криммер, Ханс-Петер; Лойхтенбергер, Вольфганг; Weckbecker, Кристоф (2006). "Аминокислоты". Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a02_057.pub2.
- ^ а б c Игнарро LJ (2000-09-13). Оксид азота: биология и патобиология. Академическая пресса. п. 189. ISBN 978-0-08-052503-7.
- ^ а б Борлас BC (1994). Энтеральное питание. Джонс и Бартлетт Обучение. п. 48. ISBN 978-0-412-98471-6.
- ^ Фридленд Р.А., Бриггс С. (2012-12-06). Биохимический подход к питанию. Springer Science & Business Media. п. 45. ISBN 9789400957329.
- ^ Потребности собак в питательных веществах. Национальная академия прессы. 1985. с. 65. ISBN 978-0-309-03496-8.
- ^ а б Уортингер А, Бернс К. (11.06.2015). Питание и управление болезнями для ветеринарных врачей и медсестер. Джон Вили и сыновья. п. 232. ISBN 978-1-118-81108-5.
- ^ Спано М.А., Крускалл Л.Дж., Томас Д.Т. (30.08.2017). Питание для спорта, физических упражнений и здоровья. Кинетика человека. п. 240. ISBN 978-1-4504-1487-6.
- ^ а б Уотсон Р. Р., Зибади С. (28 ноября 2012 г.). Биоактивные факторы питания и экстракты растений в дерматологии. Springer Science & Business Media. п. 75. ISBN 978-1-62703-167-7.
- ^ Моррис С.М. (октябрь 2004 г.). «Ферменты обмена аргинина». (обзор). Журнал питания. 134 (10 Прил.): 2743S – 2747S, обсуждение 2765S – 2767S. Дои:10.1093 / jn / 134.10.2743S. PMID 15465778.
- ^ Мауро К., Фрезза С. (13 июля 2015 г.). Метаболические проблемы иммунных клеток при здоровье и болезнях. Frontiers Media SA. п. 17. ISBN 9782889196227.
- ^ Штехмиллер Дж. К., Чайлдресс Б., Коуэн Л. (февраль 2005 г.). «Добавки аргинина и заживление ран». (обзор). Питание в клинической практике. 20 (1): 52–61. Дои:10.1177/011542650502000152. PMID 16207646.
- ^ Витте МБ, Барбул А (2003). «Физиология аргинина и ее значение для заживления ран». (обзор). Ремонт и регенерация ран. 11 (6): 419–23. Дои:10.1046 / j.1524-475X.2003.11605.x. PMID 14617280. S2CID 21239136.
- ^ Эндрю П.Дж., Майер Б. (август 1999 г.). «Ферментативная функция синтаз оксида азота». (обзор). Сердечно-сосудистые исследования. 43 (3): 521–31. Дои:10.1016 / S0008-6363 (99) 00115-7. PMID 10690324.
- ^ Гекче Н. (октябрь 2004 г.). «L-аргинин и гипертония». Журнал питания. 134 (10 Прил.): 2807S – 2811S, обсуждение 2818S – 2819S. Дои:10.1093 / jn / 134.10.2807S. PMID 15465790.
- ^ Раджапаксе Н.В., Де Мигель С., Дас С., Маттсон Д.Л. (декабрь 2008 г.). «Экзогенный L-аргинин улучшает индуцированную ангиотензином II гипертензию и повреждение почек у крыс». (первичный). Гипертония. 52 (6): 1084–90. Дои:10.1161 / ГИПЕРТЕНЗИЯAHA.108.114298. ЧВК 2680209. PMID 18981330.
- ^ а б Dong JY, Qin LQ, Zhang Z, Zhao Y, Wang J, Arigoni F, Zhang W. (декабрь 2011 г.). «Влияние пероральных добавок L-аргинина на артериальное давление: метаанализ рандомизированных двойных слепых плацебо-контролируемых исследований». обзор. Американский журнал сердца. 162 (6): 959–65. Дои:10.1016 / j.ahj.2011.09.012. PMID 22137067.
- ^ Мэтьюз К.К., Ван Холде К.Э., Ахерн К.Г. (2000). Биохимия (3-е изд.). Сан-Франциско, Калифорния: Бенджамин Каммингс. стр.180. ISBN 978-0805330663. OCLC 42290721.
- ^ а б Барнс MR (16 апреля 2007 г.). Биоинформатика для генетиков: учебник по биоинформатике для анализа генетических данных. Джон Вили и сыновья. п. 326. ISBN 9780470026199.
- ^ Kleanthous C (2000). Распознавание белок-белок. Издательство Оксфордского университета. п. 13. ISBN 9780199637607.
- ^ а б Гриффитс-младший, Анвин Р.Д. (12 октября 2016 г.). Анализ посттрансляционных модификаций белков с помощью масс-спектрометрии. Джон Вили и сыновья. ISBN 9781119250883.
- ^ Национальная медицинская библиотека США (сентябрь 2009 г. Тест на стимуляцию гормона роста
- ^ Альба-Рот Дж., Мюллер О.А., Шополь Дж., Фон Вердер К. (декабрь 1988 г.). «Аргинин стимулирует секрецию гормона роста, подавляя секрецию эндогенного соматостатина». Журнал клинической эндокринологии и метаболизма. 67 (6): 1186–9. Дои:10.1210 / jcem-67-6-1186. PMID 2903866. S2CID 7488757.
- ^ Каналей Дж. А. (январь 2008 г.). «Гормон роста, аргинин и упражнения». Текущее мнение о клиническом питании и метаболическом лечении. 11 (1): 50–4. Дои:10.1097 / MCO.0b013e3282f2b0ad. PMID 18090659. S2CID 22842434.
- ^ Forbes SC, Bell GJ (июнь 2011 г.). «Острые эффекты низких и высоких доз перорального приема L-аргинина у молодых активных мужчин в состоянии покоя». Прикладная физиология, питание и обмен веществ. 36 (3): 405–11. Дои:10.1139 / ч11-035. PMID 21574873.
- ^ Гуй С., Цзя Дж., Ню Х, Бай И, Цзоу Х, Дэн Дж, Чжоу Р. (март 2014 г.). «Добавки аргинина для улучшения исходов у матери и новорожденного при гипертоническом расстройстве беременности: систематический обзор». (обзор). Журнал системы ренин-ангиотензин-альдостерон. 15 (1): 88–96. Дои:10.1177/1470320313475910. PMID 23435582.
- ^ Лю, П; Цзин, Y; Колли, Северная Дакота; Дин, B; Билки, Дания; Чжан, Х (16 августа 2016 г.). «Измененный метаболизм аргинина в мозге при шизофрении». Трансляционная психиатрия. 6 (8): e871. Дои:10.1038 / tp.2016.144. ЧВК 5022089. PMID 27529679.
- ^ Шао А., Хэткок Дж. Н. (апрель 2008 г.). «Оценка риска для аминокислот таурин, L-глутамин и L-аргинин». Нормативная токсикология и фармакология. 50 (3): 376–99. Дои:10.1016 / j.yrtph.2008.01.004. PMID 18325648.
внешние ссылки
| Викискладе есть медиафайлы по теме Аргинин. |


