WikiDer > Лимфома из клеток мантии
| Лимфома из клеток мантии | |
|---|---|
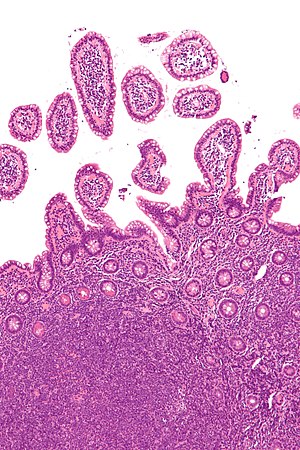 | |
| Микрофотография показывает лимфому из клеток мантии (внизу изображения) на биопсия из терминальная подвздошная кишка. H&E пятно. | |
| Специальность | Гематология и онкология |
Лимфома из клеток мантии (MCL) является разновидностью неходжкинской лимфомы (НХЛ), составляя около 6% случаев НХЛ.[1][2] Сейчас здесь всего около 15000 пациентов.[когда?] в Соединенных Штатах с лимфомой из клеток мантии.
MCL - это подтип В-клеточная лимфома, из-за CD5 положительный антиген-наивный B-клетка предерминального центра внутри мантийная зона что окружает нормальный зародышевый центр фолликулы. Клетки MCL обычно сверхэкспрессируют циклин D1 из-за т (11:14)[3] хромосомная транслокация в ДНК. В частности, транслокация находится в момент t (11; 14) (q13; q32).[4][5]
Признаки и симптомы
На момент постановки диагноза пациенты обычно находятся в возрасте 60 лет и обращаются к врачу с запущенным заболеванием. Около половины имеют B симптомы Такие как высокая температура, ночные поты, или необъяснимо потеря веса (более 10% массы тела). Увеличенные лимфатические узлы (например, «шишка» на шее, подмышках или паху) или увеличение селезенки обычно присутствуют. Поражение костного мозга, печени и желудочно-кишечного тракта происходит относительно рано в ходе заболевания.[6] Сообщалось, что лимфома из клеток мантии в редких случаях связана с тяжелые аллергические реакции на укусы комаров. Эти реакции включают обширные аллергические реакции на укусы комаров, которые варьируются от сильно увеличенных мест укусов, которые могут быть болезненными и включать некроз, до системных симптомов (например, лихорадки, увеличения лимфатических узлов, боли в животе и диареи) или, в очень редких случаях, до жизни. -угрожающая анафилаксия. В некоторых из этих случаев аллергическая реакция на укус комара возникла до постановки диагноза MCL, что свидетельствует о том, что МБА может быть проявлением раннего развития и, следовательно, предвестником лимфомы из клеток мантии.[7][8]
Патогенез
MCL, как и большинство раки, возникает в результате приобретения комбинации (ненаследственных) генетических мутаций в соматические клетки. Это приводит к клональный разрастание злокачественных В-лимфоцитов. Факторы, которые вызывают генетические изменения, обычно не поддаются идентификации и обычно возникают у людей без особых факторов риска развития лимфомы. Поскольку MCL является приобретенным генетическим заболеванием, он не передается и не передается по наследству.
Определяющей характеристикой MCL является мутация и сверхэкспрессия циклина D1, a клеточный цикл ген, который способствует аномальному разрастанию злокачественных клеток. Клетки MCL также могут быть устойчивыми к лекарственным препаратам. апоптоз, что затрудняет их лечение химиотерапией или облучением. Клетки, пораженные MCL, пролиферируют в узловатый или же размытый паттерн с двумя основными цитологическими вариантами, типичный или же взрывной. Типичные случаи - это клетки маленького и среднего размера с нерегулярными ядра. Blastic (он же бластоидный) варианты имеют ячейки среднего и большого размера с мелкодисперсными хроматин, и по своей природе более агрессивны.[9] Опухолевые клетки накапливаются в лимфоидной системе, включая лимфатические узлы и селезенку, а бесполезные клетки, в конечном итоге, приводят к дисфункции системы. MCL может также заменять нормальные клетки в костном мозге, что нарушает нормальное производство клеток крови.
Диагностика


Для диагностики обычно требуются окрашенные слайды хирургически удаленной части лимфатического узла. Также широко используются другие методы, включая цитогенетику и флуоресценция in situ гибридизация (РЫБЫ). Полимеразной цепной реакции (ПЦР) и клонотипические праймеры CER3 - дополнительные методы, но они используются реже.[требуется медицинская цитата]
В иммунофенотип профиль состоит из CD5 + (около 80%),[10] CD10 - / +, и обычно CD5+ и CD10-.[11] CD20 +, CD23 - / + (правда, в редких случаях плюс). Обычно циклин D1 экспрессируется, но это может не потребоваться. Лимфома из мантийных клеток, отрицательная по циклину D1, может быть диагностирована путем обнаружения маркера SOX11. Лечение лимфомы из клеток мантии аналогично лечению многих вялотекущих лимфом и некоторых агрессивных лимфом.
Лимфома из клеток мантии - системное заболевание с частым поражением костного мозга и желудочно-кишечного тракта (обычно проявляющееся полипоз в подкладке). Также нередко встречается лейкозная фаза, отмеченная присутствием в крови. По этой причине и периферическая кровь, и костный мозг оцениваются на предмет наличия злокачественных клеток. Обычно выполняется компьютерная томография грудной клетки, брюшной полости и таза.[требуется медицинская цитата]
Поскольку лимфома из мантийных клеток может представлять собой лимфоматозный полипоз кишечной палочки и поражение толстой кишки является обычным явлением, в настоящее время проводится колоноскопия.[когда?] считается рутинной частью оценки. В некоторых случаях могут помочь верхняя эндоскопия и компьютерная томография шеи. Некоторым пациентам с бластным вариантом проводится люмбальная пункция для оценки спинномозговой жидкости на предмет поражения.[требуется медицинская цитата]
компьютерная томография - Компьютерная томография дает изображения части или всего тела. Дает большое количество срезов на рентгеновском снимке.[требуется медицинская цитата]
ПЭТ сканирование - Как правило, всего тела, показывает трехмерное изображение того места, где ранее введенная радиоактивная глюкоза метаболизируется с высокой скоростью. Скорость метаболизма выше среднего указывает на вероятное наличие рака. Метаболизм радиоактивной глюкозы может дать ложноположительный результат, особенно если перед тестом пациент тренировался.[требуется медицинская цитата]
ПЭТ-сканирование намного эффективнее, когда информация от него объединяется с информацией, полученной при компьютерной томографии, чтобы более точно показать, где находится опухоль, и более точно измерить размер опухолей.[требуется медицинская цитата]
Лечение
Не существует проверенных стандартов лечения MCL, и среди специалистов нет единого мнения о том, как лечить его оптимальным образом.[12] Доступно множество схем лечения, которые часто дают хорошие результаты, но почти всегда у пациентов наблюдается прогрессирование болезни после химиотерапии. Каждый рецидив, как правило, труднее лечить, а рецидив обычно протекает быстрее. Доступны схемы лечения рецидивов, и проходят испытания новые подходы. Из-за вышеупомянутых факторов многие пациенты с MCL записываются на клинические испытания, чтобы получить новейшие методы лечения.[требуется медицинская цитата]
В настоящее время существует четыре класса лечения.[когда?] для общего применения: химиотерапия, иммунотерапия, радиоиммунотерапия и новые биологические агенты. Фазы лечения обычно следующие: первая линия, после диагностики, консолидация, после первой реакции (для продления ремиссии) и рецидив. Рецидив обычно случается несколько раз.[требуется медицинская цитата]
15 октября 2020 г. Комитет по лекарственным средствам для человека (CHMP) Европейское агентство по лекарствам (EMA) приняла положительное заключение, рекомендуя предоставить условное разрешение на продажу лекарственного препарата Текартус, предназначенного для лечения рецидивирующей или рефрактерной лимфомы из мантийных клеток (MCL).[13] Заявителем на это лекарственное средство является Kite Pharma EU B.V.[13] Tecartus - это аутологичная Т-клеточная иммунотерапия, которая будет доступна в виде дисперсии для инфузии (0,4–2,0 x 108 клеток).[13] Действующее вещество в Tecartus - это генетически модифицированные аутологичные клетки CD3 +, трансдуцированные анти-CD19.[13] Связываясь с раковыми клетками, экспрессирующими CD19, и нормальными В-клетками, лекарство запускает активацию Т-клеток и секрецию воспалительных цитокинов и хемокинов.[13] Эта последовательность событий приводит к гибели клеток, экспрессирующих CD19.[13] Преимущество Tecartus заключается в уменьшении размера опухоли (ответной реакции) лимфомы из мантийных клеток, которая рецидивировала или не поддавалась другому лечению.[13]
Химиотерапия
Химиотерапия широко используется в качестве первичного лечения и часто не повторяется при рецидивах из-за побочных эффектов. При первом обострении иногда используется альтернативная химиотерапия. Для передового лечения, НАРЕЗАТЬ с ритуксимаб является наиболее распространенной химиотерапией и часто назначается в амбулаторных условиях внутривенно. Более сильная химиотерапия с большими побочными эффектами (в основном гематологическими) является HyperCVAD, часто назначаемые в условиях стационара вместе с ритуксимабом и, как правило, более физическим пациентам (некоторые из которых старше 65 лет). HyperCVAD становится популярным и показывает многообещающие результаты, особенно с ритуксимабом. Его можно использовать для некоторых пожилых (старше 65) пациентов, но он кажется полезным только тогда, когда исходный анализ крови на бета-2-MG был нормальным. Он демонстрирует лучшую полную ремиссию (CR) и выживаемость без прогрессирования (PFS), чем схемы CHOP. Менее интенсивный вариант - бендамустин с ритуксимабом.[14]
Лечение второй линии может включать: флударабин, в сочетании с циклофосфамид и / или митоксантрон, обычно с ритуксимабом. Кладрибин и клофарабин два других препарата исследуются в MCL. Относительно новый режим, в котором используются старые лекарства, - это ПКП-С, который включает относительно небольшие ежедневные дозы преднизон, этопозид, прокарбазинпероральный прием циклофосфамида доказал свою эффективность у пациентов с рецидивом. По словам Джона Леонарда, PEP-C может обладать антиангиогенетическими свойствами,[15][16] то, что он и его коллеги тестируют в ходе продолжающихся испытаний лекарств.[17]
Другой подход предполагает использование очень высоких доз химиотерапии, иногда в сочетании с облучение всего тела (ЧМТ) в попытке уничтожить все свидетельства болезни. Обратной стороной этого является разрушение всей иммунной системы пациента, что требует спасения путем трансплантации новой иммунной системы (трансплантация гемопоэтических стволовых клеток), используя либо трансплантация аутологичных стволовых клеток, или от подходящего донора ( аллогенная трансплантация стволовых клеток). Выступление Кристиана Гейслера, председателя Nordic Lymphoma Group, на конференции Американского общества гематологов (ASH) в декабре 2007 г.[18] заявили, что согласно результатам испытаний, лимфома из клеток мантии потенциально излечима с помощью очень интенсивной химио-иммунотерапии с последующей трансплантацией стволовых клеток при лечении при первом проявлении болезни.[19][20]
Эти результаты, по-видимому, подтверждаются большим испытанием Европейской сети лимфомы из клеток мантии, показывающим, что режимы индукции, содержащие моноклональные антитела и высокие дозы ARA-C (цитарабин) с последующим ASCT, должны стать новым стандартом ухода за пациентами с MCL примерно до 65 лет. годы.[21][22]
Исследование, опубликованное в апреле 2013 года, показало, что пациенты с ранее нелеченной индолентной лимфомой бендамустин плюс ритуксимаб могут рассматриваться как предпочтительный подход к лечению первой линии R-CHOP из-за увеличения выживаемости без прогрессирования и меньшего токсического эффекта.[23]
Иммунотерапия
Иммунная терапия преобладает использование ритуксимаб моноклональные антитела, продаваемые под торговым наименованием Rituxan (или как Mabthera в Европе и Австралии). Ритуксимаб может обладать хорошей активностью против MCL в качестве единственного агента, но его обычно назначают в сочетании с химиотерапией, что увеличивает продолжительность ответа. Есть новее[когда?] вариации на моноклональные антитела в сочетании с радиоактивными молекулами, известными как радиоиммунотерапия (RIT). К ним относятся Зевалин и Bexxar. Ритуксимаб также применялся у небольшого числа пациентов в комбинации с талидомид с некоторым эффектом.[24] В отличие от этой «пассивной» иммунотерапии, основанной на антителах, область «активной» иммунотерапии пытается активировать иммунную систему пациента для специфического уничтожения их собственных опухолевых клеток. Примеры активной иммунотерапии включают: противораковые вакцины, адаптивный перенос клеток, и иммунотрансплантат, который сочетает в себе вакцинацию и трансплантация аутологичных стволовых клеток. Хотя в настоящее время нет активных иммунотерапевтических средств.[когда?] стандарт ухода, многочисленные клинические испытания продолжаются.[25][26][27]
Таргетная терапия
Два ингибитора тирозинкиназы Bruton (BTKi), один В ноябре 2013 г. ибрутиниб (торговое наименование Имбрувица, Pharmacyclics LLC) и в октябре 2017 г. акалабрутиниб (торговое название Calquence, AstraZeneca Pharmaceuticals LP) были одобрены в США для лечения MCL.[28] Другие целевые агенты включают ингибитор протеасомы. бортезомиб, mTOR ингибиторы Такие как темсиролимус, а P110δ ингибитор ГС-1101.[нужна цитата]
В ноябре 2019 г. занубрутиниб (Brukinsa) был одобрен в США с показанием для лечения взрослых с лимфомой из клеток мантии, которые получали по крайней мере одну предшествующую терапию.[29]
Генная терапия
Brexucabtagene autoleucel (Tecartus) был одобрен для медицинского применения в США в июле 2020 года с показанием для лечения взрослых с рецидивирующей или рефрактерной лимфомой из клеток мантии.[30][31][32]
Каждая доза brexucabtagene autoleucel - это индивидуальное лечение, созданное с использованием собственной иммунной системы реципиента для борьбы с лимфомой.[30] Получатель Т-клетки, тип лейкоцитов, собираются и генетически модифицируются, чтобы включить новый ген, который облегчает нацеливание и уничтожение клеток лимфомы.[30] Эти модифицированные Т-клетки затем вводятся обратно реципиенту.[30]
Прогноз
Недавний[когда?] Клинические достижения в области лимфомы из клеток мантии (MCL) привели к изменению стандартных алгоритмов лечения. Комбинированная терапия ритуксимабом на переднем крае, индукция высоких доз цитарабина у молодых пациентов и, в последнее время,[когда?] Все ингибиторы брутон-тирозинкиназы (BTK) в условиях рецидива продемонстрировали преимущество в выживаемости в клинических испытаниях (Wang et al, 2013; Eskelund et al, 2016; Rule et al, 2016). За последний[когда?] За 15 лет эти практики постепенно стали внедряться в клиническую практику, и в реальных данных наблюдается соответствующее улучшение выживаемости пациентов (Abrahamsson et al, 2014; Leux et al, 2014).[33]
Общая 5-летняя выживаемость для MCL обычно составляет 50%[34] (продвинутая стадия MCL) до 70%[35] (для ограниченного этапа MCL).
Прогноз для людей с MCL проблематичен, и индексы не работают из-за пациентов с запущенной стадией заболевания. Используется стадия, но она не очень информативна, так как злокачественные В-клетки могут свободно перемещаться по лимфатической системе, и поэтому большинство пациентов на момент постановки диагноза находятся на стадии III или IV. На прогноз не сильно влияет стадирование MCL, и концепция метастазирования не применима.[требуется медицинская цитата]
Международный прогностический индекс лимфомы из клеток мантии (MIPI) был получен на основе набора данных о 455 пациентах с поздней стадией MCL, пролеченных в серии клинических испытаний в Германии / Европе. Примерно 18% исследуемой популяции получали терапию высокими дозами и трансплантацию стволовых клеток в первой ремиссии. MIPI позволяет разделить пациентов на три группы риска: низкий риск (медиана выживаемости не достигается после медианы 32 месяцев наблюдения и 5-летняя выживаемость 60%), средний риск (медиана выживаемости 51 месяц) и высокий риск (медиана выживаемость 29 мес). В дополнение к 4 независимым прогностическим факторам, включенным в модель, также было показано, что индекс пролиферации клеток (Ki-67) имеет дополнительную прогностическую значимость. Когда Ki67 доступен, можно рассчитать биологический индекс MIPI.[36]
MCL - одна из немногих НХЛ, которая может пересечь границу мозга, но в этом случае ее можно лечить.[требуется медицинская цитата]
Был изучен ряд прогностических показателей. Не существует единого мнения об их важности или полезности для прогнозов.[требуется медицинская цитата]
Ki-67 является показателем того, насколько быстро созревают клетки, и выражается в диапазоне от примерно 10% до 90%. Чем ниже процент, тем ниже скорость созревания и более ленивая болезнь. Katzenberger et al. Blood 2006; 107: 3407 представляет графики зависимости выживаемости от времени для подгрупп пациентов с различными индексами Ki-67. Он показывает среднее время выживания около одного года для 61-90% Ki-67 и почти 4 года для 5-20% Ki-67 индекса.
Типы клеток MCL могут помочь в прогнозе субъективным образом. Бластик - это более крупный тип клеток. Diffuse распространяется по узлу. Узловатые - это небольшие группы собранных клеток, распространяющиеся через узел. Диффузные и узловатые похожи по поведению. Blastic быстрее растет, и получить длительные ремиссии труднее. Некоторые думают, что через долгое время некоторые небластические MCL превращаются в бластические. Хотя выживаемость большинства бластных пациентов короче, некоторые данные показывают, что 25% пациентов с бластной MCL доживают до 5 лет. Это длиннее диффузного и почти столько же узлового (почти 7 лет).[требуется медицинская цитата]
Бета-2 микроглобулин - еще один фактор риска MCL, используемый в первую очередь для пациентов с трансплантатами. Значения менее трех дали 95% общей выживаемости до шести лет для авто SCT, где более трех дает медианное значение 44 максимальной общей выживаемости для авто SCT (Khouri 03). Это еще не[когда?] полностью подтверждено.[требуется медицинская цитата]
Тестирование на высокий уровень Лактатдегидрогеназа (ЛДГ) у пациентов с НХЛ полезен, потому что ЛДГ высвобождается, когда ткани организма распадаются на любой причина. Хотя его нельзя использовать в качестве единственного средства диагностики НХЛ, он является суррогатом для отслеживания опухолевой нагрузки у тех, кто диагностирован другими способами. Нормальный диапазон составляет примерно 100-190.[требуется медицинская цитата]
Эпидемиология
6% от неходжкинская лимфома случаи лимфомы из клеток мантии.[2] По состоянию на 2015 год[Обновить]соотношение пораженных самцов и самок составляет около 4: 1.[2]
Смотрите также
Рекомендации
- ^ "Факты о лимфоме из клеток мантии" (PDF). lls.org. Получено 10 апреля 2018.
- ^ а б c Скарбник А.П., Гой А.Х. (январь 2015 г.). «Лимфома из клеток мантии: современное состояние». Clin Adv Hematol Oncol. 13 (1): 44–55. PMID 25679973.
- ^ "t (11; 14) (q13; q32) IGH / CCND1". atlasgeneticsoncology.org. Получено 10 апреля 2018.
- ^ Ли Дж.Й., Гайяр Ф., Моро А. и др. (Май 1999 г.). «Обнаружение транслокации t (11; 14) (q13; q32) в лимфоме из клеток мантии путем флуоресцентной гибридизации in situ». Являюсь. Дж. Патол. 154 (5): 1449–52. Дои:10.1016 / S0002-9440 (10) 65399-0. ЧВК 1866594. PMID 10329598.
- ^ Barouk-Simonet E, Andrieux J, Copin MC и др. (2002). «Культура стимуляции TPA для улучшенного обнаружения t (11; 14) (q13; q32) в лимфоме из клеток мантии». Анна. Genet. 45 (3): 165–8. Дои:10.1016 / S0003-3995 (02) 01122-X. PMID 12381451.
- ^ Общество лейкемии и лимфомы (2014). "Факты о лимфоме из клеток мантии" (PDF). www.LLS.org.
- ^ Тацуно К., Фудзияма Т., Мацуока Х., Шимаути Т., Ито Т., Токура Ю. (июнь 2016 г.). «Клинические категории преувеличенных кожных реакций на укусы комаров и их патофизиология». Журнал дерматологической науки. 82 (3): 145–52. Дои:10.1016 / j.jdermsci.2016.04.010. PMID 27177994.
- ^ Кириакидис И., Василиу Э., Карастрати С., Трагианнидис А., Гомпакис Н., Хацистилиану М. (декабрь 2016 г.). «Первичная ВЭБ-инфекция и гиперчувствительность к укусам комаров: клинический случай». Virologica Sinica. 31 (6): 517–520. Дои:10.1007 / с12250-016-3868-4. PMID 27900557. S2CID 7996104.
- ^ Гой, Андре. «Лимфома из клеток мантии: новости для клиницистов». Medscape. Получено 18 октября 2007.
- ^ Стэнфордская школа медицины: "Лимфома из клеток мантии, дифференциальный диагноз" [1]
- ^ Барекман С.Л., Агилера Н.С., Аббонданцо С.Л. (июль 2001 г.). «В-клеточная лимфома низкой степени злокачественности с коэкспрессией как CD5, так и CD10. Отчет о 3 случаях». Arch. Патол. Лаборатория. Med. 125 (7): 951–3. Дои:10.1043 / 0003-9985 (2001) 125 <0951: LGBCLW> 2.0.CO; 2 (неактивно 23 ноября 2020 г.). PMID 11419985.CS1 maint: DOI неактивен по состоянию на ноябрь 2020 г. (связь)
- ^ Раджаби Б., Суитнем Дж. В. (2015). «Лимфома из клеток мантии: наблюдение до трансплантации». Ther Adv Hematol. 6 (1): 37–48. Дои:10.1177/2040620714561579. ЧВК 4298490. PMID 25642314.
- ^ а б c d е ж грамм "Tecartus: Ожидается решение ЕС". Европейское агентство по лекарствам (EMA). 16 октября 2020 г.. Получено 16 октября 2020. Текст был скопирован из этого источника © European Medicines Agency. Воспроизведение разрешено при условии указания источника.
- ^ «Архивная копия» (PDF). Архивировано из оригинал (PDF) 23 июня 2017 г.. Получено 18 марта 2015.CS1 maint: заархивированная копия как заголовок (связь)
- ^ http://www.asco.org/ASCO/Abstracts+&+Virtual+Meeting/Abstracts?&vmview=abst_detail_view&confID=23&abstractID=104642[требуется полная цитата]
- ^ «Архивная копия». Архивировано из оригинал 17 апреля 2008 г.. Получено 24 февраля 2008.CS1 maint: заархивированная копия как заголовок (связь)[требуется полная цитата]
- ^ http://clinicaltrials.gov/ct2/show/NCT00151281?cond=%22Lymphoma%2C+Mantle-Cell%22&rank=55[требуется полная цитата]
- ^ «Архивная копия». Архивировано из оригинал 16 апреля 2008 г.. Получено 15 февраля 2008.CS1 maint: заархивированная копия как заголовок (связь)
- ^ «Лимфома из клеток мантии излечима с помощью интенсивной иммунохимиотерапии». DocGuide.
- ^ http://www.abstracts2view.com/hem07/view.php?nu=HEM07L1_6026&terms=[постоянная мертвая ссылка][требуется полная цитата]
- ^ Е Х, Десаи А., Хуанг С. и др. (Июль 2018). «Первостепенная терапия для молодых и здоровых пациентов с лимфомой из клеток мантии: стратегии передовой терапии». J. Exp. Clin. Рак Res. 37 (1): 150. Дои:10.1186 / s13046-018-0800-9. ЧВК 6044039. PMID 30005678.
- ^ Е Х, Десаи А., Цзэн Д. и др. (Ноябрь 2018 г.). «Передовое лечение пожилых пациентов с лимфомой из клеток мантии». Онколог. 23 (11): 1337–1348. Дои:10.1634 / теонколог.2017-0470. ЧВК 6291324. PMID 29895632.
- ^ Rummel MJ, Niederle N, Maschmeyer G и др. (Апрель 2013). «Бендамустин плюс ритуксимаб по сравнению с CHOP плюс ритуксимаб в качестве лечения первой линии для пациентов с индолентными лимфомами и лимфомами из мантийных клеток: открытое, многоцентровое, рандомизированное исследование не меньшей эффективности, фаза 3». Ланцет. 381 (9873): 1203–10. Дои:10.1016 / S0140-6736 (12) 61763-2. PMID 23433739. S2CID 27886488.
- ^ Кауфманн Х., Радерер М., Вёрер С. и др. (Октябрь 2004 г.). «Противоопухолевая активность ритуксимаба плюс талидомид у пациентов с рецидивирующей / рефрактерной лимфомой из мантийных клеток». Кровь. 104 (8): 2269–71. Дои:10.1182 / кровь-2004-03-1091. PMID 15166030.
- ^ «Химиотерапия плюс вакцинация для лечения лимфомы из клеток мантии - NCT00101101». ClinicalTrials.gov. Получено 28 февраля 2016.
- ^ «Химиотерапия плюс вакцинация для лечения лимфомы из клеток мантии - NCT00005780». ClinicalTrials.gov. Получено 28 февраля 2016.
- ^ «Химиотерапия плюс вакцинация для лечения лимфомы из клеток мантии - NCT00490529». ClinicalTrials.gov. Получено 28 февраля 2016.
- ^ «FDA одобряет Imbruvica для лечения редких видов рака крови». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 13 ноября 2013 г. «FDA одобряет Calquence, 31 октября 2017 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов предоставило ускоренное одобрение акалабрутиниба (AstraZeneca Pharmaceuticals Inc. по лицензии Acerta Pharma BV) с показанием для лечения взрослых с лимфомой из клеток мантии (MCL), которые прошли как минимум один предыдущий курс лечения " (Пресс-релиз). Архивировано из оригинал 16 февраля 2017 г.. Получено 15 ноября 2019.
- ^ «FDA одобряет терапию для лечения пациентов с рецидивирующей и резистентной лимфомой из мантийных клеток, что подтверждается результатами клинических испытаний, показывающих высокую скорость уменьшения размеров опухоли». НАС. Управление по контролю за продуктами и лекарствами (FDA) (Пресс-релиз). 14 ноября 2019 г.. Получено 15 ноября 2019.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ а б c d «FDA одобряет первую генную терапию на основе клеток для взрослых пациентов с рецидивом или рефрактерной MCL». НАС. Управление по контролю за продуктами и лекарствами (FDA). 24 июля 2020 г.. Получено 24 июля 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Текартус». НАС. Управление по контролю за продуктами и лекарствами (FDA). 24 июля 2020 г. STN: BL 125703. Получено 24 июля 2020.
- ^ «FDA США одобряет Tecartus от Kite, первое и единственное средство CAR T для лечения рецидивирующей или рефрактерной лимфомы из клеток мантии» (Пресс-релиз). Kite Pharma. 24 июля 2020 г.. Получено 24 июля 2020 - через Business Wire.
- ^ Британский гематологический журнал 20 ноября 2018 г.
- ^ Последние значения в:Херрманн А., Хостер Э., Цвингерс Т. и др. (Февраль 2009 г.). «Повышение общей выживаемости при поздней стадии лимфомы из клеток мантии». J. Clin. Онкол. 27 (4): 511–8. Дои:10.1200 / JCO.2008.16.8435. PMID 19075279.
- ^ Leitch HA, Gascoyne RD, Chhanabhai M, Voss NJ, Klasa R, Connors JM (октябрь 2003 г.). «Лимфома из мантийных клеток ограниченной стадии». Анна. Онкол. 14 (10): 1555–61. Дои:10.1093 / annonc / mdg414. PMID 14504058.
- ^ Хостер Э., Дрейлинг М., Клаппер В. и др. (Январь 2008 г.). «Новый прогностический индекс (MIPI) для пациентов с поздней стадией лимфомы из мантийных клеток». Кровь. 111 (2): 558–65. Дои:10.1182 / кровь-2007-06-095331. PMID 17962512.
дальнейшее чтение
- Коэн Дж. Б., Заин Дж. М., Каль Б. С. (2017). «Современные подходы к лимфоме из клеток мантии: диагностика, прогноз и методы лечения». Обучающая книга Am Soc Clin Oncol. 37 (37): 512–25. Дои:10.1200 / EDBK_175448. PMID 28561694.
- Дрейлинг М., Ферреро С., Эрмин О. (ноябрь 2014 г.). «Как лечить лимфому из клеток мантии». Лейкемия. 28 (11): 2117–30. Дои:10.1038 / leu.2014.171. PMID 24854989. S2CID 22105743.
- Шибер М., Гордон Л.И., Кармали Р. (2018). «Текущий обзор и лечение лимфомы из клеток мантии». F1000Res. 7: 1136. Дои:10.12688 / f1000research.14122.1. ЧВК 6069726. PMID 30109020.
внешняя ссылка
| Классификация | |
|---|---|
| Внешние ресурсы |