WikiDer > Δ-опиоидный рецептор
В δ-опиоидный рецептор, также известный как дельта опиоидный рецептор или просто дельта-рецептор, сокращенно DOR или же DOP, является ингибирующим 7-трансмембранным Рецептор, связанный с G-белком в сочетании с G протеин граммя/ГРАММ0 и имеет энкефалины как его эндогенные лиганды.[5] Области мозга, где в значительной степени экспрессируется δ-опиоидный рецептор, варьируются от модели к модели вида. У людей δ-опиоидный рецептор наиболее сильно экспрессируется в базальный ганглий и неокортикальные области мозга.[6]
Функция
Эндогенная система опиоидных рецепторов хорошо известна своим анальгетическим потенциалом; однако точная роль активации δ-опиоидных рецепторов в модуляции боли в значительной степени является предметом дискуссий. Это также зависит от рассматриваемой модели, поскольку известно, что активность рецепторов меняется от вида к виду. Активация дельта-рецепторов производит обезболивание, возможно, как значимые потенциаторы агонистов μ-опиоидных рецепторов. Однако похоже, что дельта-агонизм сильно усиливает любой мю-агонизм. Следовательно, даже селективные агонисты мю могут вызывать анальгезию при определенных условиях, тогда как при других не могут вызывать вообще ничего.[7][8] Однако также предполагается, что боль, модулируемая μ-опиоидным рецептором, и боль, модулируемая δ-опиоидным рецептором, относятся к разным типам, с утверждением, что DOR модулирует ноцицепцию хронической боли, в то время как MOR модулирует острую боль.[9]
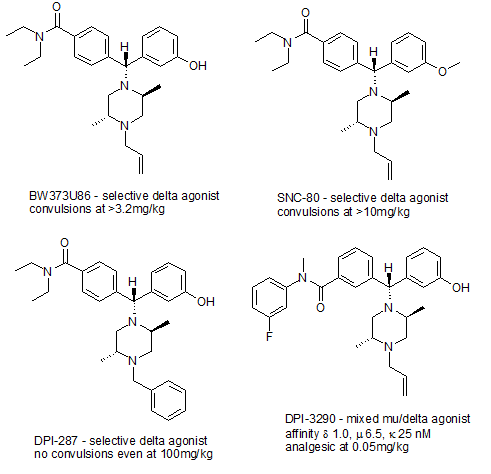
Доказательства того, производят ли дельта-агонисты угнетение дыхания смешанный; высокие дозы пептида дельта-агониста DPDPE вызывает угнетение дыхания у овец,[10] но в тестах на мышах непептидный дельта-агонист SNC-80 вызывал угнетение дыхания только при очень высокой дозе 40 мг / кг.[11] В отличие от обоих пептидных дельта-агонистов Дельторфин II и непептидный дельта-агонист (+) - BW373U86 фактически стимулировали респираторную функцию и блокировали респираторный депрессивный эффект сильного μ-опиоидного агониста альфентанил, не влияя на обезболивание.[12] Таким образом, кажется вероятным, что, хотя δ-опиоидные агонисты могут вызывать угнетение дыхания в очень высоких дозах, в более низких дозах они имеют противоположный эффект, факт, который может сделать смешанные агонисты мю / дельта, такие как DPI-3290, потенциально очень полезными лекарствами, которые могут быть намного безопаснее, чем μ-агонисты, используемые в настоящее время для снятия боли. Многие дельта-агонисты также могут вызывать припадки в высоких дозах, хотя не все дельта-агонисты вызывают такой эффект.[13]
Дополнительный интерес представляет возможность разработки дельта-агонистов для использования в качестве нового класса антидепрессант лекарства, после убедительных доказательств обоих антидепрессивных эффектов[14] а также усиление BDNF производство в мозгу в животные модели депрессии.[15] Эти антидепрессивные эффекты были связаны с эндогенными опиоидными пептидами, действующими на δ- и μ-опиоидные рецепторы,[16] и поэтому он также может быть продуцирован ингибиторами энкефалиназы, такими как RB-101.[17] ] Однако на моделях человека данные об антидепрессивных эффектах остаются неубедительными. В клиническом исследовании фазы 2 2008 года, проведенном Astra Zeneca, NCT00759395, 15 пациентов лечили селективным дельта-агонистом AZD 2327. Результаты не показали значительного влияния на настроение, что позволяет предположить, что модуляция δ-опиоидных рецепторов может не участвовать в регуляции настроения у людей. . Однако дозы применялись в низких дозах, и фармакологические данные также остаются неубедительными.[18][19] Требуются дальнейшие испытания.
Другим интересным аспектом функции δ-опиоидных рецепторов является предположение о взаимодействиях μ / δ-опиоидных рецепторов. В крайних случаях этого предположения кроется возможность олигомера μ / δ опиоидного рецептора. Доказательства этого исходят из различных профилей связывания типичных мю- и дельта-агонистов, таких как морфин и DAMGO соответственно, в клетках, которые коэкспрессируют оба рецептора, по сравнению с клетками, которые экспрессируют их индивидуально. Кроме того, работа Fan и соавторов показывает восстановление профилей связывания, когда дистальные карбоксильные концы усекаются у любого рецептора, предполагая, что концы играют роль в олигомеризации.[20] Хотя это захватывающе, опровержение Javitch и коллег предполагает, что идея олигомеризации может быть преувеличена. Надеется RET, Javitch и соавторы показали, что сигналы RET были более характерны для случайной близости между рецепторами, чем для фактического образования связи между рецепторами, предполагая, что несоответствия в профилях связывания могут быть результатом последующих взаимодействий, а не новых эффектов из-за олигомеризации.[21] Тем не менее, коэкспрессия рецепторов остается уникальной и потенциально полезной при лечении расстройств настроения и боли.
Недавняя работа показывает, что экзогенные лиганды, активирующие дельта-рецепторы, имитируют явление, известное как ишемическое прекондиционирование.[22] Экспериментально, если короткие периоды переходного ишемия индуцируются, нижележащие ткани надежно защищены, если это влияет на более длительное прерывание кровоснабжения. Опиаты и опиоиды с активностью DOR имитируют этот эффект. В модели на крысах введение лигандов DOR приводит к значительной кардиопротекции.[23]
Лиганды
До сравнительно недавнего времени было немного фармакологических инструментов для изучения δ-рецепторов. Как следствие, наше понимание их функции гораздо более ограничено, чем у других опиоидных рецепторов, для которых уже давно доступны селективные лиганды.
Однако в настоящее время доступно несколько селективных агонистов δ-опиоидных рецепторов, включая пептиды, такие как DPDPE и дельторфин II, и непептидные препараты, такие как SNC-80,[24] более мощный (+) -BW373U86,[25] новый препарат DPI-287, который не вызывает проблем с судорогами, которые наблюдались у более ранних препаратов,[26] и смешанный μ / δ-агонист DPI-3290, который является гораздо более сильным анальгетиком, чем более селективные δ-агонисты.[27] Также доступны селективные антагонисты рецептора δ, наиболее известным из которых является производное опиата. налтриндол.[28]
Агонисты
- Пептиды
- Непептиды
- 7-спироинданилоксиморфон
- N-фенэтил-14-этоксиметопон
- ADL-5859[29]
- БУ-48
- SNC-80
- BW373U86
- DPI-221
- DPI-287
- DPI-3290
- ТАН-67
- RWJ-394674
- Десметилклозапин
- Норбупренорфин (периферически ограничено)
- Каннабидиол (аллостерический модулятор, неселективный)[30]
- Тетрагидроканнабинол (аллостерический модулятор, неселективный)[30]
- Ксорфанол
Mitragyna speciosa (кратом) производные индола:
Антагонисты
Взаимодействия
дельта-опиоидные рецепторы взаимодействовать с β2 адренорецепторы,[31] аррестин β1[32] и GPRASP1.[33]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000116329 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000050511 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Quock RM, Burkey TH, Varga E, Hosohata Y, Hosohata K, Cowell SM, Slate CA, Ehlert FJ, Roeske WR, Yamamura HI (сентябрь 1999 г.). «Дельта-опиоидный рецептор: молекулярная фармакология, передача сигнала и определение эффективности лекарств». Фармакологические обзоры. 51 (3): 503–32. PMID 10471416.
- ^ Peppin, J.F .; Раффа, Р. Б. (2015). «Дельта-опиоидные агонисты: краткая информация о потенциальных терапевтических применениях». J. Clin. Pharm. Ther. (40): 155–166.
- ^ Варга Э.В., Навратилова Э., Стропова Д., Джамброзич Дж., Роеске В.Р., Ямамура Х.И. (декабрь 2004 г.). «Агонист-специфическая регуляция дельта-опиоидного рецептора». Науки о жизни. 76 (6): 599–612. Дои:10.1016 / j.lfs.2004.07.020. PMID 15567186.
- ^ Алвимопан
- ^ Berrocoso, E .; Санчес-Бласкес, П. (2009). «Опиаты как антидепрессанты». Curr. Pharm. Des. 15 (14): 1612–1622. Дои:10.2174/138161209788168100. HDL:10261/62156.
- ^ Клапп Дж. Ф., Кетт А., Олариу Н., Омоний А. Т., Ву Д., Ким Х., Сзето Х. Х. (февраль 1998 г.). «Сердечно-сосудистые и метаболические реакции на два рецептор-селективных агонистов опиоидов у беременных овец». Американский журнал акушерства и гинекологии. 178 (2): 397–401. Дои:10.1016 / S0002-9378 (98) 80032-X. PMID 9500506.
- ^ Gallantine EL, Meert TF (июль 2005 г.). «Сравнение антиноцицептивных и побочных эффектов мю-опиоидного агониста морфина и дельта-опиоидного агониста SNC80». Фундаментальная и клиническая фармакология и токсикология. 97 (1): 39–51. Дои:10.1111 / j.1742-7843.2005.pto_07.x. PMID 15943758.
- ^ Су Й.Ф., Макнатт Р.В., Чанг К.Дж. (декабрь 1998 г.). «Дельта-опиоидные лиганды устраняют вызванное альфентанилом угнетение дыхания, но не антиноцицепцию». Журнал фармакологии и экспериментальной терапии. 287 (3): 815–23. PMID 9864259.
- ^ Юткевич Е.М., Балади М.Г., Фолк Дж. Э., Райс К. К., Вудс Дж. Х. (июнь 2006 г.). «Судорожные и электроэнцефалографические изменения, вызванные непептидными дельта-опиоидными агонистами у крыс: сравнение с пентилентетразолом». Журнал фармакологии и экспериментальной терапии. 317 (3): 1337–48. Дои:10.1124 / jpet.105.095810. PMID 16537798.
- ^ Метла, округ Колумбия, Юткевич Е.М., Райс К.С., Трейнор Дж. Р., Вудс Дж. Х. (сентябрь 2002 г.). «Поведенческие эффекты агонистов дельта-опиоидных рецепторов: потенциальные антидепрессанты?». Японский журнал фармакологии. 90 (1): 1–6. Дои:10.1254 / jjp.90.1. PMID 12396021.
- ^ Торрегросса М.М., Юткевич Е.М., Мосберг Х.И., Балбони Г., Уотсон С.Дж., Вудс Дж. Х. (январь 2006 г.). «Агонисты пептидных дельта-опиоидных рецепторов вызывают эффекты, подобные антидепрессантам в тесте принудительного плавания, и регулируют экспрессию мРНК BDNF у крыс». Исследование мозга. 1069 (1): 172–81. Дои:10.1016 / j.brainres.2005.11.005. ЧВК 1780167. PMID 16364263.
- ^ Zhang H, Torregrossa MM, Jutkiewicz EM, Shi YG, Rice KC, Woods JH, Watson SJ, Ko MC (февраль 2006 г.). «Эндогенные опиоиды активируют мРНК нейротрофического фактора головного мозга через дельта- и микро-опиоидные рецепторы независимо от антидепрессантоподобных эффектов». Европейский журнал нейробиологии. 23 (4): 984–94. Дои:10.1111 / j.1460-9568.2006.04621.x. ЧВК 1462954. PMID 16519663.
- ^ Юткевич Е.М., Торрегросса М.М., Собчик-Коджиро К., Мосберг Х.И., Фолк Дж. Э., Райс К. С., Уотсон С. Дж., Вудс Дж. Х. (февраль 2006 г.). «Поведенческие и нейробиологические эффекты ингибитора энкефалиназы RB101 по сравнению с его антидепрессивным действием». Европейский журнал фармакологии. 531 (1–3): 151–9. Дои:10.1016 / j.ejphar.2005.12.002. ЧВК 1828120. PMID 16442521.
- ^ Hudzik TJ, Maciag C, Smith MA, Caccese R, Pietras MR, Bui KH, Coupal M, Adam L, Payza K, Griffin A, Smagin G, Song D, Swedberg MD, Brown W (июль 2011 г.). «Доклиническая фармакология AZD2327: высокоселективный агонист δ-опиоидного рецептора». Журнал фармакологии и экспериментальной терапии. 338 (1): 195–204. Дои:10.1124 / jpet.111.179432. PMID 21444630.
- ^ «Исследование антидепрессивной эффективности селективного высокоаффинного энкефалинергического агониста при тревожном большом депрессивном расстройстве (AMDD) - Просмотр полного текста - ClinicalTrials.gov». Clinicaltrials.gov. Получено 2015-12-11.
- ^ Fan T, Varghese G, Nguyen T., Tse R, O'Dowd BF, George SR (ноябрь 2005 г.). «Роль дистальных карбоксильных хвостов в создании новой фармакологии и профиля активации G-белка для гетероолигомеров мю- и дельта-опиоидных рецепторов» (PDF). Журнал биологической химии. 280 (46): 38478–88. Дои:10.1074 / jbc.M505644200. PMID 16159882.
- ^ Ламберт, Невин А; Джавич, Джонатан А (2014). "Опровержение Невина А. Ламберта и Джонатана А. Джавича". Журнал физиологии. 592 (12): 2449. Дои:10.1113 / jphysiol.2014.274241. ЧВК 4080929. PMID 24931947.
- ^ Чжан Дж, Цянь Х, Чжао П, Хун СС, Ся Й (апрель 2006 г.). «Быстрое прекондиционирование гипоксии защищает нейроны коры от токсичности глутамата через дельта-опиоидный рецептор». Инсульт: журнал церебрального кровообращения. 37 (4): 1094–9. Дои:10.1161 / 01.STR.0000206444.29930.18. PMID 16514101.
- ^ Го Л., Чжан Л., Чжан, округ Колумбия (октябрь 2005 г.). «[Механизмы кардиозащитных эффектов дельта-опиоидов при ишемии и их потенциальные клинические применения]». Шэн Ли Кэ Сюэ Цзинь Чжань [Прогресс в физиологии] (на китайском языке). 36 (4): 333–6. PMID 16408774.
- ^ Кальдерон С. Н., Ротман Р. Б., Поррека Ф., Флиппен-Андерсон Дж. Л., МакНатт Р. В., Сюй Х., Смит Л. Е., Билски Е. Дж., Дэвис П., Райс К. К. (июль 1994 г.). "Зонды для явлений, опосредованных наркотическими рецепторами. 19. Синтез (+) - 4 - [(альфа R) -альфа - ((2S, 5R) -4-аллил-2,5-диметил-1-пиперазинил) -3- метоксибензил] -N, N-диэтилбензамид (SNC 80): высокоселективный непептидный агонист дельта-опиоидных рецепторов ». Журнал медицинской химии. 37 (14): 2125–8. Дои:10.1021 / jm00040a002. PMID 8035418.
- ^ Кальдерон С.Н., Райс К.С., Ротман Р.Б., Поррека Ф., Флиппен-Андерсон Дж.Л., Каякири Х., Сюй Х., Бекеттс К., Смит Л.Е., Билски Э.Дж., Дэвис П., Хорват Р. (февраль 1997 г.). «Зонды для явлений, опосредованных наркотическими рецепторами. 23. Синтез, связывание с опиоидными рецепторами и биологический анализ высокоселективного дельта-агониста (+) - 4 - [(альфа R) -альфа - ((2S, 5R) -4-Аллил-2») , 5-диметил-1-пиперазинил) -3-метоксибензил] - N, N-диэтилбензамид (SNC 80) и родственные новые лиганды непептидных дельта-опиоидных рецепторов ». Журнал медицинской химии. 40 (5): 695–704. Дои:10.1021 / jm960319n. PMID 9057856.
- ^ Юткевич Е.М. (июнь 2006 г.). «Антидепрессантоподобные эффекты агонистов дельта-опиоидных рецепторов». Молекулярные вмешательства. 6 (3): 162–9. Дои:10.1124 / миль 6.3.7. PMID 16809477.
- ^ Анантан С (2006). «Опиоидные лиганды со смешанными взаимодействиями мю / дельта-опиоидных рецепторов: новый подход к новым анальгетикам». Журнал AAPS. 8 (1): E118-25. Дои:10.1208 / aapsj080114. ЧВК 2751430. PMID 16584118.
- ^ Портогезе PS, Султана М., Такемори А.Е. (январь 1988 г.). «Налтриндол, высокоселективный и мощный непептидный дельта-антагонист опиоидных рецепторов». Европейский журнал фармакологии. 146 (1): 185–6. Дои:10.1016 / 0014-2999 (88) 90502-Х. PMID 2832195.
- ^ Ле Бурдоннек Б., Винд РТ, Аджелло К.В., Лейстер Л.К., Гу М., Чу Г.Х., Тутхилл П.А., Баркер В.М., Коблиш М., Виант Д.Д., Грачик Т.М., Беланжер С., Кассель Д.А., Фещенко М.С., Брогдон Б.Л., Смит С.А., Христос DD, Дереланко MJ, Kutz S, Little PJ, DeHaven RN, DeHaven-Hudkins DL, Dolle RE (октябрь 2008 г.). «Сильные пероральные биодоступные агонисты дельта-опиоидных рецепторов для лечения боли: открытие N, N-диэтил-4- (5-гидроксиспиро [хромен-2,4'-пиперидин] -4-ил) бензамида (ADL5859)». Журнал медицинской химии. 51 (19): 5893–6. Дои:10.1021 / jm8008986. PMID 18788723.
- ^ а б Kathmann M, Flau K, Redmer A, Tränkle C, Schlicker E (февраль 2006 г.). «Каннабидиол является аллостерическим модулятором мю- и дельта-опиоидных рецепторов». Архив фармакологии Наунин-Шмидеберг. 372 (5): 354–61. Дои:10.1007 / s00210-006-0033-х. PMID 16489449.
- ^ Маквей М., Рамзи Д., Келлетт Е., Рис С., Уилсон С., Папа А. Дж., Миллиган Г. (апрель 2001 г.). «Мониторинг олигомеризации рецепторов с использованием резонансного переноса энергии флуоресценции с временным разрешением и резонансного переноса энергии биолюминесценции. Дельта-опиоидный рецептор человека демонстрирует конститутивную олигомеризацию на поверхности клетки, которая не регулируется занятостью рецептора». Журнал биологической химии. 276 (17): 14092–9. Дои:10.1074 / jbc.M008902200. PMID 11278447.
- ^ Цен Би, Ю Кью, Го Дж, Ву И, Лин К, Ченг З, Ма Л, Пей Джи (март 2001 г.). «Прямое связывание бета-аррестинов с двумя отдельными внутриклеточными доменами дельта-опиоидного рецептора». Журнал нейрохимии. 76 (6): 1887–94. Дои:10.1046 / j.1471-4159.2001.00204.x. PMID 11259507.
- ^ Уистлер Дж. Л., Энквист Дж., Марли А., Фонг Дж., Гладхер Ф., Цуруда П., Мюррей С. Р., Фон Застров М. (июль 2002 г.). «Модуляция постендоцитарной сортировки рецепторов, связанных с G-белком». Наука. 297 (5581): 615–20. Дои:10.1126 / science.1073308. PMID 12142540.
дальнейшее чтение
- Нарита М., Фунада М., Судзуки Т. (январь 2001 г.). «Регулирование опиоидной зависимости по типам опиоидных рецепторов». Фармакология и терапия. 89 (1): 1–15. Дои:10.1016 / S0163-7258 (00) 00099-1. PMID 11316510.
- Эванс С.Дж., Кейт Д.Е., Моррисон Х., Магендзо К., Эдвардс Р.Х. (декабрь 1992 г.). «Клонирование дельта-опиоидного рецептора путем функциональной экспрессии». Наука. 258 (5090): 1952–5. Дои:10.1126 / science.1335167. PMID 1335167.
- Offermanns S, Schultz G, Rosenthal W (февраль 1991 г.). «Доказательства опиоидного рецептора-опосредованной активации G-белков Go и Gi2 в мембранах гибридных клеток нейробластомы x глиомы (NG108-15)». Журнал биологической химии. 266 (6): 3365–8. PMID 1671672.
- Симонин Ф., Бефорт К., Гаверио-Рафф С., Маттес Х., Наппей В., Ланн Б., Мичелетти Г., Киффер Б. (декабрь 1994 г.). «Человеческий дельта-опиоидный рецептор: геномная организация, клонирование кДНК, функциональная экспрессия и распределение в человеческом мозге». Молекулярная фармакология. 46 (6): 1015–21. PMID 7808419.
- Бефорт К., Маттей М.Г., Рокель Н., Киффер Б. (март 1994 г.). «Хромосомная локализация гена дельта-опиоидного рецептора в человеческих 1p34.3-p36.1 и 4D полосах мыши с помощью гибридизации in situ». Геномика. 20 (1): 143–5. Дои:10.1006 / geno.1994.1146. PMID 8020949.
- Кнапп Р.Дж., Малатынска Э., Фанг Л., Ли Х, Бабин Э., Нгуен М., Санторо Г., Варга Е.В., Хруби В.Дж., Роеске В.Р. (1994). «Идентификация человеческого дельта-опиоидного рецептора: клонирование и экспрессия». Науки о жизни. 54 (25): PL463-9. Дои:10.1016/0024-3205(94)90138-4. PMID 8201839.
- Георгоусси З., Карр С., Миллиган Дж. (Июль 1993 г.). «Прямые измерения in situ взаимодействий опиоидных рецепторов мозга крысы с гуанин-нуклеотид-связывающим белком Go». Молекулярная фармакология. 44 (1): 62–9. PMID 8393523.
- Бздега Т., Чин Х., Ким Х., Юнг Х.Х., Козак К.А., Клее В.А. (октябрь 1993 г.). «Региональная экспрессия и хромосомная локализация гена дельта-опиатного рецептора». Труды Национальной академии наук Соединенных Штатов Америки. 90 (20): 9305–9. Дои:10.1073 / пнас.90.20.9305. ЧВК 47556. PMID 8415697.
- Хо МК, Вонг Й.Х. (июнь 1997 г.). «Функциональная роль амино-концевого серина16 и серина27 G alphaZ в рецепторном и эффекторном взаимодействии». Журнал нейрохимии. 68 (6): 2514–22. Дои:10.1046 / j.1471-4159.1997.68062514.x. PMID 9166747.
- Hedin KE, Bell MP, Kalli KR, Huntoon CJ, Sharp BM, McKean DJ (декабрь 1997 г.). «Дельта-опиоидные рецепторы, экспрессируемые Т-клетками Jurkat, усиливают секрецию ИЛ-2 за счет увеличения комплексов АР-1 и активности элемента промотора, связывающего NF-AT / АР-1». Журнал иммунологии. 159 (11): 5431–40. PMID 9548483.
- Джордан Б.А., Деви Л.А. (июнь 1999 г.). «Гетеродимеризация рецептора, связанного с G-белком, модулирует функцию рецептора». Природа. 399 (6737): 697–700. Дои:10.1038/21441. ЧВК 3125690. PMID 10385123.
- Petaja-Repo UE, Hogue M, Laperriere A, Walker P, Bouvier M (май 2000 г.). «Экспорт из эндоплазматического ретикулума представляет собой ограничивающую стадию созревания и экспрессии на клеточной поверхности человеческого дельта-опиоидного рецептора». Журнал биологической химии. 275 (18): 13727–36. Дои:10.1074 / jbc.275.18.13727. PMID 10788493.
- Гелернтер Дж., Кранцлер HR (июль 2000 г.). «Обнаружение варианта в локусе дельта-опиоидного рецептора (OPRD1) и популяционная генетика нового варианта, влияющего на последовательность белка». Генетика человека. 107 (1): 86–8. Дои:10.1007 / s004390050016. PMID 10982041.
- Го Дж, Ву И, Чжан В., Чжао Дж, Деви Л.А., Пей Джи, Ма Л. (ноябрь 2000 г.). «Идентификация сайтов фосфорилирования киназы 2 рецепторов, связанных с G-белками, ответственных за фосфорилирование дельта-опиоидных рецепторов, стимулированное агонистами». Молекулярная фармакология. 58 (5): 1050–6. Дои:10.1124 / моль 58.5.1050. PMID 11040053.
- Гомес И., Джордан Б.А., Гупта А., Трапаидзе Н., Надь В., Деви Л.А. (ноябрь 2000 г.). «Гетеродимеризация мю- и дельта-опиоидных рецепторов: роль в синергии опиатов». Журнал неврологии. 20 (22): RC110. Дои:10.1523 / JNEUROSCI.20-22-j0007.2000. ЧВК 3125672. PMID 11069979.
- Сюй В., Чен С., Хуан П., Ли Дж., Де Риэль Дж. К., Джавич Дж. А., Лю-Чен Л. Ю. (ноябрь 2000 г.). «Консервативный остаток цистеина 7.38 по-разному доступен в щелях сайта связывания мю-, дельта- и каппа-опиоидных рецепторов». Биохимия. 39 (45): 13904–15. Дои:10.1021 / bi001099p. PMID 11076532.
- Хартли Дж. Л., Темпл Г. Ф., Браш Массачусетс (ноябрь 2000 г.). «Клонирование ДНК с использованием сайт-специфической рекомбинации in vitro». Геномные исследования. 10 (11): 1788–95. Дои:10.1101 / гр.143000. ЧВК 310948. PMID 11076863.
- Саид RW, Стефано Б. Б., Мурга Д. Д., Short TW, Qi F, Bilfinger TV, Magazine HI (декабрь 2000 г.). «Экспрессия функциональных дельта-опиоидных рецепторов в гладких мышцах сосудов». Международный журнал молекулярной медицины. 6 (6): 673–7. Дои:10.3892 / ijmm.6.6.673. PMID 11078827.
- Сян Б., Ю Г. Х., Го Дж, Чен Л., Ху В., Пей Г., Ма Л. (февраль 2001 г.). «Гетерологичная активация протеинкиназы С стимулирует фосфорилирование дельта-опиоидного рецептора по серину 344, что приводит к интернализации опосредованного бета-аррестином и клатрином рецептора». Журнал биологической химии. 276 (7): 4709–16. Дои:10.1074 / jbc.M006187200. PMID 11085981.
- Йео А., Самуэй Д.С., Фаулер К.Э., Ганн-Мур Ф., Хендерсон Дж. (Март 2001 г.). «Совпадающая передача сигналов между Gi / Go-связанным дельта-опиоидным рецептором и Gq-связанным мускариновым рецептором m3 на уровне внутриклеточного свободного кальция в клетках SH-SY5Y». Журнал нейрохимии. 76 (6): 1688–700. Дои:10.1046 / j.1471-4159.2001.00185.x. PMID 11259487.
внешняя ссылка
- «Опиоидные рецепторы: δ». База данных рецепторов и ионных каналов IUPHAR. Международный союз фундаментальной и клинической фармакологии.
- дельта + опиоид + рецептор в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)