WikiDer > Апигенин
 | |
 | |
| Имена | |
|---|---|
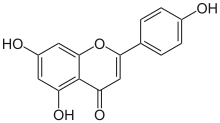
| Название ИЮПАК 5,7-дигидрокси-2- (4-гидроксифенил) -4ЧАС-1-бензопиран-4-он | |
| Другие имена Апигенин; Ромашка; Апигенол; Спигенин; Версулин; 4 ', 5,7-тригидроксифлавон; C.I. Натуральный желтый 1 | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ |
|
| ChemSpider |
|
| DrugBank |
|
| ECHA InfoCard | 100.007.540 |
| КЕГГ |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C15ЧАС10О5 | |
| Молярная масса | 270.240 г · моль−1 |
| Внешность | Желтое кристаллическое твердое вещество |
| Температура плавления | От 345 до 350 ° C (от 653 до 662 ° F, от 618 до 623 K) |
| УФ-видимый (λМаксимум) | 267, 296sh, 336 нм в метаноле[2] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Апигенин (4 ', 5,7-тригидроксифлавон), обнаруженный во многих растениях, является натуральный продукт принадлежащий к флавон класс, который является агликон из нескольких встречающихся в природе гликозиды. Это желтое кристаллическое вещество, которое использовалось для окрашивания шерсти.
Источники в природе
Апигенин содержится во многих фруктах и овощах, но петрушка, сельдерей, сельдерей, и ромашка чай - самые распространенные источники.[3] Апигенин особенно много в цветках ромашки, составляя 68% от общего количества. флавоноиды.[4]
Биосинтез
Апигенин является биосинтетическим производным от общего фенилпропаноидный путь и путь синтеза флавонов.[5] Путь фенилпропаноидов начинается с ароматических аминокислот L-фенилаланина или L-тирозина, обоих продуктов Путь Шикимата.[6] Начиная с L-фенилаланина, сначала аминокислота дезаминируется неокислительно путем фенилаланин аммиаклиаза (PAL) для получения циннамата с последующим окислением на параграф позиция по циннамат-4-гидроксилаза (C4H) производить п-кумарат. Поскольку L-тирозин уже окисляется в параграф положении, он пропускает это окисление и просто дезаминируется тирозин аммиаклиаза (TAL) прибыть в п-кумарат.[7] Чтобы завершить общий путь фенилпропаноидов, 4-кумарат КоА-лигаза (4CL) заменяет кофермент A (CoA) на карбоксигруппу п-кумарат. Вступая в путь синтеза флавонов, тип III поликетидсинтаза фермент халкон-синтаза (CHS) использует последовательную конденсацию трех эквивалентов малонил-КоА с последующей ароматизацией для преобразования п-кумароил-КоА в халкон.[8] Халкон-изомераза (CHI) затем изомеризует продукт, чтобы замкнуть пироновое кольцо, чтобы получить нарингенин. Наконец, фермент флаванонсинтаза (ФНС) окисляет нарингенин до апигенина.[9] Ранее были описаны два типа FNS; FNS I, растворимый фермент, который использует 2-оксоглутурат, Fe2+, аскорбат в качестве кофакторов и FNS II, мембраносвязанная, НАДФН-зависимая цитохром p450 монооксигеназа.[10]
Гликозиды
Встречающиеся в природе гликозиды образованные комбинацией апигенина с сахарами включают:
- Апиин (апигенин 7-О-апиоглюкозид), выделенный из петрушка[11] и сельдерей
- Апигетрин (апигенин 7-глюкозид), обнаруженный в одуванчик кофе
- Витексин (апигенин 8-C-глюкозид)
- Изовитексин (апигенин 6-C-глюкозид)
- Рифолин (апигенин 7-О-неогесперидозид)
- Шафтозайд (апигенин 6-C-глюкозид 8-C-арабинозид)
Смотрите также
Рекомендации
- ^ Индекс Merck, 11-е издание, 763.
- ^ Систематическая идентификация флавоноидов. Mabry et al, 1970, стр. 81
- ^ Соединение средиземноморской диеты, делающее раковые клетки «смертельными» Эмили Колдуэлл, Medical Express, 20 мая 2013 г.
- ^ Venigalla M, Gyengesi E, Münch G (август 2015 г.). «Куркумин и апигенин - новые и многообещающие терапевтические средства против хронического нейровоспаления при болезни Альцгеймера». Исследование нейронной регенерации. 10 (8): 1181–5. Дои:10.4103/1673-5374.162686. ЧВК 4590215. PMID 26487830.
- ^ Форкманн, Г. (январь 1991 г.). «Флавоноиды как цветочные пигменты: формирование природного спектра и его расширение с помощью генной инженерии». Селекция растений. 106 (1): 1–26. Дои:10.1111 / j.1439-0523.1991.tb00474.x. ISSN 0179-9541.
- ^ Херрманн К.М. (январь 1995 г.). «Путь шикимата как вход во вторичный ароматический метаболизм». Физиология растений. 107 (1): 7–12. Дои:10.1104 / стр.107.1.7. ЧВК 161158. PMID 7870841.
- ^ Ли Х, Ким Б.Г., Ким М., Ан Дж. Х. (сентябрь 2015 г.). «Биосинтез двух флавонов, апигенина и генкванина в Escherichia coli». Журнал микробиологии и биотехнологии. 25 (9): 1442–8. Дои:10.4014 / jmb.1503.03011. PMID 25975614.
- ^ Остин МБ, Ноэль Дж. П. (февраль 2003 г.). «Суперсемейство халконсинтаз поликетидсинтаз типа III». Отчеты о натуральных продуктах. 20 (1): 79–110. CiteSeerX 10.1.1.131.8158. Дои:10.1039 / b100917f. PMID 12636085.
- ^ Мартенс С., Форкманн Г., Матерн Ю., Лукацин Р. (сентябрь 2001 г.). «Клонирование флавон-синтазы I петрушки». Фитохимия. 58 (1): 43–6. Дои:10.1016 / S0031-9422 (01) 00191-1. PMID 11524111.
- ^ Леонард Э., Ян Й., Лим К. Х., Коффас М. А. (декабрь 2005 г.). «Исследование двух различных флавон-синтаз для растительного биосинтеза флавонов в Saccharomyces cerevisiae». Прикладная и экологическая микробиология. 71 (12): 8241–8. Дои:10.1128 / AEM.71.12.8241-8248.2005. ЧВК 1317445. PMID 16332809.
- ^ Мейер Х, Боларинва А, Вольфрам Г, Линсейсен Дж (2006). «Биодоступность апигенина из петрушки, богатой апиином, у человека». Анналы питания и метаболизма. 50 (3): 167–72. Дои:10.1159/000090736. PMID 16407641. S2CID 8223136.
Флавоны и их конъюгаты | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Агликоны |
| ||||||||||||
| Гликозиды |
| ||||||||||||
| Ацетилированный | |||||||||||||
| Сульфатные гликозиды | |||||||||||||
| Полимеры | |||||||||||||
| Наркотики | |||||||||||||
| Фитоэстрогены |
| ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Микоэстрогены |
| ||||||||||||||||||||||||
| Синтетический | |||||||||||||||||||||||||
| Металлоэстрогены | |||||||||||||||||||||||||
| ER |
| ||||||
|---|---|---|---|---|---|---|---|
| GPER |
| ||||||
| Спирты | |
|---|---|
| Барбитураты |
|
| Бензодиазепины |
|
| Карбаматы | |
| Флавоноиды | |
| Имидазолы | |
| Кава составляющие | |
| Monoureides | |
| Нейроактивные стероиды |
|
| Небензодиазепины | |
| Фенолы | |
| Пиперидиндионы | |
| Пиразолопиридины | |
| Хиназолиноны | |
| Летучие вещества/газы |
|
| Прочие / несортированные |
|
| |||||||||||||||||||||||||||||||||||||
| MOR |
|
|---|---|
| DOR |
|
| KOR |
|
| NOP |
|
| Несортированный | |
| Другие |
|
| PR |
| ||||||
|---|---|---|---|---|---|---|---|
| mPR (PAQR) |
| ||||||
