WikiDer > Селегилин
 | |
 | |
| Клинические данные | |
|---|---|
| Произношение | /səˈлɛdʒɪляп/ sə-LEJ-i-leen |
| Торговые наименования | Элдеприл, Джумекс, Зелапар, Эмсам, другие[1] |
| Другие имена | L-Депренил; (р)-(–)-N, α-Диметил-N-2-пропинилфенэтиламин; (р)-(–)-N-Метил-N-2-пропиниламфетамин; (р)-(–)-N-2-пропинилметамфетамин |
| AHFS/Drugs.com | Монография |
| MedlinePlus | a697046 |
| Данные лицензии | |
| Беременность категория |
|
| Маршруты администрация | Устно, трансдермальный (патч) |
| Код УВД | |
| Легальное положение | |
| Легальное положение | |
| Фармакокинетический данные | |
| Биодоступность | 10% (перорально), 73% (пластырь) |
| Связывание с белками | 94% |
| Метаболизм | Кишечник и печень |
| Метаболиты | N-Десметилселегилин, левоамфетамин, левометамфетамин |
| Устранение период полураспада | 10 часов (устно)[нужна цитата], 18–25 часов[нужна цитата] (трансдермальный) |
| Экскреция | Моча |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| ECHA InfoCard | 100.109.269 |
| Химические и физические данные | |
| Формула | C13ЧАС17N |
| Молярная масса | 187,281 г · моль−1 |
| 3D модель (JSmol) | |
| |
| |
| (проверить) | |
Селегилин, также известен как L-депренил и продается под торговыми марками Элдеприл и Эмсам среди прочего, это лекарство, которое используется для лечения болезнь Паркинсона и сильное депрессивное расстройство.[1] Выпускается в форме капсулы или планшет взят устно для болезни Паркинсона и как патч на кожу от депрессии.
Селегилин действует как ингибитор моноаминоксидазы, и увеличивает уровень моноаминовые нейротрансмиттеры в мозг. В типичных клинических дозах селегилин является селективный и необратимый ингибитор из моноаминоксидаза B (МАО-В), повышение уровня дофамин в мозгу. В больших дозах он теряет свою специфичность, а также подавляет МАО-А, повышение уровня серотонин, норэпинефрин, и дофамин в головном мозге.
Медицинское использование
болезнь Паркинсона
В форме таблеток селегилин используется для лечения симптомов болезнь Паркинсона.[2] Чаще всего используется как дополнение к таким лекарствам, как леводопа (L-ДОПА), хотя он использовался не по назначению в качестве монотерапии.[3][4] Обоснованием добавления селегилина к леводопе является уменьшение необходимой дозы леводопы и, таким образом, уменьшение моторных осложнений терапии леводопой.[5] Селегилин отсрочивает момент, когда становится необходимым лечение леводопой, примерно с 11 до 18 месяцев после постановки диагноза.[6] Есть некоторые свидетельства того, что селегилин действует как нейропротектор и снижает скорость прогрессирования заболевания, хотя это оспаривается.[4][5]
Селегилин также использовался не по назначению в качестве паллиативного лечения деменции у Болезнь Альцгеймера.[4]
Депрессия
Селегилин также доставляется через трансдермальный пластырь используется как лечение сильное депрессивное расстройство.[7][8]
Количественный обзор, опубликованный в 2015 году, показал, что для объединенных результатов основных испытаний количество, необходимое для лечения (признак размер эффекта, поэтому меньшее число лучше) для пластыря для уменьшения симптомов было 11, а для ремиссии - 9.[8] В число, необходимое, чтобы навредить (инверсия NNT, большее число здесь лучше) варьировалось от 387 для сексуальных побочных эффектов до 7 для реакции в месте нанесения.[8] Что касается вероятности получения помощи или вреда (ЛГГ), анализ показал, что пластырь с селегилином в 3,6 раза чаще приводит к ремиссии по сравнению с прекращением лечения из-за побочных эффектов; ЛГГ для ремиссии по сравнению с частотой бессонницы составил 2,1; ЛГГ для ремиссии по сравнению с прекращением лечения из-за бессонницы составил 32,7. ЛГГ для ремиссии по сравнению с бессонницей и сексуальной дисфункцией были очень низкими.[8]
Синдром дефицита внимания и гиперактивности
Селегилин применялся в Синдром дефицита внимания и гиперактивности (СДВГ).[9]
Особые группы населения
Селегилин является универсальным для всех видов использования человеком и во всех формах. категория беременности C: исследования на беременных лабораторных животных показали неблагоприятное воздействие на плод, но адекватных исследований на людях нет.[2][7]
Побочные эффекты
Побочные эффекты таблетированной формы в сочетании с леводопа включать в порядке убывания частоты тошнота, галлюцинации, спутанность сознания, депрессия, потеря равновесия, бессонница, учащение непроизвольных движений, волнение, медленный или нерегулярный пульс, заблуждения, гипертония, новый или увеличенный стенокардия, и обморок.[2] Большинство побочных эффектов связано с высокой передачей сигналов дофамина, и их можно облегчить, снизив дозу леводопы.[1]
Основные побочные эффекты пластыря от депрессии включают: реакция на сайте приложения, бессонница, понос, и больное горло.[7] Пластырь селегилин имеет предупреждение о черном ящике о возможном повышенном риске самоубийство, особенно для молодежи,[7] как и все антидепрессанты с 2007 года.[10]
Взаимодействия
И пероральная форма, и пластырь содержат строгие предупреждения против сочетания селегилина с препаратами, которые могут вызывать серотониновый синдром, такие как СИОЗС и лекарства от кашля декстрометорфан.[2][7][11] Селегилин в сочетании с опиоидным анальгетиком петидин не рекомендуется, так как это может привести к серьезным побочным эффектам.[11] Несколько других синтетических опиоидов, таких как трамадол и метадон, а также различные триптаны, противопоказаны из-за возможности развития серотонинового синдрома.[12][13]
Противозачаточные таблетки содержащий этинилэстрадиол и прогестин увеличить биодоступность селегилина в 10-20 раз.[14] Высокие уровни могут привести к потере селективности МАО-В, а селегилин также может начать ингибировать МАО-А. Это увеличивает восприимчивость к побочным эффектам неселективного MAOI, такие как тирамин-индуцированный гипертонический криз и токсичность серотонина в сочетании с серотонинергический лекарства.[14]
Обе формы препарата содержат предупреждения о пищевые ограничения избежать гипертонический криз которые связаны с ингибиторами МАО.[2][7] Форма пластыря была создана частично для преодоления пищевых ограничений; клинические испытания показали, что он был успешным. Кроме того, в постмаркетинговое наблюдение с апреля 2006 г. по октябрь 2010 г. было сделано только 13 самоотчетов о возможных эпизодах гипертонии или гипертонии из 29 141 воздействия препарата, и ни один не сопровождался объективными клиническими данными.[8] Самая низкая доза пластыря, 6 мг / 24 часа, не требует каких-либо диетических ограничений.[15] Более высокие дозы пластыря и пероральных составов, будь то в сочетании с более старыми неселективными ИМАО или в сочетании с обратимый ингибитор МАО-А моклобемид, требуют низкого-тирамин диета.[11]
Фармакология
Фармакодинамика
Селегилин - селективный ингибитор МАО-Б, необратимо подавляя его, связывая с ним ковалентно.[1][16] Он оказывает действие, блокируя распад дофамина, тем самым увеличивая его активность.[17] Его возможные нейрозащитные свойства могут быть связаны с защитой близлежащих нейронов от свободных кислородные радикалы которые высвобождаются действием MAO-B. В более высоких дозах селегилин теряет избирательность в отношении МАО-В и подавляет МАО-А также.[1]
Селегилин также подавляет CYP2A6 и может усилить действие никотин как результат.[18] Селегилин также активирует σ1 рецепторы, имеющий относительно высокое сродство к этим рецепторам приблизительно 400 нМ.[19][20]
Фармакокинетика
Селегилин имеет пероральный биодоступность около 10%, что увеличивается при приеме внутрь вместе с жирной пищей, поскольку молекула является жирорастворимой.[1][21] Селегилин и его метаболиты широко связываются с белками плазмы (94%). Они пересекают гематоэнцефалический барьер и попадают в мозг, где они наиболее сконцентрированы в таламус, базальный ганглий, средний мозг, и поясная извилина.[4][7]
Селегилин в основном метаболизируется в кишечник и печень; он и его метаболиты выводятся с мочой.[1]
Буккальное управление Селегилина приводит к 5-кратному повышению биодоступности, более воспроизводимой концентрации в крови и образованию меньшего количества метаболитов амфетамина, чем при пероральной таблетированной форме.[22]
Метаболизм
Селегилин метаболизируется цитохром P450 к L-десметилселегилин и левометамфетамин.[23][24] Десметилселегилин имеет некоторую активность против МАО-В, но намного меньшую, чем у селегилина.[17][16] Считается, что в дальнейшем он метаболизируется CYP2C19.[25] Левометамфетамин превращается в левоамфетамин.
Из-за наличия этих метаболитов люди, принимающие селегилин, могут дать положительный результат на «амфетамин» или «метамфетамин» при проверке на наркотики.[26] Хотя метаболиты амфетамина могут способствовать способности селегилина к подавлять обратный захват нейротрансмиттеров дофамина и норэпинефрин, они также были связаны с ортостатическая гипотензия и галлюцинации.[24][27][28] Метаболиты амфетамина: гидроксилированный а в фазе II сопряжены глюкуронилтрансфераза.
Новый ингибитор МАО-В против паркинсона, разагилин, метаболизируется в 1 (р) -аминоиндан, не имеющий амфетаминоподобных свойств.[29]
Патч
После нанесения пластыря людям в среднем от 25% до 30% содержания селегилина системно доставляется в течение 24 часов. Трансдермальное дозирование приводит к значительно более высокому воздействию селегилина и более низкому воздействию всех метаболитов по сравнению с пероральным приемом; это происходит из-за обширного метаболизма первого прохождения формы таблетки и низкого метаболизма первого прохождения формы пластыря. Место применения не является существенным фактором в распределении препарата. У человека селегилин не накапливается в коже и там не метаболизируется.[7]
Химия
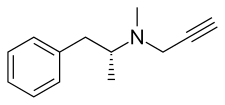
Селегилин принадлежит к фенэтиламин и амфетамин химические семейства. Он также известен как L-депренил, а также (р)-(–)-N, α-диметил-N- (2-пропинил) фенэтиламин или (р)-(–)-N-метил-N-2-пропиниламфетамин. Состав представляет собой производная из левометамфетамин (L-метамфетамин) с пропаргил группа прикреплен к азот атом. Эта деталь заимствована из паргилин, более старый ингибитор MAO-B группы фенэтиламина.[30] Селегилин - это левовращающий энантиомер из рацемическая смесь депренил.
Селегилин синтезируется алкилирование из (-) - метамфетамина с использованием пропаргил бромид.[31][32][33][34]
Другим клинически используемым ИМАО класса амфетаминов является транилципромин.
История
После открытия, что туберкулез препарат, средство, медикамент ипрониазид подняло настроение людей, принимающих его, и последующее открытие, что эффект, вероятно, был вызван ингибированием МАО, многие люди и компании начали пытаться найти ингибиторы МАО для использования в качестве антидепрессантов. Селегилин был обнаружен Золтаном Эксери в венгерской фармацевтической компании Chinoin (часть Санофи с 1993 г.),[35] который они назвали Е-250.[36]:66–67 Хиноин получил патент на лекарство в 1962 году, и это соединение было впервые опубликовано в научной литературе на английском языке в 1965 году.[36]:67[37] Работа над биологией и воздействием E-250 на животных и людей проводилась группой под руководством Йожефа Кнолля в Университет Земмельвейса который также был в Будапешт.[36]:67
Депренил - это рацемическое соединение, представляющее собой смесь двух изомеров, называемых энантиомеры. Дальнейшая работа определила, что левовращающий энантиомер был более мощным ингибитором МАО, который был опубликован в 1967 году, и последующая работа была проведена с единственным энантиомером L-депренил.[36]:67[38][39]
В 1971 году Кнолль показал, что селегилин избирательно ингибирует B-изоформу моноаминоксидазы (MAO-B), и предположил, что он вряд ли вызовет печально известный «сырный эффект» (гипертонический криз в результате потребления продукты, содержащие тирамин), что происходит с неселективными ингибиторами МАО. Несколько лет спустя два исследователя болезни Паркинсона из Вены, Питер Ридерер и Вальтер Биркмайер, осознали, что селегилин может быть полезен при болезни Паркинсона. Один из их коллег, проф. Мусса Б.Х. Youdim, посетил Кнолля в Будапеште и взял у него селегилин в Вену. В 1975 году группа Биркмайера опубликовала первую статью о влиянии селегилина на болезнь Паркинсона.[39][40]
В 1970-х годах было предположение, что это может быть полезно в качестве против старения наркотик или афродизиак.[41]
В 1987 г. компания Somerset Pharmaceuticals в Нью-Джерси, которая приобрела права США на разработку селегилина, подала применение нового препарата (NDA) с FDA продавать препарат от болезни Паркинсона в США.[42] Пока NDA находилось на рассмотрении, Somerset была приобретена в рамках совместного предприятия двумя компаниями-производителями дженериков. Mylan и Bolan Pharmaceuticals.[42] Селегилин был одобрен FDA для лечения болезни Паркинсона в 1989 году.[42]
В 1990-е годы Я. Александр Бодкин на Больница Маклин, филиал Гарвардская медицинская школа, начал сотрудничество с Somerset по разработке доставки селегилина через трансдермальный пластырь, чтобы избежать хорошо известных диетические ограничения ингибиторов МАО.[41][43][44] Somerset получил одобрение FDA на продажу пластыря в 2006 году.[45]
Общество и культура
В E для экстази (книга, в которой исследуется использование уличных наркотиков экстаз в Великобритании) писатель, активист и защитник экстази Николас Сондерс подчеркнули результаты испытаний, показывающие, что в некоторых партиях препарата также содержится селегилин.[46] Партии экстази, известные как «Клубника», содержали то, что Сондерс описал как «потенциально опасную комбинацию кетамин, эфедрин и селегилин », равно как и партия таблеток экстази« Сидящая утка ».[47]
Дэвид Пирс написал Гедонистический императив[48] через шесть недель после начала приема селегилина.[49]
В Грегг Гурвицроман Из темноты,[50] селегилин (Эмсам) и тирамин-содержащая пища использовались для убийства президента Соединенных Штатов.
Ветеринарное использование
В Ветеринария, селегилин продается под торговой маркой Аниприл (производитель Зоэтис). Он используется в собаки лечить когнитивная дисфункция у собак и, в более высоких дозах, гипофиз-зависимый гиперадренокортицизм (PDH).[51][52] Когнитивная дисфункция собак - это форма деменции, имитирующая болезнь Альцгеймера у людей. У гериатрических собак, получавших селегилин, наблюдается улучшение режима сна, снижение недержания мочи и повышение уровня активности; большинство показывает улучшения к одному месяцу.[53][54] Хотя он предназначен только для собак, селегилин использовался не по назначению для гериатрических заболеваний. кошки с когнитивной дисфункцией.[55]
Эффективность селегилина при лечении гипофизарно-зависимого гиперадренокортицизма оспаривается.[51] Теоретически он работает за счет увеличения уровня дофамина, который подавляет высвобождение АКТГ, что в конечном итоге приводит к снижению уровня кортизол.[55] Некоторые утверждают, что селегилин эффективен только при лечении ПДГ, вызванного: поражения в передний гипофиз (которые составляют большинство собачьих случаев).[56] Самый большой признак улучшения - уменьшение вздутие живота.[53]
Побочные эффекты у собак встречаются нечасто, но они включают рвоту, диарею, снижение слуха, слюноотделение, снижение веса и поведенческие изменения, такие как гиперактивность, вялость, дезориентация, и повторяющиеся движения.[52][56]
Селегилин не оказывает клинического воздействия на лошади.[56]
использованная литература
- ^ а б c d е ж г «Селегилин». Drugs.com. Получено 7 февраля, 2016.
- ^ а б c d е Селегилин пероральная этикетка. Обновлено 31 декабря 2008 г.
- ^ Ридерер П., Лахенмайер Л., Лаукс Г. (август 2004 г.). «Клиническое применение ингибиторов МАО». Современная лекарственная химия. 11 (15): 2033–43. Дои:10.2174/0929867043364775. PMID 15279566.
- ^ а б c d «Монография селегилина гидрохлорида для профессионалов». Drugs.com. Получено 23 февраля, 2018.
- ^ а б Ives NJ, Stowe RL, Marro J, Counsell C, Macleod A, Clarke CE, et al. (Сентябрь 2004 г.). «Ингибиторы моноаминоксидазы типа B на ранних стадиях болезни Паркинсона: метаанализ 17 рандомизированных исследований с участием 3525 пациентов». BMJ. 329 (7466): 593. Дои:10.1136 / bmj.38184.606169.AE. ЧВК 516655. PMID 15310558.
- ^ Ридерер П., Лахенмайер Л. (ноябрь 2003 г.). «Пересмотр нейропротекторной способности селегилина». Журнал нейронной передачи. 110 (11): 1273–8. Дои:10.1007 / s00702-003-0083-x. PMID 14628191. S2CID 20232921.
- ^ а б c d е ж г час Этикетка Emsam Последнее обновление: сентябрь 2014 г. Индексная страница в FDA
- ^ а б c d е Citrome L, Goldberg JF, Portland KB (ноябрь 2013 г.). «Включение трансдермального селегилина для лечения большого депрессивного расстройства в клинический контекст: количество, необходимое для лечения, количество, необходимое для нанесения вреда, и вероятность получения помощи или вреда». Журнал аффективных расстройств. 151 (2): 409–17. Дои:10.1016 / j.jad.2013.06.027. PMID 23890583.
- ^ Мур, JJ; Саадабади, А (январь 2020 г.). «Селегилин». PMID 30252350. Цитировать журнал требует
| журнал =(Помогите) - ^ Фридман Р.А., Леон А.С. (июнь 2007 г.). «Расширение черного ящика - депрессия, антидепрессанты и риск суицида». Медицинский журнал Новой Англии. 356 (23): 2343–6. Дои:10.1056 / NEJMp078015. PMID 17485726.
- ^ а б c Heinonen EH, Myllylä V (июль 1998 г.). «Безопасность селегилина (депренила) при лечении болезни Паркинсона». Безопасность лекарств. 19 (1): 11–22. Дои:10.2165/00002018-199819010-00002. PMID 9673855. S2CID 9632549.
- ^ Csoti I, Storch A, Müller W, Jost WH (1 декабря 2012 г.). «Лекарственное взаимодействие с селегилином по сравнению с разагилином». Базальный ганглий. Ингибиторы моноаминоксидазы B. 2 (4, Приложение): S27 – S31. Дои:10.1016 / j.baga.2012.06.003. ISSN 2210-5336.
- ^ Гиллман П.К. (октябрь 2005 г.). «Ингибиторы моноаминоксидазы, опиоидные анальгетики и токсичность серотонина». Британский журнал анестезии. 95 (4): 434–41. Дои:10.1093 / bja / aei210. PMID 16051647.
- ^ а б Лайне К., Анттила М., Хелминен А., Карнани Х., Хуппонен Р. (март 1999 г.). «Исследование линейности доз фармакокинетики селегилина после перорального приема: доказательства сильного лекарственного взаимодействия с женскими половыми стероидами». Британский журнал клинической фармакологии. 47 (3): 249–54. Дои:10.1046 / j.1365-2125.1999.00891.x. ЧВК 2014223. PMID 10215747.
- ^ Джессен Л., Ковалик Л.Дж., Аззаро А.Дж. (апрель 2008 г.). «Трансдермальная система селегилина (эмсам): терапевтический вариант для лечения большого депрессивного расстройства». P&T. 33 (4): 212–46. ЧВК 2730099. PMID 19750165.
- ^ а б Фактор SA, Вайнер В. (2007). Болезнь Паркинсона: диагностика и клиническое лечение (2-е изд.). Demos Medical Publishing. С. 503, 505. ISBN 978-1-934559-87-1.
- ^ а б Кацунг Б.Г. (2004). Фундаментальная и клиническая фармакология (9-е изд.). Медицинские книги Ланге / Макгроу Хилл. стр.453. ISBN 978-0-07-141092-2.
- ^ Siu EC, Tyndale RF (март 2008 г.). «Селегилин - это инактиватор CYP2A6 на основе механизма, ингибирующий метаболизм никотина у людей и мышей». Журнал фармакологии и экспериментальной терапии. 324 (3): 992–9. Дои:10.1124 / jpet.107.133900. PMID 18065502.
- ^ Ицхак Y (1994). Сигма рецепторы. Академическая пресса. п. 84. ISBN 978-0-12-376350-1.
- ^ Камень TW (1993). Ацетилхолин, сигма-рецепторы, ХЦК и эйкозаноиды, нейротоксины. Тейлор и Фрэнсис. п. 124. ISBN 978-0-7484-0063-8.
- ^ Barrett JS, Szego P, Rohatagi S, Morales RJ, De Witt KE, Rajewski G, Ireland J (октябрь 1996 г.). «Абсорбция и пресистемный метаболизм селегилина гидрохлорида в различных областях желудочно-кишечного тракта у здоровых мужчин». Фармацевтические исследования. 13 (10): 1535–40. Дои:10.1023 / А: 1016035730754. PMID 8899847. S2CID 24654277.
- ^ Кларк А., Брюэр Ф., Джонсон Е.С., Маллард Н., Хартиг Ф., Тейлор С., Корн TH (ноябрь 2003 г.). «Новый состав селегилина: улучшенная биодоступность и селективность ингибирования МАО-В». Журнал нейронной передачи. 110 (11): 1241–55. Дои:10.1007 / s00702-003-0036-4. PMID 14628189. S2CID 711419.
- ^ Энгберг Г., Элебринг Т., Ниссбрандт Н. (ноябрь 1991 г.). «Депренил (селегилин), селективный ингибитор МАО-В с активными метаболитами; влияние на двигательную активность, дофаминергическую нейротрансмиссию и скорость возбуждения нигральных дофаминовых нейронов». Журнал фармакологии и экспериментальной терапии. 259 (2): 841–7. PMID 1658311.
- ^ а б Лемке Т.Л., Уильямс Д.А., ред. (2012). Принципы медицинской химии Фуа. Липпинкотт Уильямс и Уилкинс. п. 434. ISBN 978-1609133450.
- ^ Таавицайнен П., Анттила М., Нюман Л., Карнани Х., Салонен Дж. С., Пелконен О. (май 2000 г.). «Метаболизм селегилина и ферменты цитохрома Р450: исследование in vitro на микросомах печени человека». Фармакология и токсикология. 86 (5): 215–21. Дои:10.1034 / j.1600-0773.2000.pto860504.x. PMID 10862503.
- ^ Ромберг Р. У., Нидлман С. Б., Снайдер Дж. Дж., Гридан А (ноябрь 1995 г.). «Метамфетамин и амфетамин, полученные в результате метаболизма селегилина». Журнал судебной медицины. 40 (6): 1100–2. Дои:10.1520 / JFS13885J. PMID 8522918.
- ^ Bar Am O, Amit T, Youdim MB (январь 2004 г.). «Противоположное нейропротекторное и нейротоксическое действие соответствующих метаболитов антипаркинсонических препаратов разагилина и селегилина». Письма о неврологии. 355 (3): 169–72. Дои:10.1016 / j.neulet.2003.10.067. PMID 14732458. S2CID 20471004.
- ^ Ясар С., Гольдберг Дж. П., Голдберг С. Р. (1 января 1996 г.). «Полезны или вредны метаболиты l-депренила (селегилина)? Показания доклинических исследований». Журнал нейронной передачи. Дополнение. 48: 61–73. Дои:10.1007/978-3-7091-7494-4_6. ISBN 978-3-211-82891-5. PMID 8988462.
- ^ Chen JJ, Swope DM (август 2005 г.). «Клиническая фармакология разагилина: новый пропаргиламин второго поколения для лечения болезни Паркинсона». Журнал клинической фармакологии. 45 (8): 878–94. Дои:10.1177/0091270005277935. PMID 16027398. S2CID 24350277. Архивировано из оригинал 11 июля 2012 г.
- ^ Микля I (13 марта 2014 г.). «История селегилина / (-) - депренила, первого селективного ингибитора моноаминоксидазы B-типа и первого синтетического вещества, усиливающего катехоламинергическую активность». Международная сеть по истории нейропсихофармакологии. Получено 7 января, 2016.
- ^ Дж. Нолл, Э. Санфай, DE 1568277 (1966).
- ^ J. Hermann Nee Voeroes, Z. Ecsery, G. Sabo, L. Arvai, L. Nagi, O. Orban, E. Sanfai, Патент США 4564706 (1986)
- ^ Б. Брунова, М. Ференц, EP 344675 (1989)
- ^ Фаулер Дж. С. (июль 1977 г.). «2-Метил-3-бутин-2-ол как предшественник ацетилена в реакции Манниха. Новый синтез суицидных инактиваторов моноаминоксидазы». Журнал органической химии. 42 (15): 2637–7. Дои:10.1021 / jo00435a026. PMID 874623.
- ^ «Санофи расширяет холдинг в Чиноине». Фармацевтическое письмо. 19 сентября 1993 г.
- ^ а б c d Мадьяр К (2011). «Фармакология селегилина». В Youdim M, Riederer P (ред.). Моноаминоксидазы и их ингибиторы. Международный обзор нейробиологии. 100. Академическая пресса. ISBN 978-0-12-386468-0.
- ^ Knoll J, Ecseri Z, Kelemen K, Nievel J, Knoll B (май 1965 г.). «Фенилизопропилметилпропиниламин (Е-250), психический энергетик нового спектра». Archives Internationales de Pharmacodynamie et de Therapie. 155 (1): 154–64. PMID 4378644.
- ^ Magyar K, Vizi ES, Ecseri Z, Knoll J (1967). «Сравнительный фармакологический анализ оптических изомеров фенилизопропилметилпропиниламина (Е-250)». Acta Physiologica Academiae Scientiarum Hungaricae. 32 (4): 377–87. PMID 5595908.
- ^ а б Хили Д (2000). «Психофармакология жизни и смерти. Интервью с Джозефом Ноллом». Психофармакологи, Vol. III: Интервью. Лондон: Арнольд. С. 81–110. ISBN 978-0-340-76110-6.
- ^ Биркмайер В., Ридерер П., Юдим МБ, Линауэр В. (1975). «Усиление антиакинетического эффекта после лечения L-допа ингибитором МАО-B Депренилом». Журнал нейронной передачи. 36 (3–4): 303–26. Дои:10.1007 / BF01253131. PMID 1172524. S2CID 38179089. Архивировано из оригинал 12 февраля 2013 г.
- ^ а б Кроми WJ (7 ноября 2002 г.). «Бодкин лечит депрессию». Вестник Гарвардского университета. Получено 8 сентября, 2007.
- ^ а б c Матрос Дж. Т., Ландри Дж. Т. (2011). Милан: 50 лет нетрадиционного успеха: сделать качественную медицину доступной и доступной. Университетское издательство Новой Англии. п. 50. ISBN 978-1-61168-269-4.
- ^ Фрэмптон Дж. Э., Плоскер Г. Л. (2007). «Трансдермальная система селегилин: в лечении большого депрессивного расстройства». Наркотики. 67 (2): 257–65, обсуждение 266–7. Дои:10.2165/00003495-200767020-00006. PMID 17284087. S2CID 42425086.
- ^ Даффи М. (3 декабря 2002 г.). «Патч вселяет новую надежду на победу над депрессией». Нью-Йорк Таймс. ISSN 0362-4331.
- ^ Cascade EF, Kalali AH, Preskorn SH (июнь 2007 г.). «Эмсам: первый год». Психиатрия. 4 (6): 19–21. ЧВК 2921248. PMID 20711332.
- ^ Сондерс Н., Херон Л. (1993). E для экстази. Лондон: Н. Сондерс. ISBN 978-0-9501628-8-1. OCLC 29388575.[страница нужна]
- ^ Сондерс Н. «Результаты испытаний 30 образцов экстази, купленных в британских клубах с 11/94 по 7/95».
- ^ Пирс, Дэвид (1995). Гедонистический императив. OCLC 44325836.
- ^ "Сэм Баркер и Дэвид Пирс об искусстве, райском строительстве и экзистенциальной надежде (с гостевым миксом) | Подкаст FLI". Институт будущего жизни (аудио, стенограмма). 24 июня 2020 г.
- ^ Гурвиц, Грегг (2019). Из темноты. п. 431. ISBN 9780718185480.
- ^ а б Брэддок Дж. А., Church DB, Robertson ID (2004). «Селегилин для лечения гипофизозависимого гиперадренокортицизма собак» (PDF). Австралийский ветеринарный журнал. Архивировано из оригинал (PDF) 29 ноября 2010 г.. Получено 8 апреля, 2011. (PDF)
- ^ а б Eghianruwa K (2014). Основные данные о лекарственных средствах для рациональной терапии в ветеринарной практике. АвторДом. С. 127–128. ISBN 978-1-4918-0010-2.
- ^ а б «Аниприл в таблетках для животных». Drugs.com. Получено 31 августа, 2017.
- ^ Лундгрен Б. «Когнитивная дисфункция у собак». Ветеринарный партнер. Получено 8 апреля, 2011.
- ^ а б Ривьер Дж. Э., Папич М. Г. (2013). Ветеринарная фармакология и терапия. Джон Вили и сыновья. п. 530. ISBN 978-1-118-68590-7.
- ^ а б c Папич М.Г. (2015). Справочник Сондерса по ветеринарным препаратам: мелкие и крупные животные. Elsevier Health Sciences. п. 722. ISBN 978-0-323-24485-5.

