WikiDer > Фермент расщепления боковой цепи холестерина
Фермент расщепления боковой цепи холестерина обычно называют P450scc, где "scc" - это аббревиатура от боковая цепь расщепление. P450scc - это митохондриальный фермент который катализирует конверсию холестерин к прегненолон. Это первая реакция в процессе стероидогенеза во всех тканях млекопитающих, которые специализируются на производстве различных стероидных гормонов.[4]
P450scc является членом цитохром P450 суперсемейство ферментов (семейство 11, подсемейство A, полипептид 1). В ген имя CYP11A1.[5]
Номенклатура
| холестерин монооксигеназа (расщепление боковой цепи) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 1.14.15.6 | ||||||||
| Количество CAS | 37292-81-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
В систематическое название этого класса ферментов холестерин, восстановленный ферредоксин надпочечников: оксидоредуктаза кислорода (расщепление боковой цепи). Другие названия включают:
|
Тканевая и внутриклеточная локализация
Самый высокий уровень системы расщепления боковой цепи холестерина обнаружен в коре надпочечников и желтом теле.[4] Система также экспрессируется на высоком уровне в стероидогенных клетках теки яичника и клетках Лейдига в семенниках.[4] Во время беременности плацента также экспрессирует значительные уровни этой ферментной системы.[6] P450scc также присутствует в гораздо меньших количествах в нескольких других типах тканей, включая мозг.[7] В коре надпочечников концентрация адренодоксина аналогична концентрации P450scc, но адренодоксинредуктаза экспрессируется на более низких уровнях.[8]
Исследования иммунофлуоресценции с использованием специфических антител против ферментов системы P450scc продемонстрировали, что белки расположены исключительно в митохондриях.[9][10] P450scc связан с внутренняя митохондриальная мембрана, обращенные внутрь (матрица).[11][12] Адренодоксин и адренодоксинредуктаза растворимы белки периферической мембраны расположены внутри митохондриального матрикса, которые, по-видимому, связаны друг с другом в основном за счет электростатических взаимодействий.[13]
Механизм действия
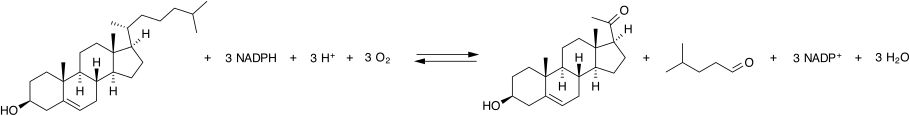
P450scc катализирует превращение холестерина в прегненолон в трех монооксигеназных реакциях. Они включают 2 гидроксилирование боковой цепи холестерина, которые генерируют сначала 22R-гидроксихолестерин, а затем 20альфа, 22R-дигидроксихолестерин. На последнем этапе происходит разрыв связи между атомами углерода 20 и 22, в результате чего получают прегненолон и изокапроновый альдегид.
На каждый шаг монооксигеназы требуется 2 электроны (уменьшающие эквиваленты). Первоначальный источник электронов - НАДФН.[14] Электроны передаются от НАДФН к P450scc через два белка переноса электронов: адренодоксинредуктаза[15] и адренодоксин.[16][17] Все три белка вместе составляют комплекс расщепления холестериновой боковой цепи.
Участие трех белков в реакции расщепления боковой цепи холестерина поднимает вопрос о том, функционируют ли эти три белка как тройной комплекс как редуктаза: адренодоксин: P450. Как спектроскопические исследования связывания адренодоксина с P450scc, так и кинетические исследования в присутствии различных концентраций адренодоксинредуктазы продемонстрировали, что редуктаза конкурирует с P450scc за связывание с адренодоксином. Эти результаты продемонстрировали, что образование функционального тройного комплекса невозможно.[16] Из этих исследований был сделан вывод, что сайты связывания адренодоксина с его редуктазой и с P450 перекрываются, и, как следствие, адренодоксин действует как мобильный электронный челнок между редуктазой и P450.[16] Эти выводы были подтверждены структурным анализом адренодоксина и комплекса P450.[18]
Процесс переноса электронов от НАДФН к P450scc не сильно связан; то есть во время переноса электрона от адренодоксинредуктазы через адренодоксин к P450scc определенная часть электронов утекает за пределы цепи и реагирует с O2, генерируя супероксидные радикалы.[19] Стероидогенные клетки включают в себя широкий спектр антиоксидантных систем, способных справиться с радикалами, генерируемыми стероидогенными ферментами.[20]
Регулирование
В каждой стероидогенной клетке экспрессия белков системы P450scc регулируется трофической гормональной системой, специфичной для данного типа клетки.[4] В клетках коры надпочечников из зоны фасцикулята экспрессия мРНК, кодирующих все три белка P450scc, индуцируется кортикотропин (АКТГ).[10][21] Трофические гормоны увеличивают CYP11A1 экспрессия гена через факторы транскрипции Такие как стероидогенный фактор 1 (SF-1) α-изоформой активирующий белок 2 (AP-2) в человеке и многие другие.[21][22] Производство этого фермента заметно подавляется ядерный рецептор DAX-1.[21]
P450scc всегда активен, однако его активность ограничена поступлением холестерина во внутреннюю мембрану. Доставка холестерина к этой мембране (от внешняя митохондриальная мембрана), таким образом, считается истинным ограничивающий шаг в производстве стероидов. Этот шаг опосредуется прежде всего стероидогенный белок острой регуляции (ЗВЕЗДА или ЗВЕЗДА1). При стимуляции клетки производить стероид количество StAR, доступное для переноса холестерина на внутреннюю мембрану, ограничивает скорость реакции (острая фаза). Считается, что при длительной (хронической) стимуляции поставка холестерина больше не является проблемой и что способность системы вырабатывать стероиды (то есть уровень P450scc в митохондриях) становится более важной.
Кортикотропин (АКТГ) - это гормон, который выделяется из передний гипофиз в ответ на стрессовые ситуации. Изучение стероидогенной способности коры надпочечников у младенцев с острым респираторным заболеванием продемонстрировало, что действительно во время болезненного состояния наблюдается специфическое увеличение стероидогенной способности синтеза глюкокортикоидного кортизола, но не секретируемого минералокортикоидного альдостерона или андрогена DHEAS из других зон коры надпочечников.[23]
Патология
Мутации в гене CYP11A1 приводят к дефициту стероидных гормонов, вызывая меньшее количество случаев редких и потенциально смертельных состояний. липоидная врожденная гиперплазия надпочечников.[24][25][26]
Смотрите также
Рекомендации
- ^ а б c ENSG00000288362 GRCh38: Ensembl release 89: ENSG00000140459, ENSG00000288362 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c d Ханукоглу I (декабрь 1992 г.). «Стероидогенные ферменты: структура, функция и роль в регуляции биосинтеза стероидных гормонов». Журнал стероидной биохимии и молекулярной биологии. 43 (8): 779–804. Дои:10.1016/0960-0760(92)90307-5. PMID 22217824.
- ^ «Ген Entrez: цитохром P450 CYP11A1, семейство 11, подсемейство A, полипептид 1».
- ^ Штраус Дж. Ф., Мартинес Ф., Кириакиду М. (февраль 1996 г.). «Синтез плацентарных стероидных гормонов: уникальные особенности и вопросы без ответов». Биология размножения. 54 (2): 303–11. Дои:10.1095 / биолрепрод54.2.303. PMID 8788180.
- ^ Стоффель-Вагнер Б (декабрь 2001 г.). «Метаболизм нейростероидов в мозге человека». Европейский журнал эндокринологии. 145 (6): 669–79. Дои:10.1530 / eje.0.1450669. PMID 11720889.
- ^ Ханукоглу I, Ханукоглу З. (май 1986 г.). «Стехиометрия митохондриальных цитохромов P-450, адренодоксина и адренодоксинредуктазы в коре надпочечников и желтом теле. Значение для мембранной организации и регуляции генов». Европейский журнал биохимии. 157 (1): 27–31. Дои:10.1111 / j.1432-1033.1986.tb09633.x. PMID 3011431.
- ^ Hanukoglu I, Suh BS, Himmelhoch S, Amsterdam A (октябрь 1990 г.). «Индукция и митохондриальная локализация ферментов системы цитохрома P450scc в нормальных и трансформированных клетках гранулезы яичников». Журнал клеточной биологии. 111 (4): 1373–81. Дои:10.1083 / jcb.111.4.1373. ЧВК 2116250. PMID 2170421.
- ^ а б Ханукоглу I, Фейхтвангер Р., Ханукоглу А. (ноябрь 1990 г.). «Механизм индукции кортикотропином и цАМФ ферментов митохондриальной системы цитохрома Р450 в клетках коры надпочечников» (PDF). Журнал биологической химии. 265 (33): 20602–8. PMID 2173715.
- ^ Топологические исследования цитохромов P-450scc и P-45011 beta в адренокортикальных внутренних митохондриальных мембранах коров быка. Эффекты контролируемого триптического пищеварения. J. Biol. Chem. 1979 254: 10443-8.
- ^ Фаркаш Ю., Тимберг Р., Орли Дж. (Апрель 1986 г.). «Приготовление антисыворотки к расщеплению боковой цепи холестерина цитохрома Р-450 крысы и ее использование для ультраструктурной локализации иммунореактивного фермента методом протеина А-золота». Эндокринология. 118 (4): 1353–65. Дои:10.1210 / эндо-118-4-1353. PMID 3948785.
- ^ Ханукоглу И., Привалле, CT, Джефкоат ЧР (май 1981 г.). «Механизмы ионной активации цитохромов митохондрий надпочечников P-450scc и P-45011 beta». Журнал биологической химии. 256 (9): 4329–35. PMID 6783659.
- ^ Ханукоглу И., Рапопорт Р. (1995). «Пути и регуляция продукции НАДФН в стероидогенных митохондриях». Эндокринные исследования. 21 (1–2): 231–41. Дои:10.3109/07435809509030439. PMID 7588385.
- ^ Ханукоглу И., Гутфингер Т., Ханю М., Шивели Дж. Э. (декабрь 1987 г.). «Выделение кДНК для адренодоксинредуктазы (ферредоксин-НАДФ + редуктаза). Значение для митохондриальных систем цитохрома Р-450». Европейский журнал биохимии. 169 (3): 449–455. Дои:10.1111 / j.1432-1033.1987.tb13632.x. PMID 3691502.
- ^ а б c Ханукоглу И., Джефкоат ЧР (апрель 1980 г.). «Митохондриальный цитохром P-450scc. Механизм переноса электронов адренодоксином». Журнал биологической химии. 255 (7): 3057–61. PMID 6766943.
- ^ Ханукоглу И., Спицберг В., Бампус Дж. А., Дус К. М., Джефкоат С. Р. (май 1981 г.). «Митохондриальный цитохром P-450scc надпочечников. Взаимодействие холестерина и адренодоксина в равновесии и во время обмена». Журнал биологической химии. 256 (9): 4321–8. PMID 7217084.
- ^ Струшкевич Н., Маккензи Ф, Черкесова Т., Грабовец И., Усанов С., Park HW (июнь 2011 г.). «Структурные основы биосинтеза прегненолона митохондриальной монооксигеназной системой». Труды Национальной академии наук Соединенных Штатов Америки. 108 (25): 10139–43. Дои:10.1073 / pnas.1019441108. ЧВК 3121847. PMID 21636783.
- ^ Ханукоглу И., Рапопорт Р., Вайнер Л., Склан Д. (сентябрь 1993 г.). «Утечка электронов из митохондриальной системы НАДФН-адренодоксинредуктаза-адренодоксин-P450scc (расщепление боковой цепи холестерина)». Архивы биохимии и биофизики. 305 (2): 489–98. Дои:10.1006 / abbi.1993.1452. PMID 8396893.
- ^ Ханукоглу I (2006). «Антиоксидантные защитные механизмы против активных форм кислорода (АФК), генерируемых митохондриальными системами P450 в стероидогенных клетках». Обзоры метаболизма лекарств. 38 (1–2): 171–96. Дои:10.1080/03602530600570040. PMID 16684656.
- ^ а б c Лавуа Х.А., король SR (август 2009 г.). «Регуляция транскрипции стероидогенных генов: STARD1, CYP11A1 и HSD3B». Экспериментальная биология и медицина. 234 (8): 880–907. Дои:10.3181 / 0903-MR-97. PMID 19491374.
- ^ Guo IC, Shih MC, Lan HC, Hsu NC, Hu MC, Chung BC (июль 2007 г.). «Регуляция транскрипции человеческого CYP11A1 в гонадах и надпочечниках». Журнал биомедицинских наук. 14 (4): 509–15. Дои:10.1007 / s11373-007-9177-z. PMID 17594537.
- ^ Ханукоглу А., Фрид Д., Накаш И., Ханукоглу И. (ноябрь 1995 г.). «Избирательное повышение стероидогенной способности надпочечников во время острых респираторных заболеваний у младенцев». Европейский журнал эндокринологии. 133 (5): 552–6. Дои:10.1530 / eje.0.1330552. PMID 7581984.
- ^ Bhangoo A, Anhalt H, Ten S, King SR (март 2006 г.). «Фенотипические вариации липоидной врожденной гиперплазии надпочечников». Обзоры детской эндокринологии. 3 (3): 258–71. PMID 16639391.
- ^ аль Кандари Х., Кацумата Н., Александр С., Расул М.А. (август 2006 г.). «Гомозиготная мутация гена фермента расщепления боковой цепи P450 (CYP11A1) у 46, XY пациента с надпочечниковой недостаточностью, полным изменением пола и агенезом мозолистого тела». Журнал клинической эндокринологии и метаболизма. 91 (8): 2821–6. Дои:10.1210 / jc.2005-2230. PMID 16705068.
- ^ Ким CJ, Лин Л., Хуанг Н., Куигли CA, АвРускин Т.В., Achermann JC, Миллер В.Л. (март 2008 г.). «Тяжелая комбинированная недостаточность надпочечников и гонад, вызванная новыми мутациями фермента расщепления боковой цепи холестерина, P450scc». Журнал клинической эндокринологии и метаболизма. 93 (3): 696–702. Дои:10.1210 / jc.2007-2330. ЧВК 2266942. PMID 18182448.
дальнейшее чтение
- Хельмберг А. (август 1993 г.). «Гены-близнецы и эндокринные заболевания: гены CYP21 и CYP11B». Acta Endocrinologica. 129 (2): 97–108. Дои:10.1530 / acta.0.1290097. PMID 8372604.
- Пападопулос В., Амри Х., Бужрад Н., Кашио С., Культи М., Гарнье М., Хардвик М., Ли Х., Видич Б., Браун А.С., Реверса Дж. Л., Бернассау Дж. М., Дриё К. (январь 1997 г.). «Периферический бензодиазепиновый рецептор в транспорте холестерина и стероидогенезе». Стероиды. 62 (1): 21–8. Дои:10.1016 / S0039-128X (96) 00154-7. PMID 9029710.
- Stocco DM (июнь 2000 г.). «Внутримитохондриальный перенос холестерина». Biochimica et Biophysica Acta (BBA) - Молекулярная и клеточная биология липидов. 1486 (1): 184–97. Дои:10.1016 / S1388-1981 (00) 00056-1. PMID 10856721.
- Кристенсен В.Н., Куре Э.Х., Эрикштейн Б., Харада Н., Бёрресен-Дейл А. (октябрь 2001 г.). «Генетическая предрасположенность и экологические эстрогеноподобные соединения». Мутационные исследования. 482 (1–2): 77–82. Дои:10.1016 / S0027-5107 (01) 00212-3. PMID 11535251.
- Штраус Дж. Ф. (ноябрь 2003 г.). «Некоторые новые мысли о патофизиологии и генетике синдрома поликистозных яичников». Летопись Нью-Йоркской академии наук. 997 (1): 42–8. Дои:10.1196 / анналы.1290.005. PMID 14644808.
- Wada A, Waterman MR (ноябрь 1992 г.). «Идентификация посредством сайт-направленного мутагенеза двух остатков лизина в цитохроме P450, расщепляющего боковую цепь холестерина, которые необходимы для связывания адренодоксина». Журнал биологической химии. 267 (32): 22877–82. PMID 1429635.
- Ху MC, Го IC, Линь Дж. Х., Чжун BC (март 1991 г.). «Регулируемая экспрессия цитохрома P-450scc (фермент расщепления холестериновой боковой цепи) в культивируемых клеточных линиях, обнаруживаемых антителом против бактериально экспрессируемого человеческого белка». Биохимический журнал. 274 (Пт 3): 813–7. Дои:10.1042 / bj2740813. ЧВК 1149983. PMID 1849407.
- Спаркс Р.С., Клисак И., Миллер В.Л. (июнь 1991 г.). «Региональное картирование генов, кодирующих человеческие стероидогенные ферменты: P450scc - 15q23-q24, адренодоксин - 11q22; адренодоксинредуктаза - 17q24-q25; и P450c17 - 10q24-q25». ДНК и клеточная биология. 10 (5): 359–65. Дои:10.1089 / dna.1991.10.359. PMID 1863359.
- Коглан В.М., Викери Л.Е. (октябрь 1991 г.). «Сайт-специфические мутации в ферредоксине человека, которые влияют на связывание ферредоксинредуктазы и цитохрома P450scc». Журнал биологической химии. 266 (28): 18606–12. PMID 1917982.
- Matteson KJ, Chung BC, Urdea MS, Miller WL (апрель 1986 г.). «Изучение дефицита расщепления боковой цепи холестерина (20,22 десмолазы), вызывающего врожденную липоидную гиперплазию надпочечников, с использованием олигодезоксирибонуклеотидных зондов с бычьей последовательностью P450scc». Эндокринология. 118 (4): 1296–305. Дои:10.1210 / эндо-118-4-1296. PMID 2419119.
- Чунг BC, Маттесон К.Дж., Воутилайнен Р., Мохандас Т.К., Миллер В.Л. (декабрь 1986 г.). «Фермент расщепления боковой цепи холестерина человека, P450scc: клонирование кДНК, отнесение гена к хромосоме 15 и экспрессия в плаценте». Труды Национальной академии наук Соединенных Штатов Америки. 83 (23): 8962–6. Дои:10.1073 / пнас.83.23.8962. ЧВК 387054. PMID 3024157.
- Морохаши К., Согава К., Омура Т., Фудзи-Курияма Ю. (апрель 1987 г.). «Генная структура человеческого цитохрома P-450 (SCC), холестерин десмолаза». Журнал биохимии. 101 (4): 879–87. Дои:10.1093 / oxfordjournals.jbchem.a121955. PMID 3038854.
- Маруяма К., Сугано С. (январь 1994 г.). «Олиго-кэппинг: простой метод замены кэп-структуры эукариотических мРНК олигорибонуклеотидами». Ген. 138 (1–2): 171–4. Дои:10.1016/0378-1119(94)90802-8. PMID 8125298.
- Гарани Н., Уотеруорт Д.М., Бэтти С., Уайт Д., Джиллинг-Смит К., Конвей Г.С., Маккарти М., Фрэнкс С., Уильямсон Р. (март 1997 г.). «Ассоциация гена синтеза стероидов CYP11a с синдромом поликистозных яичников и гиперандрогенизмом». Молекулярная генетика человека. 6 (3): 397–402. Дои:10,1093 / hmg / 6.3.397. PMID 9147642.
- Судзуки Ю., Ёситомо-Накагава К., Маруяма К., Суяма А., Сугано С. (октябрь 1997 г.). «Создание и характеристика полноразмерной библиотеки кДНК, обогащенной по 5'-концу». Ген. 200 (1–2): 149–56. Дои:10.1016 / S0378-1119 (97) 00411-3. PMID 9373149.
- Хукканен Дж., Мянтюля М., Кангас Л., Вирта П., Хаккола Дж., Паакки П., Эвисалми С., Пелконен О., Раунио Х. (февраль 1998 г.). «Экспрессия генов цитохрома P450, кодирующих ферменты, активные в метаболизме тамоксифена в эндометрии матки человека». Фармакология и токсикология. 82 (2): 93–7. Дои:10.1111 / j.1600-0773.1998.tb01404.x. PMID 9498238.
- Zhou Z, Shackleton CH, Pahwa S, White PC, Speiser PW (март 1998 г.). «Выдающийся метаболизм половых стероидов в лимфоцитах человека». Молекулярная и клеточная эндокринология. 138 (1–2): 61–9. Дои:10.1016 / S0303-7207 (98) 00052-5. PMID 9685215.
Синтез стероидных гормонов

Дополнительные изображения
внешняя ссылка
- Цитохром + P450scc в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)