WikiDer > Железо - Википедия
 | |||||||||||||||||||||||||||||||||||||||||
| Утюг | |||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Внешность | блестящий металлик с сероватым оттенком | ||||||||||||||||||||||||||||||||||||||||
| Стандартный атомный вес Аг, стд(Fe) | 55.845(2)[1] | ||||||||||||||||||||||||||||||||||||||||
| Утюг в периодическая таблица | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Атомный номер (Z) | 26 | ||||||||||||||||||||||||||||||||||||||||
| Группа | группа 8 | ||||||||||||||||||||||||||||||||||||||||
| Период | период 4 | ||||||||||||||||||||||||||||||||||||||||
| Блокировать | d-блок | ||||||||||||||||||||||||||||||||||||||||
| Категория элемента | Переходный металл | ||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Ar] 3d6 4 с2 | ||||||||||||||||||||||||||||||||||||||||
| Электронов на оболочку | 2, 8, 14, 2 | ||||||||||||||||||||||||||||||||||||||||
| Физические свойства | |||||||||||||||||||||||||||||||||||||||||
| Фаза вSTP | твердый | ||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1811 K (1538 ° С, 2800 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Точка кипения | 3134 К (2862 ° С, 5182 ° F) | ||||||||||||||||||||||||||||||||||||||||
| Плотность (возлеr.t.) | 7,874 г / см3 | ||||||||||||||||||||||||||||||||||||||||
| в жидком состоянии (приm.p.) | 6,98 г / см3 | ||||||||||||||||||||||||||||||||||||||||
| Теплота плавления | 13.81 кДж / моль | ||||||||||||||||||||||||||||||||||||||||
| Теплота испарения | 340 кДж / моль | ||||||||||||||||||||||||||||||||||||||||
| Молярная теплоемкость | 25,10 Дж / (моль · К) | ||||||||||||||||||||||||||||||||||||||||
Давление газа
| |||||||||||||||||||||||||||||||||||||||||
| Атомные свойства | |||||||||||||||||||||||||||||||||||||||||
| Состояния окисления | −4, −2, −1, 0, +1,[2] +2, +3, +4, +5,[3] +6, +7[4] (анамфотерный окись) | ||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | Шкала Полинга: 1,83 | ||||||||||||||||||||||||||||||||||||||||
| Энергии ионизации |
| ||||||||||||||||||||||||||||||||||||||||
| Радиус атома | эмпирические: 126вечера | ||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | Низкое вращение: 132 ± 15:00 Высокий отжим: 152 ± 6 вечера | ||||||||||||||||||||||||||||||||||||||||
| Спектральные линии из железа | |||||||||||||||||||||||||||||||||||||||||
| Другие свойства | |||||||||||||||||||||||||||||||||||||||||
| Естественное явление | изначальный | ||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | объемно-центрированный кубический (скрытая копия) а= 286,65 вечера | ||||||||||||||||||||||||||||||||||||||||
| Кристальная структура | гранецентрированная кубическая (fcc) 1185–1667 К; а= 364,680 вечера | ||||||||||||||||||||||||||||||||||||||||
| Скорость звука тонкий стержень | 5120 м / с (приr.t.) (электролитический) | ||||||||||||||||||||||||||||||||||||||||
| Тепловое расширение | 11,8 мкм / (м · К) (при 25 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | 80,4 Вт / (м · К) | ||||||||||||||||||||||||||||||||||||||||
| Удельное электрическое сопротивление | 96,1 нОм · м (при 20 ° C) | ||||||||||||||||||||||||||||||||||||||||
| Точка Кюри | 1043 К | ||||||||||||||||||||||||||||||||||||||||
| Магнитный заказ | ферромагнитный | ||||||||||||||||||||||||||||||||||||||||
| Модуль для младших | 211 ГПа | ||||||||||||||||||||||||||||||||||||||||
| Модуль сдвига | 82 ГПа | ||||||||||||||||||||||||||||||||||||||||
| Объемный модуль | 170 ГПа | ||||||||||||||||||||||||||||||||||||||||
| коэффициент Пуассона | 0.29 | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Моосу | 4 | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Виккерсу | 608 МПа | ||||||||||||||||||||||||||||||||||||||||
| Твердость по Бринеллю | 200–1180 МПа | ||||||||||||||||||||||||||||||||||||||||
| Количество CAS | 7439-89-6 | ||||||||||||||||||||||||||||||||||||||||
| История | |||||||||||||||||||||||||||||||||||||||||
| Открытие | перед 5000 г. до н.э. | ||||||||||||||||||||||||||||||||||||||||
| Главный изотопы железа | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
Утюг (/ˈаɪərп/) это химический элемент с символ Fe (из латинский: железо) и атомный номер 26. Это металл что принадлежит первая переходная серия и группа 8 из периодическая таблица. это по массе самый распространенный элемент на земной шар, прямо перед кислород (32,1% и 30,1% соответственно), что составляет большую часть земных внешний и Внутреннее ядро. Это четвертый по распространенности элемент в земной коре.
В металлическом состоянии железо редко встречается в земной коры, ограничивается в основном осаждением метеориты. Железные руды, напротив, являются одними из самых распространенных в земной коре, хотя для извлечения из них пригодного для использования металла требуется печи или же печи может достигать 1500 ° C (2730 ° F) или выше, примерно на 500 ° C (900 ° F) выше, чем требуется для нюхать медь. Люди начали осваивать этот процесс в Евразия только около 2000 г. до н.э.,[не проверено в теле] и использование железа инструменты и оружие начал вытеснять медные сплавы, в некоторых регионах только около 1200 г. до н.э. Это событие считается переходом от Бронзовый век к Железный век. в современный мир, сплавы железа, такие как стали, нержавеющая сталь, чугун и специальные стали на сегодняшний день являются наиболее распространенными промышленными металлами из-за их механических свойств и низкой стоимости.
Безупречные и гладкие поверхности из чистого железа зеркально-серебристо-серые. Однако железо легко реагирует с кислород и воды придать коричневый цвет черному гидратированный оксиды железа, широко известный как ржавчина. В отличие от оксидов некоторых других металлов, которые образуют пассивирующий слоев ржавчина занимает больше объема, чем металл, и отслаивается, подвергая свежие поверхности коррозии.
В теле взрослого человека содержится около 4 г (0,005% веса тела) железа, в основном в гемоглобин и миоглобин. Эти двое белки играть важную роль в позвоночное животное метаболизм, соответственно кислородный транспорт к кровь и хранение кислорода в мышцы. Чтобы поддерживать необходимый уровень, метаболизм железа у человека требует в рационе минимум железа. Железо также является металлом в активной зоне многих важных редокс ферменты иметь дело с клеточное дыхание и окисление и восстановление у растений и животных.[5]
Химически наиболее распространенными состояниями окисления железа являются: железо (II) и железо (III). Железо имеет много общих свойств с другими переходные металлы, включая другие группа 8 элементов, рутений и осмий. Железо образует соединения в широком диапазоне состояния окисления, От −2 до +7. Железо также образует много координационные соединения; некоторые из них, такие как ферроцен, ферриоксалат, и Берлинская лазурь, имеют важные промышленные, медицинские или исследовательские приложения.
Характеристики
Аллотропы
Известно, по крайней мере, четыре аллотропа железа (отличающиеся расположением атомов в твердом теле), условно обозначаемые α, γ, δ и ε.

Первые три формы наблюдаются при обычных давлениях. Когда расплавленное железо охлаждается выше точки замерзания 1538 ° C, оно кристаллизуется в свой δ-аллотроп, который имеет объемно-центрированный кубический (скрытая копия) Кристальная структура. По мере охлаждения до 1394 ° C он превращается в аллотроп γ-железа, гранецентрированная кубическая (ГЦК) кристаллическая структура, или аустенит. При 912 ° C и ниже кристаллическая структура снова становится аллотропом ОЦК α-железа.[6]
Физические свойства железа при очень высоких давлениях и температурах также широко изучены.[7][8] из-за их отношения к теориям о ядрах Земли и других планет. Выше примерно 10 ГПа и температурах в несколько сотен градусов Кельвина или ниже α-железо превращается в другое. шестиугольный плотно упакованный (hcp) структура, также известная как ε-железо. Более высокотемпературная γ-фаза также превращается в ε-железо, но при более высоком давлении.
Существуют противоречивые экспериментальные данные о стабильной β-фазе при давлениях выше 50 ГПа и температурах не менее 1500 К. Предполагается, что она имеет ромбический или двойная ГПУ структура.[9] (Что сбивает с толку, термин «β-железо» иногда также используется для обозначения α-железа выше точки Кюри, когда оно меняется с ферромагнитного на парамагнитное, даже если его кристаллическая структура не изменилась.[6])
В Внутреннее ядро из земной шар обычно предполагается, что он состоит из железаникель сплав со структурой ε (или β).[10]
Точки плавления и кипения
Температуры плавления и кипения железа, а также его энтальпия распыления, ниже, чем у более ранних 3D-элементов из скандий к хром, демонстрирующий уменьшение вклада 3d-электронов в металлическую связь, поскольку они все больше и больше притягиваются ядром к инертному остову;[11] однако они выше, чем значения для предыдущего элемента марганец потому что этот элемент имеет наполовину заполненную трехмерную подоболочку, и, следовательно, его d-электроны нелегко делокализовать. Та же тенденция проявляется для рутения, но не для осмия.[12]
Температура плавления железа экспериментально хорошо определена для давлений менее 50 ГПа. Для более высоких давлений опубликованные данные (по состоянию на 2007 год) все еще варьируются на десятки гигапаскалей и более тысячи кельвинов.[13]
Магнитные свойства

Ниже его Точка Кюри 770 ° C, α-железо изменяется от парамагнитный к ферромагнитный: the спины двух неспаренных электронов в каждом атоме обычно выравниваются со спинами его соседей, создавая общую магнитное поле.[15] Это происходит потому, что орбитали этих двух электронов (dz2 и гИкс2 − у2) не указывают на соседние атомы в решетке и, следовательно, не участвуют в металлической связи.[6]
В отсутствие внешнего источника магнитного поля атомы самопроизвольно распадаются на магнитные домены, около 10 микрометров в поперечнике,[16] так что атомы в каждом домене имеют параллельные спины, но некоторые домены имеют другую ориентацию. Таким образом, макроскопический кусок железа будет иметь почти нулевое общее магнитное поле.
Приложение внешнего магнитного поля вызывает рост доменов, намагниченных в одном и том же общем направлении, за счет соседних, которые указывают в других направлениях, усиливая внешнее поле. Этот эффект используется в устройствах, которым необходимо направлять магнитные поля, например электрические трансформаторы, магнитная запись головы и электродвигатели. Примеси, дефекты решетки, или границы зерен и частиц могут «закрепить» домены в новых положениях, так что эффект сохраняется даже после удаления внешнего поля - таким образом, превращая железный объект в (постоянный) магнит.[15]
Подобное поведение демонстрируют некоторые соединения железа, такие как ферриты и минералы. магнетит, кристаллическая форма смешанного оксида железа (II, III) Fe
3О
4 (хотя механизм атомного масштаба, ферримагнетизм, несколько иначе). Кусочки магнетита с естественной постоянной намагниченностью (магниты) предоставил самый ранний компасы для навигации. Частицы магнетита широко использовались в магнитных носителях записи, таких как основные воспоминания, магнитные ленты, дискеты, и диски, пока они не были заменены кобальтматериалы на основе.
Изотопы
Железо имеет четыре стабильных изотопы: 54Fe (5,845% природного железа), 56Fe (91.754%), 57Fe (2,119%) и 58Fe (0,282%). Также создано 20-30 искусственных изотопов. Из этих стабильных изотопов только 57Fe имеет ядерное вращение (−1⁄2). В нуклид 54Fe теоретически может пройти двойной захват электронов к 54Cr, но этот процесс никогда не наблюдался, а только нижний предел периода полураспада 3,1 × 1022 лет было установлено.[17]
60Fe - это потухший радионуклид долго период полураспада (2,6 миллиона лет).[18] Его нет на Земле, но конечный продукт его распада - это его внучка, стабильный нуклид. 60Ni.[17] Большая часть прошлых работ по изотопному составу железа была сосредоточена на нуклеосинтез из 60Fe через исследования метеориты и рудообразование. В последнее десятилетие достижения в масс-спектрометрии позволили обнаруживать и количественно определять мельчайшие, естественные вариации в соотношении стабильные изотопы железа. Большая часть этой работы продиктована земной шар и планетология сообщества, хотя появляются новые приложения для биологических и промышленных систем.[19]
В фазах метеоритов Семаркона и Червоный Кут, корреляция между концентрацией 60Ni, внучка из 60Fe и обилие стабильных изотопов железа свидетельствовали о существовании 60Fe во время формирование Солнечной системы. Возможно, энергия, выделяемая при распаде 60Fe, наряду с выпущенным 26Al, способствовал переплавке и дифференциация из астероиды после их образования 4,6 миллиарда лет назад. Обилие 60Ni присутствует в внеземной материал может пролить свет на происхождение и раннюю историю Солнечная система.[20]
Самый распространенный изотоп железа 56Fe представляет особый интерес для ученых-ядерщиков, поскольку представляет собой наиболее частую конечную точку нуклеосинтез.[21] С 56Ni (14 альфа-частицы) легко получается из более легких ядер в альфа-процесс в ядерные реакции в сверхновых (см. процесс горения кремния), это конец цепочек слияния внутри чрезвычайно массивные звезды, поскольку добавление еще одной альфа-частицы, в результате 60Zn требует гораздо больше энергии. Этот 56Ni, период полураспада которого составляет около 6 дней, создается в больших количествах в этих звездах, но вскоре распадается в результате двух последовательных излучений позитронов в продуктах распада сверхновой звезды. остаток сверхновой газовое облако, сначала радиоактивное 56Co, а затем в стабильную 56Fe. Таким образом, железо является наиболее распространенным элементом в ядре красные гиганты, и является наиболее распространенным металлом в железные метеориты и в плотном металле ядра планет Такие как земной шар.[22] Это также очень распространено во Вселенной по сравнению с другими стабильными металлы примерно такой же атомный вес.[22][23] Железо на шестом месте обильный элемент в вселенная, а наиболее распространенные огнеупорный элемент.[24]
Хотя дополнительный крошечный выигрыш в энергии можно было бы извлечь, синтезируя 62Ni, который имеет немного более высокую энергию связи, чем 56Fe, условия в звездах для этого не подходят. Производство элементов в сверхновых звездах и их распространение на Земле в значительной степени предпочитают железо никелю, и в любом случае, 56Fe по-прежнему имеет меньшую массу на нуклон, чем 62Ni из-за более высокой доли более легких протонов.[25] Следовательно, элементы тяжелее железа требуют сверхновая звезда для их формирования с привлечением быстрый захват нейтронов начав 56Ядра Fe.[22]
в далекое будущее Вселенной, предполагая, что распад протона не происходит, холодно слияние происходит через квантовое туннелирование заставит легкие ядра в обычной материи слиться в 56Ядра Fe. Деление и испускание альфа-частиц затем заставит тяжелые ядра распадаться на железо, превращая все объекты звездной массы в холодные сферы из чистого железа.[26]
Происхождение и возникновение в природе
Космогенез
Изобилие железа в скалистые планеты как Земля, из-за ее обильного производства слияние в большой массе звезды, где это последний элемент, который будет произведен с выделением энергии перед сильным взрывом типа Ia сверхновая, который разбрасывает железо в космос. Другие типы сверхновых не влияют существенно на содержание железа (см. сверхновая с коллапсом ядра).[27]
Металлическое железо

Металлический или самородное железо редко встречается на поверхности Земли, потому что он склонен к окислению. Однако как земные внутренний и внешнее ядро, которые составляют 35% массы всей Земли, как полагают, состоят в основном из сплава железа, возможно с никель. Считается, что электрические токи в жидком внешнем ядре являются источником Магнитное поле Земли. Другой планеты земной группы (Меркурий, Венера, и Марс) так же хорошо как Луна Считается, что они имеют металлическое ядро, состоящее в основном из железа. В Астероиды М-типа также считается, что они частично или большей частью сделаны из сплава металлического железа.
Редкий железные метеориты являются основной формой природного металлического железа на поверхности Земли. Предметы из холодно обработанный метеоритное железо было обнаружено в различных археологических раскопках, относящихся к временам, когда выплавка железа еще не была развита; и Инуиты в Гренландия сообщалось об использовании железа из Кейп-Йорк метеорит для инструментов и охотничьего оружия.[28] Примерно 1 из 20 метеориты состоят из уникальных железо-никелевых минералов тенит (35–80% железа) и камасит (90–95% железа).[29] Самородное железо также редко встречается в базальтах, которые образовались из магм, которые вступили в контакт с богатыми углеродом осадочными породами, которые восстановили кислород. летучесть достаточно для кристаллизации железа. Это известно как Теллурическое железо и описан в нескольких местах, например Остров Диско в Западной Гренландии, Якутия в России и Bühl в Германии.[30]
Минералы мантии
Ферропериклаз (Mg, Fe) O, твердый раствор периклаз (MgO) и вюстит (FeO), составляет около 20% объема нижняя мантия Земли, что делает его второй по распространенности минеральной фазой в этом регионе после силикатный перовскит (Mg, Fe) SiO3; он также является основным носителем железа в нижней мантии.[31] Внизу переходная зона мантии реакция γ- (Mg, Fe)2[SiO4] ↔ (Mg, Fe) [SiO3] + (Mg, Fe) O превращает гамма-оливин в смесь силикатного перовскита и ферропериклаза и наоборот. В литературе эту минеральную фазу нижней мантии также часто называют магнезиовюститом.[32] Силикатный перовскит может составлять до 93% нижней мантии,[33] и форма железа магния, (Mg, Fe) SiO3, считается самым распространенным минеральная в Земле, составляя 38% ее объема.[34]
земной коры

Хотя железо является самым распространенным элементом на Земле, большая часть этого железа сосредоточена в внутренний и внешний ядра.[35][36] Доля железа в земной коры составляет всего около 5% от общей массы корки и, таким образом, является четвертым по численности элементом в этом слое (после кислород, кремний, и алюминий).[37]
Большая часть железа в коре сочетается с различными другими элементами, образуя множество минералы железа. Важный класс - это оксид железа минералы, такие как гематит (Fe2О3), магнетит (Fe3О4), и сидерит (FeCO3), которые являются основными руды железа. Много Магматические породы также содержат сульфидные минералы пирротин и пентландит.[38][39] В течение выветриваниежелезо имеет тенденцию выщелачиваться из сульфидных отложений в виде сульфата и из силикатных отложений в виде бикарбоната. Оба они окисляются в водном растворе и выпадают в осадок даже при слегка повышенном pH. оксид железа (III).[40]
Большие залежи железа полосчатые железные образования, тип породы, состоящий из повторяющихся тонких слоев оксидов железа, чередующихся с полосами бедных железом сланец и черт. Полосчатые железные образования были заложены в период между 3,700 миллион лет назад и 1,800 миллион лет назад.[41][42]
Материалы, содержащие тонкоизмельченные оксиды или оксид-гидроксиды железа (III), такие как охра, использовались как желтый, красный и коричневый пигменты с доисторических времен. Они также влияют на цвет различных камней и глины, включая целые геологические образования, такие как Нарисованные холмы в Орегон и Buntsandstein («цветной песчаник», англ. Бантер).[43] Через Эйзенсандштейн (а юрский "железный песчаник", например из Донздорф в Германии)[44] и Камень для ванны в Великобритании соединения железа являются причиной желтоватого цвета многих исторических зданий и скульптур.[45] Пресловутый красный цвет поверхности Марса получен из богатого оксидом железа реголит.[46]
В минерале сульфида железа содержится значительное количество железа. пирит (FeS2), но из него трудно извлечь железо и поэтому он не эксплуатируется. Фактически, железо настолько распространено, что производство обычно сосредоточено только на рудах с очень большим его содержанием.
Согласно Международная панель ресурсовс Отчет о запасах металлов в обществе, мировой запас железа, используемого в обществе, составляет 2 200 кг на душу населения. В этом отношении более развитые страны отличаются от менее развитых (7 000–14 000 против 2 000 кг на душу населения).[47]
Химия и соединения
| Окисление государственный | Типичное соединение |
|---|---|
| −2 (d10) | Динатрия тетракарбонилферрат (Реагент Коллмана) |
| −1 (d9) | Fe 2(CO)2− 8 |
| 0 (d8) | Пентакарбонил железа |
| 1 (d7) | Циклопентадиенил-дикарбонилдимер железа ("Fp2") |
| 2 (d6) | Сульфат железа, ферроцен |
| 3 (d5) | Хлорид железа, тетрафторборат ферроцения |
| 4 (d4) | Fe (дневники) 2Cl2+ 2 |
| 5 (d3) | FeO3− 4 |
| 6 (d2) | Феррат калия |
| 7 (d1) | [FeO4]– (матричная изоляция, 4K) |
Железо демонстрирует характерные химические свойства переходные металлы, а именно способность образовывать различные степени окисления, различающиеся ступенями одной и очень большой координационной и металлоорганической химии: действительно, это было открытие соединения железа, ферроцен, которая произвела революцию в этой области в 1950-х годах.[48] Железо иногда считают прототипом всего блока переходных металлов из-за его большого количества и огромной роли, которую оно сыграло в техническом прогрессе человечества.[49] Его 26 электронов расположены в конфигурация [Ar] 3d64 с2, из которых 3d- и 4s-электроны относительно близки по энергии, и, таким образом, он может потерять переменное количество электронов, и нет четкой точки, где дальнейшая ионизация станет невыгодной.[12]
Железо образует соединения в основном в состояния окисления +2 (железо (II), "железо") и +3 (железо (III), «железо»). Железо также встречается в более высокие степени окисления, например фиолетовый феррат калия (K2FeO4), который содержит железо в степени окисления +6. Хотя оксид железа (VIII) (FeO4), отчет не мог быть воспроизведен, и такой вид от удаления всех электронов элемента за пределами предыдущей конфигурации инертного газа (по крайней мере, с железом в его степени окисления +8) был признан маловероятным с вычислительной точки зрения.[50] Однако одна форма анионного [FeO4]– с железом в его степени окисления +7, вместе с (V) -пероксоизомером железа, был обнаружен инфракрасной спектроскопией при 4 K после соконденсации подвергнутых лазерной абляции атомов Fe со смесью O2/ Ар.[51] Железо (IV) является обычным промежуточным продуктом во многих реакциях биохимического окисления.[52][53] Многочисленные органо-железо соединения содержат формальные степени окисления +1, 0, -1 или даже -2. Степени окисления и другие связывающие свойства часто оценивают с использованием метода Мессбауэровская спектроскопия.[54] Много соединения со смешанной валентностью содержат центры железа (II) и железа (III), такие как магнетит и Берлинская лазурь (Fe4(Fe [CN]6)3).[53] Последний используется как традиционный «синий» в чертежи.[55]
Железо - первый из переходных металлов, который не может достичь своей групповой степени окисления +8, хотя его более тяжелые родственные соединения рутений и осмий могут, с рутением сложнее, чем с осмием.[6] Рутений демонстрирует водный катионный химический состав в своих низких степенях окисления, аналогичный таковому у железа, но осмий нет, что благоприятствует высоким степеням окисления, в которых он образует анионные комплексы.[6] Во второй половине серии 3d-переходов вертикальные сходства вниз по группам конкурируют с горизонтальными сходствами железа с его соседями. кобальт и никель в периодической таблице, которые также являются ферромагнитными при комнатная температура и разделяют похожую химию. Таким образом, железо, кобальт и никель иногда объединяют в группы. железная триада.[49]
В отличие от многих других металлов, железо не образует амальгам с Меркурий. В результате ртуть продается в стандартных металлических колбах весом 76 фунтов (34 кг).[56]
Железо - безусловно, самый реактивный элемент в своей группе; он пирофорен при тонком измельчении и легко растворяется в разбавленных кислотах, давая Fe2+. Однако он не реагирует с концентрированными азотная кислота и другие окисляющие кислоты из-за образования непроницаемого оксидного слоя, который, тем не менее, может реагировать с соляная кислота.[6]
Бинарные соединения
Оксиды и гидроксиды
Железо образует различные оксидные и гидроксидные соединения; наиболее распространены оксид железа (II, III) (Fe3О4), и оксид железа (III) (Fe2О3). Оксид железа (II) также существует, хотя он нестабилен при комнатной температуре. Несмотря на их имена, на самом деле они все нестехиометрические соединения состав которых может быть разным.[57] Эти оксиды являются основными рудами для производства железа (см. цветущий и доменная печь). Они также используются в производстве ферриты, полезный магнитное хранилище СМИ в компьютерах и пигменты. Самый известный сульфид - это железный пирит (FeS2), также известное как золото дураков из-за его золотого блеска.[53] Это не соединение железа (IV), но на самом деле это железо (II). полисульфид содержащий Fe2+ и S2−
2 ионы в искаженном хлорид натрия структура.[57]

Галогениды
Двойное железо и железо галогениды хорошо известны. Галогениды железа обычно возникают в результате обработки металлического железа соответствующим галогеноводородная кислота с получением соответствующих гидратированных солей.[53]
- Fe + 2 HX → FeX2 + H2 (X = F, Cl, Br, I)
Железо реагирует с фтором, хлором и бромом с образованием соответствующих галогенидов железа, хлорид железа самый распространенный.[58]
- 2 Fe + 3 X2 → 2 FeX3 (Х = F, Cl, Br)
Иодид железа является исключением, поскольку он термодинамически нестабилен из-за окислительной способности Fe.3+ и высокая редуцирующая способность I−:[58]
- 2 я− + 2 Fe3+ → я2 + 2 Fe2+ (E0 = +0,23 В)
Иодид железа, твердое вещество черного цвета, нестабилен в обычных условиях, но может быть получен реакцией пентакарбонил железа с йод и монооксид углерода в присутствии гексан свет при температуре −20 ° C, без кислорода и воды.[58]
Химия раствора

В стандартные восстановительные потенциалы в кислом водном растворе для некоторых распространенных ионов железа приведены ниже:[6]
| Fe2+ + 2 е− | ⇌ Fe | E0 = −0,447 В |
| Fe3+ + 3 е− | ⇌ Fe | E0 = -0,037 В |
| FeO2− 4 + 8 часов+ + 3 е− | ⇌ Fe3+ + 4 часа2О | E0 = +2,20 В |
Красно-фиолетовый четырехгранник феррат(VI) анион является настолько сильным окислителем, что окисляет азот и аммиак при комнатной температуре, и даже саму воду в кислых или нейтральных растворах:[58]
- 4 FeO2−
4 + 10 ЧАС
2О → 4 Fe3+
+ 20 ОЙ−
+ 3 O2
Fe3+ ион имеет простую катионную химию, хотя бледно-фиолетовый гексаквойон [Fe (H2O)6]3+ очень легко гидролизуется при повышении pH выше 0 следующим образом:[59]
| [Fe (H2O)6]3+ | ⇌ [Fe (H2O)5(ОЙ)]2+ + H+ | K = 10−3.05 моль дм−3 |
| [Fe (H2O)5(ОЙ)]2+ | ⇌ [Fe (H2O)4(ОЙ)2]+ + H+ | K = 10−3.26 моль дм−3 |
| 2 [Fe (H2O)6]3+ | ⇌ [Fe (H 2O) 4(ОЙ)]4+ 2 + 2 часа+ + 2 часа2О | K = 10−2.91 моль дм−3 |

При повышении pH выше 0 образуются указанные выше желтые гидролизованные частицы, а при повышении его значения выше 2–3 - красновато-коричневые водные оксид железа (III) выпадает из раствора. Хотя Fe3+ имеет d5 конфигурации его спектр поглощения не такой, как у Mn2+ со своими слабыми, запрещенными по спину d – d зонами, поскольку Fe3+ имеет более высокий положительный заряд и более поляризующий, что снижает энергию его превращения лиганда в металл перенос заряда поглощения. Таким образом, все вышеперечисленные комплексы довольно сильно окрашены, за единственным исключением гексакво-иона, и даже у него в спектре преобладает перенос заряда в ближней ультрафиолетовой области.[59] С другой стороны, бледно-зеленый гексаквойон железа (II) [Fe (H2O)6]2+ не подвергается заметному гидролизу. Углекислый газ не выделяется при карбонат добавляются анионы, в результате чего получается белый карбонат железа (II) осаждаются. В избытке углекислого газа он образует малорастворимый бикарбонат, который обычно встречается в грунтовых водах, но он быстро окисляется на воздухе с образованием оксид железа (III) это объясняет коричневые отложения, присутствующие в значительном количестве потоков.[60]
Координационные соединения
Из-за своей электронной структуры железо имеет очень большой координационный и металлоорганический состав.

Известно много координационных соединений железа. Типичный шестикоординированный анион - гексахлорферрат (III), [FeCl6]3−, встречается в смешанном соль тетракис (метиламмоний) гексахлорферрат (III) хлорид.[61][62] Комплексы с множественными бидентатными лигандами имеют геометрические изомеры. Например, транс-хлоргидридобис (бис-1,2- (дифенилфосфино) этан) железо (II) комплекс используется в качестве исходного материала для соединений с Fe (dppe)2 часть.[63][64] Ион ферриоксалата с тремя оксалат лиганды (показаны справа) отображаются спиральная хиральность с двумя несложными геометриями, помеченными Λ (лямбда) для оси левого винта и Δ (дельта) для правой оси винта в соответствии с соглашениями IUPAC.[59] Ферриоксалат калия используется в химической актинометрия и вместе с его натриевая соль подвергается фотовосстановление применяется в старых фотографических процессах. В дигидрат из оксалат железа (II) имеет полимерный структура с копланарными ионами оксалата, соединяющими центры железа с кристаллизационной водой, расположенной в шапках каждого октаэдра, как показано ниже.[65]
Комплексы железа (III) очень похожи на комплексы хром(III) за исключением того, что железо (III) предпочитает О-донор вместо N-донорные лиганды. Последние имеют тенденцию быть более нестабильными, чем комплексы железа (II), и часто диссоциируют в воде. Многие комплексы Fe – O демонстрируют интенсивный цвет и используются в качестве тестов на фенолы или же Enols. Например, в тест на хлорид железа, используемый для определения наличия фенолов, хлорид железа (III) реагирует с фенолом с образованием темно-фиолетового комплекса:[59]
- 3 ArOH + FeCl3 → Fe (OAr)3 + 3 HCl (Ar = арил)
Среди галогенидных и псевдогалогенидных комплексов наиболее стабильными являются фторокомплексы железа (III) с бесцветным [FeF5(ЧАС2O)]2− является наиболее стабильным в водном растворе. Хлорокомплексы менее стабильны и способствуют тетраэдрической координации, как в [FeCl4]−; [FeBr4]− и [FeI4]− легко восстанавливаются до железа (II). Тиоцианат является обычным тестом на присутствие железа (III), поскольку оно образует кроваво-красный [Fe (SCN) (H2O)5]2+. Как и марганец (II), большинство комплексов железа (III) являются высокоспиновыми, за исключением комплексов с лигандами с высоким содержанием спектрохимический ряд Такие как цианид. Примером низкоспинового комплекса железа (III) является [Fe (CN)6]3−. Цианидные лиганды легко отделяются от [Fe (CN)6]3−, и, следовательно, этот комплекс ядовит, в отличие от комплекса железа (II) [Fe (CN)6]4− найдено в берлинской лазурь,[59] который не выпускает цианистый водород кроме случаев добавления разбавленных кислот.[60] Железо показывает великое множество электронных спиновые состояния, включая все возможные значения спинового квантового числа для элемента d-блока от 0 (диамагнитный) до5⁄2 (5 неспаренных электронов). Это значение всегда вдвое меньше количества неспаренных электронов. Комплексы с нулевым или двумя неспаренными электронами считаются низкоспиновыми, а комплексы с четырьмя или пятью - высокоспиновыми.[57]
Комплексы железа (II) менее стабильны, чем комплексы железа (III), но предпочтение отдается О-донорные лиганды менее выражены, так что, например, [Fe (NH3)6]2+ известно, а [Fe (NH3)6]3+ не является. Они имеют тенденцию к окислению до железа (III), но это можно смягчить низким pH и используемыми специфическими лигандами.[60]
Металлоорганические соединения
Химия органического железа это изучение металлоорганические соединения железа, где атомы углерода ковалентно связаны с атомом металла. Их много и они разнообразны, в том числе цианидные комплексы, карбонильные комплексы, бутерброд и полусэндвич-компаунды.
Берлинская лазурь или «ферроцианид железа», Fe4[Fe (CN)6]3, представляет собой старый и хорошо известный комплекс цианида железа, широко используемый в качестве пигмента и в некоторых других областях. Его образование можно использовать как простой тест влажной химии для различения водных растворов Fe2+ и Fe3+ как они реагируют (соответственно) с феррицианид калия и ферроцианид калия сформировать берлинскую лазурь.[53]
Еще один старый пример железоорганического соединения: пентакарбонил железа, Fe (CO)5, в которой нейтральный атом железа связан с атомами углерода пяти монооксид углерода молекулы. Смесь можно использовать для изготовления карбонильное железо порошок, высокореакционная форма металлического железа. Термолиз пентакарбонила железа дает трижелезный додекакарбонил, Fe
3(CO)
12, a с кластером из трех атомов железа в ядре. Реагент Коллмана, динатрия тетракарбонилферрат, является полезным реагентом для органической химии; он содержит железо в степени окисления -2. Циклопентадиенил-дикарбонилдимер железа содержит железо в редкой степени окисления +1.[66]
Вехой в этой области стало открытие в 1951 г. удивительно стабильного сэндвич-компаунд ферроцен Fe (C
5ЧАС
5)
2, к Полсон и Кили[67] и независимо Миллер и другие,[68] чья удивительная молекулярная структура была определена только год спустя Woodward и Уилкинсон[69] и Фишер.[70]Ферроцен по-прежнему остается одним из самых важных инструментов и моделей в этом классе.[71]
Железоцентрированные металлоорганические соединения используются в качестве катализаторы. В Комплекс Knölker, например, это перенос гидрирования катализатор для кетоны.[72]
Промышленное использование
Наиболее производимые в промышленности соединения железа: сульфат железа (II) (FeSO4·7ЧАС2О) и хлорид железа (III) (FeCl3). Первый является одним из наиболее доступных источников железа (II), но менее устойчив к окислению в воздухе, чем Соль Мора ((NH4)2Fe (SO4)2· 6H2О). Соединения железа (II) имеют тенденцию окисляться в воздухе до соединений железа (III).[53]
Этимология
Поскольку железо используется так долго, у него много названий. Источник его химического символа Fe это латинское слово железо, а его потомки - это имена элемента в Романские языки (Например, Французский Fer, испанский Иерро, и Итальянский и португальский Ферро).[73] Слово железо сам возможно происходит от Семитские языки, через Этрусский, от корня, который также дал начало Древнеанглийский bræs "латунь".[74] Английское слово утюг происходит в конечном итоге от Прото-германский * isarnan, который также является источником немецкого названия Эйзен. Скорее всего, он был заимствован из кельтская * isarnon, который в конечном итоге происходит от Протоиндоевропейский * is- (e) ro- "могущественный, святой" и наконец * eis «сильный», ссылаясь на прочность железа как металла.[75] Клюге связывает * isarnon на иллирийский и латынь Ира, 'гнев').[нужна цитата] В Балто-славянский названия для железа (например, русский железо [железо], Польский elazo, Литовский Гележис) - единственные, кто пришел непосредственно из протоиндоевропейской *граммчасэльгчас- "утюг".[76] Во многих из этих языков слово для утюг может также использоваться для обозначения других предметов, сделанных из железа или стали, или, образно говоря, из-за твердости и прочности металла.[77] В Китайский галстук (традиционный 鐵; упрощенный 铁) происходит от Прото-сино-тибетский * hliek,[78] и был заимствован в Японский как 鉄 тецу, который также имеет собственное чтение курогане «черный металл» (аналогично тому, как в английском слове упоминается железо кузнец).[79]
История
Развитие металлургии железа
Железо - один из элементов, несомненно известных древнему миру.[80] Это сработало, или кованый, тысячелетиями. Однако железные предметы большого возраста встречаются гораздо реже, чем предметы из золота или серебра, из-за легкости, с которой железо разъедает.[81] Технология развивалась медленно, и даже после открытия плавки железо потребовалось много веков, чтобы заменить бронзу в качестве металла, используемого для изготовления инструментов и оружия.
Метеоритное железо

Бусы из метеоритное железо в 3500 г. до н.э. или ранее были найдены в Герце, Египет, Г.А. Уэйнрайт.[82] Бусины содержат 7,5% никеля, что является признаком метеорного происхождения, поскольку железо, обнаруженное в земной коре, обычно содержит лишь незначительные примеси никеля.
Метеоритное железо высоко ценилось из-за своего происхождения с небес и часто использовалось для изготовления оружия и инструментов.[82] Например, кинжал сделанное из метеоритного железа было найдено в гробнице Тутанхамон, содержащий такие же пропорции железа, кобальта и никеля, что и обнаруженный в этом районе метеорит, выпавший в результате древнего метеорного потока.[83][84][85] Предметы, которые, вероятно, были сделаны египтянами из железа, датируются периодом от 3000 до 2500 лет до нашей эры.[81]
Метеоритное железо сравнительно мягкое, пластичное и легко холодная ковка но может стать хрупким при нагревании из-за никель содержание.[86]
Кованое железо

Первое производство чугуна началось в Средний бронзовый век, но прошло несколько столетий, прежде чем железо вытеснило бронзу. Образцы плавил железо из Асмар, Месопотамия и базар Высокий Чагар на севере Сирии были созданы где-то между 3000 и 2700 годами до нашей эры.[87] В Хеттов основал империю в северо-центральной Анатолия около 1600 г. до н.э. Похоже, они первыми поняли, как производить железо из руды, и высоко оценили это в своем обществе.[88] В Хеттов начали плавить железо между 1500 и 1200 годами до нашей эры, и эта практика распространилась на остальной Ближний Восток после падения их империи в 1180 году до нашей эры.[87] Последующий период называется периодом Железный век.
Артефакты выплавленного железа найдены в Индия начиная с 1800 по 1200 гг. до н.э.,[89] и в Левант примерно с 1500 г. до н.э. (предполагается плавка в Анатолия или Кавказ).[90][91] Предполагаемые ссылки (сравнить история металлургии в Южной Азии) гладить по-индийски Веды были использованы для заявлений об очень раннем использовании железа в Индии, соответственно, для датирования текстов как таковых. В Ригведа срок аяс (металл), вероятно, относится к меди и бронзе, а железо или шйама айас, буквально «блэк-метал», впервые упоминается в постригведической Атхарваведа.[92]
Некоторые археологические данные свидетельствуют о том, что железо выплавляли в Зимбабве и юго-восточная Африка уже в восьмом веке до нашей эры.[93] Обработка железа была представлена Греция в конце 11 века до нашей эры, откуда он быстро распространился по Европе.[94]
Распространение обработки железа в Центральной и Западной Европе связано с кельтская расширение. В соответствии с Плиний Старший, железо было распространено в Римский эпоха.[82] Годовой объем производства чугуна Римская империя оценивается в 84750 т,[95] в то время как такой же густонаселенный и современный ханьский Китай производил около 5000 т.[96] В Китае железо появляется только около 700–500 лет до нашей эры.[97] Выплавка железа могла быть завезена в Китай через Среднюю Азию.[98] Самые ранние свидетельства использования доменная печь в Китае датируется 1 веком нашей эры,[99] и вагранки использовались еще в Период воюющих царств (403–221 гг. До н.э.).[100] Использование доменной и вагранки оставалось распространенным в течение Песня и Династии Тан.[101]
Во время промышленной революции в Великобритании Генри Корт начал очищать железо от чугун к кованое железо (или пруток) с использованием инновационных производственных систем. В 1783 году он запатентовал процесс лужения для переработки железной руды. Позже он был улучшен другими, в том числе Джозеф Холл.[102]
Чугун
Чугун был впервые произведен в Китай в 5 веке до нашей эры,[103] но вряд ли был в Европе до средневековья.[104][105] Самые ранние чугунные артефакты были обнаружены археологами на территории современной Лухэ, Цзянсу в Китае. Чугун использовался в древний Китай для войны, сельского хозяйства и архитектуры.[106] Вовремя средневековый период, в Европе были найдены средства производства кованого железа из чугуна (в этом контексте известного как чугун) с помощью изысканные кузницы. Для всех этих процессов уголь требовалось как топливо.[107]
Средневековый доменные печи были около 10 футов (3,0 м) в высоту и выполнены из несгораемого кирпича; принудительный воздух обычно подавался сильфонами с ручным управлением.[105] Современные доменные печи стали намного больше, с подами диаметром четырнадцать метров, что позволяет им производить тысячи тонн железа каждый день, но, по сути, они работают так же, как и в средневековые времена.[107]
В 1709 г. Авраам Дарби I создал кокс- доменная печь с обогревом для производства чугуна, заменяющая древесный уголь, но продолжающая использовать доменные печи. Последовавшая доступность недорогого железа была одним из факторов, приведших к Индустриальная революция. К концу 18 века чугун начал заменять кованое железо для определенных целей, потому что он был дешевле. Содержание углерода в железе не рассматривалось как причина различий в свойствах кованого железа, чугуна и стали до 18 века.[87]
Поскольку железо становилось все более дешевым и доступным, оно также стало основным конструкционным материалом после создания инновационных первый железный мост в 1778 году. Этот мост до сих пор стоит как памятник роли железа в промышленной революции. После этого железо использовалось в рельсах, лодках, кораблях, акведуках и зданиях, а также в железных цилиндрах в Паровые двигатели.[107] Железные дороги сыграли центральную роль в формировании современности и идей прогресса.[108] и на разных языках (например, на французском, испанском, итальянском и немецком) железные дороги называются железная дорога.
Стали
Сталь (с меньшим содержанием углерода, чем чугун, но больше, чем кованое железо) была впервые произведена в древности с использованием цветущий. Кузнецы в Луристан в западной Персии к 1000 г. до н.э. производили хорошую сталь.[87] Потом улучшенные версии, Wootz сталь Индией и Дамасская сталь были разработаны около 300 г. до н.э. и 500 г. н.э. соответственно. Эти методы были специализированными, и поэтому сталь не стала основным товаром до 1850-х годов.[109]
Новые методы производства науглероживание прутки железа в процесс цементирования были изобретены в 17 веке. в Индустриальная революциябыли разработаны новые методы производства пруткового чугуна без древесного угля, которые позже были применены для производства стали. В конце 1850-х гг. Генри Бессемер изобрел новый процесс производства стали, включающий продувку воздухом расплавленного чугуна для производства мягкой стали. Это сделало сталь намного более экономичной, что привело к тому, что кованое железо больше не производилось в больших количествах.[110]
Основы современной химии
В 1774 г. Антуан Лавуазье использовали реакцию водяного пара с металлическим железом внутри раскаленной железной трубки для получения водород в его экспериментах, приведших к демонстрации сохранение массы, который сыграл важную роль в превращении химии из качественной науки в количественную.[111]
Символическая роль

Железо играет определенную роль в мифологии и находит различное применение. как метафора И в фольклор. В Греческий поэт Гесиодс Работы и дни (строки 109–201) перечислены различные возраст человека названы в честь металлов, таких как золото, серебро, бронза и железо, чтобы объяснить последовательные эпохи человечества.[112] Железный век был тесно связан с Римом, и у Овидия Метаморфозы
Добродетели в отчаянии покинули землю; и порочность человека становится всеобщей и полной. Тогда на смену пришли твердые стали.
— Овидий, Метаморфозы, Книга I, Железный век, строка 160 и далее
Пример важности символической роли железа можно найти в Немецкая кампания 1813 г.. Фридрих Вильгельм III сдал тогда первый Железный крест как военная награда. Берлинские железные украшения достигла пика производства между 1813 и 1815 годами, когда прусский Королевская семья призвали граждан жертвовать золотые и серебряные украшения на военные нужды. Надпись Gold gab ich für Eisen (Я отдал золото за железо) также использовалось в более поздних военных действиях.[113]
Производство металлического железа
Лабораторные маршруты
Для некоторых ограниченных целей, когда это необходимо, чистое железо производится в лаборатории в небольших количествах путем восстановления чистого оксида или гидроксида водородом или образования пентакарбонила железа и нагревания его до 250 ° C, чтобы оно разлагалось с образованием чистого порошка железа. .[40] Другой метод - электролиз хлорида железа на железном катоде.[114]
Главный промышленный маршрут
| Страна | Железная руда | Чугун | Прямое утюг | Стали |
|---|---|---|---|---|
| Китай | 1,114.9 | 549.4 | 573.6 | |
| Австралия | 393.9 | 4.4 | 5.2 | |
| Бразилия | 305.0 | 25.1 | 0.011 | 26.5 |
| Япония | 66.9 | 87.5 | ||
| Индия | 257.4 | 38.2 | 23.4 | 63.5 |
| Россия | 92.1 | 43.9 | 4.7 | 60.0 |
| Украина | 65.8 | 25.7 | 29.9 | |
| Южная Корея | 0.1 | 27.3 | 48.6 | |
| Германия | 0.4 | 20.1 | 0.38 | 32.7 |
| Мир | 1,594.9 | 914.0 | 64.5 | 1,232.4 |
В настоящее время промышленное производство чугуна или стали состоит из двух основных этапов. На первом этапе железная руда уменьшенный с кокс в доменная печь, а расплавленный металл отделяется от крупных примесей, таких как силикатные минералы. На этой стадии получается сплав -чугун- содержащий относительно большое количество углерода. На втором этапе количество углерода в передельном чугуне снижается путем окисления с получением кованого железа, стали или чугуна.[116] На этом этапе можно добавить другие металлы для образования легированные стали.

Доменная обработка
В доменную печь загружается железная руда, обычно гематит Fe
2О
3 или же магнетит Fe
3О
4вместе с коксом (каменный уголь который был отдельно запечен для удаления летучих компонентов). Воздух, предварительно нагретый до 900 ° C, пропускается через смесь в количестве, достаточном для превращения угля в монооксид углерода:[116]
- 2 К + О2 → 2 СО
Эта реакция повышает температуру примерно до 2000 ° C. Окись углерода восстанавливает железную руду до металлического железа.[116]
- Fe2О3 + 3 CO → 2 Fe + 3 CO2
Некоторое количество железа в высокотемпературной нижней области печи вступает в реакцию непосредственно с коксом:[116]
- 2 Fe2О3 + 3 C → 4 Fe + 3 CO2
А поток Такие как известняк (карбонат кальция) или же доломит (карбонат кальция-магния) также добавляется в загрузку печи. Его цель - удалить из руды кремнеземистые минералы, которые в противном случае засорили бы печь. Тепло печи разлагает карбонаты до оксид кальция, который реагирует любым избытком кремнезем сформировать шлак состоит из силикат кальция CaSiO
3 или другие продукты. При температуре печи и металл, и шлак расплавляются. Они собираются внизу в виде двух несмешивающихся жидких слоев (со шлаком наверху), которые затем легко разделяются.[116] Шлак можно использовать в качестве материала в Дорога строительства или улучшения бедных минералами почв для сельское хозяйство.[105]
Сталеплавильное производство
Как правило, чугун, полученный в доменной печи, содержит до 4–5% углерода с небольшими количествами других примесей, таких как сера, магний, фосфор и марганец. Высокий уровень углерода делает его относительно непрочным и хрупким. Снижение количества углерода до 0,002–2,1% при массовом производстве стали, которое может быть до 1000 раз тверже чистого железа. Таким образом, можно производить самые разные стальные изделия холодная обработка, горячая прокатка, ковка, механическая обработкаи т. д. Удаление других примесей вместо этого приводит к получению чугуна, который используется для литья изделий в литейные заводы; например, печи, трубы, радиаторы, фонарные столбы и рельсы.[116]
Стальные изделия часто подвергаются различным термообработка после того, как им придана форма. Отжиг состоит в их нагревании до 700–800 ° C в течение нескольких часов с последующим постепенным охлаждением. Это делает сталь более мягкой и удобной.[118]
Прямое восстановление железа
По соображениям охраны окружающей среды были разработаны альтернативные методы обработки железа. "Прямое восстановление железа" восстанавливает железную руду к железному куску под названием "губчатое" железо или «прямое» железо, подходящее для выплавки стали.[105] В процесс прямого восстановления входят две основные реакции:
Природный газ частично окисляется (с теплом и катализатором):[105]
- 2 канала4 + O2 → 2 СО + 4 Н2
Затем железная руда обрабатывается этими газами в печи, в результате чего получается твердое губчатое железо:[105]
- Fe2О3 + CO + 2 H2 → 2 Fe + CO2 + 2 часа2О
Кремнезем удаляется добавлением известняк флюс, как описано выше.[105]
Термитный процесс
Воспламенение смеси алюминиевого порошка и оксида железа дает металлическое железо через термитная реакция:
- Fe2О3 + 2 Al → 2 Fe + Al2О3
В качестве альтернативы передельный чугун может быть превращен в сталь (с содержанием углерода до 2%) или кованое железо (технически чистое железо). Для этого использовались различные процессы, в том числе изысканные кузницы, лужа печи, Бессемеровские преобразователи, мартеновские печи, кислородные печи, и электродуговые печи. Во всех случаях цель состоит в том, чтобы окислить часть или весь углерод вместе с другими примесями. С другой стороны, для получения легированных сталей могут быть добавлены другие металлы.[107]
Приложения
Как конструкционный материал
Железо - наиболее широко используемый из всех металлов, на него приходится более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его предпочтительным материалом для выдерживания нагрузок или передачи сил, таких как конструкция машин и Станки, рельсы, автомобили, корпуса кораблей, арматурные стержни из бетона, и несущий каркас зданий. Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для получения стали.[119]
Механические свойства
| Материал | TS (МПа) | BH (Бринелль) |
|---|---|---|
| Железные усы | 11000 | |
| Ausformed (закаленный) стали | 2930 | 850–1200 |
| Мартенситная сталь | 2070 | 600 |
| Бейнитная сталь | 1380 | 400 |
| Перлитная сталь | 1200 | 350 |
| Холодно обработанный утюг | 690 | 200 |
| Мелкозернистое железо | 340 | 100 |
| Углеродсодержащее железо | 140 | 40 |
| Чистое монокристаллическое железо | 10 | 3 |
Механические свойства железа и его сплавов чрезвычайно важны для их структурного применения. Эти свойства могут быть оценены различными способами, включая Тест Бринелля, то Тест Роквелла и Тест твердости по Виккерсу.
Свойства чистого железа часто используются для калибровки измерений или сравнения тестов.[121][122] Однако на механические свойства железа значительно влияет чистота образца: чистые монокристаллы железа на самом деле мягче алюминия,[120] и самое чистое промышленное железо (99,99%) имеет твердость 20–30 по Бринеллю.[123]
Увеличение содержания углерода приведет к значительному увеличению твердости и прочности железа на разрыв. Максимальная твердость 65 руб.c достигается при содержании углерода 0,6%, хотя сплав имеет низкую прочность на разрыв.[124] Из-за мягкости железа работать с ним намного легче, чем с более тяжелым сородичи рутений и осмий.[12]
Типы сталей и сплавов
α-Железо - довольно мягкий металл, способный растворять лишь небольшую концентрацию углерода (не более 0,021% по массе при 910 ° C).[125] Аустенит (γ-железо) аналогично мягкое и металлическое, но может растворять значительно больше углерода (до 2,04% по массе при 1146 ° C). Эта форма железа используется в виде нержавеющая сталь используется для изготовления столовых приборов, больничного и общественного оборудования.[16]
Коммерчески доступное железо классифицируется на основе чистоты и количества добавок. Чугун имеет 3,5–4,5% углерода[126] и содержит различное количество загрязняющих веществ, таких как сера, кремний и фосфор. Чугун - это не товарный продукт, а скорее промежуточный этап в производстве чугуна и стали. Уменьшение содержания загрязняющих веществ в чугуне, которые отрицательно влияют на свойства материала, таких как сера и фосфор, дает чугун, содержащий 2–4% углерода, 1–6% кремния и небольшое количество марганец.[116] Чугун имеет температура плавления в диапазоне 1420–1470 К, что ниже, чем у любого из двух его основных компонентов, и делает его первым продуктом, который плавится при совместном нагревании углерода и железа.[6] Его механические свойства сильно различаются и зависят от формы, которую углерод принимает в сплаве.[12]
«Белые» чугуны содержат углерод в виде цементит, или карбид железа (Fe3C).[12] Этот твердый, хрупкий состав доминирует в механических свойствах белого чугуна, делая его твердым, но не устойчивым к ударам. Изломанная поверхность белого чугуна полна мелких граней битого карбида железа, очень бледного, серебристого, блестящего материала, отсюда и название. Медленное охлаждение смеси железа с 0,8% углерода ниже 723 ° C до комнатной температуры приводит к образованию отдельных чередующихся слоев цементита и α-железа, которое является мягким и податливым и называется перлит за его внешний вид. С другой стороны, быстрое охлаждение не оставляет времени для этого разделения и создает твердые и хрупкие мартенсит. Затем сталь может быть подвергнута отпуску путем повторного нагрева до промежуточной температуры, изменяя пропорции перлита и мартенсита. Конечный продукт с содержанием углерода ниже 0,8% представляет собой смесь перлит-αFe, а продукт с содержанием углерода выше 0,8% представляет собой смесь перлит-цементит.[12]
В серое железо углерод существует в виде отдельных мелких хлопьев графит, а также делает материал хрупким из-за чешуек графита с острыми краями, которые создают концентрация напряжения сайты в материале.[127] Более новый вариант серого чугуна, называемый ковкий чугун, специально обрабатывается следовыми количествами магний для изменения формы графита на сфероиды или конкреции, снижая концентрацию напряжений и значительно увеличивая ударную вязкость и прочность материала.[127]
Кованое железо содержит менее 0,25% углерода, но большое количество шлака придает ему волокнистость.[126] Это прочный, податливый продукт, но не такой плавкий, как чугун. Если заточить до края, он быстро его теряет. Кованое железо отличается наличием тонких волокон шлак заключенный в металле. Кованое железо более устойчиво к коррозии, чем сталь. Он был почти полностью заменен на мягкая сталь для традиционных изделий из кованого железа и кузнечное дело.
Мягкая сталь подвержена коррозии легче, чем кованое железо, но она дешевле и более широко доступна. Углеродистая сталь содержит не более 2,0% углерода,[128] с небольшим количеством марганец, сера, фосфор, и кремний. Легированные стали содержат различное количество углерода, а также других металлов, таких как хром, ванадий, молибден, никель, вольфрами т. д. Содержание в них сплава увеличивает их стоимость, поэтому они обычно используются только для специальных целей. Одна из распространенных легированных сталей - это нержавеющая сталь. Последние разработки в черной металлургии привели к производству все большего количества микролегированных сталей, также называемых «HSLA'или высокопрочные низколегированные стали, содержащие крошечные добавки для обеспечения высокой прочности и часто впечатляющей ударной вязкости при минимальных затратах.[128][129][130]
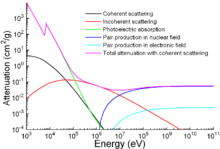
Помимо традиционных применений, железо также используется для защиты от ионизирующего излучения. Хотя он легче другого традиционного защитного материала, вести, механически он намного прочнее. Ослабление излучения как функция энергии показано на графике.[131]
Основным недостатком чугуна и стали является то, что чистое железо и большинство его сплавов сильно страдают от ржавчина если не защищен каким-либо образом, затраты составляют более 1% мировой экономики.[132] Картина, гальванизация, пассивация, пластиковое покрытие и воронение все используются для защиты железа от ржавчины, исключая воды и кислород или катодная защита. Механизм ржавления железа следующий:[132]
- Катод: 3 O2 + 6 часов2O + 12 e− → 12 ОН−
- Анод: 4 Fe → 4 Fe2+ + 8 e−; 4 Fe2+ → 4 Fe3+ + 4 е−
- Всего: 4 Fe + 3 O2 + 6 часов2O → 4 Fe3+ + 12 ОН− → 4 Fe (OH)3 или 4 FeO (OH) + 4 H2О
Электролит обычно сульфат железа (II) в городских условиях (образуются при атмосферных диоксид серы атакует железо) и частицы соли в атмосфере в прибрежных районах.[132]
Соединения железа
Хотя в основном железо используется в металлургии, соединения железа широко распространены и в промышленности. Железные катализаторы традиционно используются в Процесс Габера-Боша для производства аммиака и Процесс Фишера-Тропша для преобразования окиси углерода в углеводороды для горюче-смазочных материалов.[133] Порошковое железо в кислотном растворителе использовалось в Сокращение Бешампа сокращение нитробензол к анилин.[134]
Оксид железа (III) смешанный с алюминий порошок можно поджечь, чтобы создать термитная реакция, используется при сварке крупных металлических деталей (например, рельсы) и очистка руд. Оксид железа (III) и оксигидроксид используются как красноватый и охристый пигменты.
Хлорид железа (III) находит применение в очистке воды и очистка сточных вод, при крашении ткани, в качестве красителя в красках, в качестве добавки в корма для животных и в качестве травить за медь в производстве печатные платы.[135] Его также можно растворить в спирте с образованием настойки железа, которая используется как лекарство от кровотечения. канарейки.[136]
Сульфат железа (II) используется как предшественник других соединений железа. Он также используется для уменьшать хромат в цементе. Он используется для обогащения продуктов и лечения железодефицитная анемия. Сульфат железа (III) используется для осаждения мелких частиц сточных вод в баковой воде. Хлорид железа (II) используется в качестве восстанавливающего флокулянта, при образовании комплексов железа и магнитных оксидов железа, а также в качестве восстановителя в органическом синтезе.[135]
Биологическая и патологическая роль
Железо необходимо для жизни.[5][137][138] В железо-серные кластеры распространены и включают нитрогеназа, ферменты, ответственные за биологические азотфиксация. Железосодержащие белки участвуют в транспортировке, хранении и использовании кислорода.[5] Белки железа участвуют в перенос электронов.[139]
Примеры железосодержащих белков у высших организмов включают гемоглобин, цитохром (видеть железо с высокой валентностью), и каталаза.[5][140] Средний взрослый человек содержит около 0,005% веса тела железа, или около четырех граммов, из которых три четверти приходится на гемоглобин - уровень, который остается постоянным, несмотря на то, что каждый день усваивается только около одного миллиграмма железа.[139] потому что человеческое тело перерабатывает гемоглобин для содержания железа.[141]
Биохимия
Приобретение железа представляет собой проблему для аэробных организмов, поскольку трехвалентное железо плохо растворяется вблизи нейтрального pH. Таким образом, эти организмы разработали средства для поглощения железа в виде комплексов, иногда поглощая двухвалентное железо перед тем, как окислить его обратно до трехвалентного железа.[5] В частности, бактерии эволюционировали с очень высоким сродством. секвестирование агенты позвонили сидерофоры.[142][143][144]
После поглощения человеком клетки, хранение железа четко регламентировано.[5][145] Основным компонентом этого регулирования является белок трансферрин, который связывает ионы железа, абсорбированные из двенадцатиперстная кишка и несет его в кровь в клетки.[5][146] Трансферрин содержит Fe3+ в середине искаженного октаэдра, связанный с одним азотом, тремя атомами кислорода и хелатирующим карбонат анион, улавливающий Fe3+ ion: у него такой высокий константа стабильности что он очень эффективно поглощает Fe3+ ионы даже из самых стабильных комплексов. В костном мозге трансферрин восстанавливается из Fe.3+ и Fe2+ и хранится как ферритин включаться в гемоглобин.[139]
Наиболее известные и изученные биоинорганический соединения железа (биологические молекулы железа) являются гемовые белки: примеры гемоглобин, миоглобин, и цитохром P450.[5] Эти соединения участвуют в транспортировке газов, строительстве ферменты, и перенос электроны.[139] Металлопротеины представляют собой группу белков с ионом металла кофакторы. Некоторые примеры металлопротеинов железа: ферритин и рубредоксин.[139] Многие ферменты, жизненно важные для жизни, содержат железо, например каталаза,[147] липоксигеназы,[148] и IRE-BP.[149]
Гемоглобин - переносчик кислорода, который встречается в красные кровяные тельца и способствует их окраске, транспортируя кислород по артериям от легких к мышцам, где он передается миоглобин, который хранит его до тех пор, пока он не понадобится для метаболического окисления глюкоза, генерируя энергию.[5] Здесь гемоглобин связывается с углекислый газ, образуется при окислении глюкозы, которая транспортируется по венам гемоглобином (преимущественно в виде бикарбонат анионы) обратно в легкие, где он выдыхается.[139] В гемоглобине железо находится в одном из четырех гем групп и имеет шесть возможных координационных площадок; четыре заняты атомами азота в порфирин кольцо, пятое имидазол азот в гистидин Остаток одной из белковых цепей присоединен к гемовой группе, а шестой зарезервирован для молекулы кислорода, с которой он может обратимо связываться.[139] Когда гемоглобин не присоединен к кислороду (и тогда его называют дезоксигемоглобином), Fe2+ ион в центре гем группа (внутри гидрофобного белка) находится в высокоспиновой конфигурации. Таким образом, оно слишком велико, чтобы поместиться внутри порфиринового кольца, которое вместо этого изгибается в купол с Fe.2+ ion примерно на 55 пикометров выше. В этой конфигурации шестой координационный центр, зарезервированный для кислорода, заблокирован другим остатком гистидина.[139]
Когда дезоксигемоглобин захватывает молекулу кислорода, этот остаток гистидина удаляется и возвращается, как только кислород надежно присоединяется, чтобы сформировать водородная связь с этим. Это приводит к Fe2+ переключение иона на низкоспиновую конфигурацию, что приводит к уменьшению ионного радиуса на 20%, так что теперь он может поместиться в порфириновое кольцо, которое становится плоским.[139] (Кроме того, эта водородная связь приводит к наклону молекулы кислорода, в результате чего валентный угол Fe – O – O составляет около 120 °, что позволяет избежать образования Fe – O – Fe или Fe – O2–Fe мостики, которые привели бы к переносу электрона, окислению Fe2+ в Fe3+(и разрушение гемоглобина). Это приводит к перемещению всех белковых цепей, что приводит к изменению формы других субъединиц гемоглобина на форму с большим сродством к кислороду. Таким образом, когда дезоксигемоглобин поглощает кислород, его сродство к большему количеству кислорода увеличивается, и наоборот.[139] Миоглобин, с другой стороны, содержит только одну гемовую группу, и, следовательно, этот кооперативный эффект не может возникнуть. Таким образом, хотя гемоглобин почти насыщен кислородом при высоких парциальных давлениях кислорода в легких, его сродство к кислороду намного ниже, чем у миоглобина, который насыщает кислородом даже при низких парциальных давлениях кислорода в мышечной ткани.[139] Как описано в Эффект Бора (названный в честь Кристиан Бор, отец Нильс Бор) сродство гемоглобина к кислороду уменьшается в присутствии диоксида углерода.[139]

Монооксид углерода и трифторид фосфора ядовиты для людей, потому что они связываются с гемоглобином так же, как с кислородом, но с гораздо большей силой, так что кислород больше не может транспортироваться по телу. Гемоглобин, связанный с оксидом углерода, известен как карбоксигемоглобин. Этот эффект также играет незначительную роль в токсичности цианид, но главный эффект заключается в его вмешательстве в правильное функционирование белка-транспортера электронов цитохрома а.[139] Белки цитохрома также включают гемовые группы и участвуют в метаболическом окислении глюкозы кислородом. В этом случае шестой координационный центр занимает либо другой имидазольный азот, либо метионин серы, так что эти белки в значительной степени инертны по отношению к кислороду - за исключением цитохрома а, который непосредственно связывается с кислородом и поэтому очень легко отравляется цианидом.[139] Здесь перенос электрона происходит, когда железо остается в низком спине, но изменяется между состояниями окисления +2 и +3. Поскольку потенциал восстановления на каждом этапе немного больше, чем на предыдущем, энергия высвобождается постепенно и, таким образом, может храниться в аденозинтрифосфат. Цитохром а немного отличается, так как он находится на митохондриальной мембране, непосредственно связывается с кислородом и переносит протоны, а также электроны, следующим образом:[139]
- 4 Cytc2+ + O2 + 8H+
внутри → 4 Cytc3+ + 2 часа2O + 4H+
за пределами
Хотя гемовые белки являются наиболее важным классом железосодержащих белков, железо-серные белки также очень важны, так как участвуют в переносе электронов, что возможно, поскольку железо может стабильно существовать в степенях окисления +2 или +3. Они имеют один, два, четыре или восемь атомов железа, каждый из которых приблизительно тетраэдрически координирован с четырьмя атомами серы; из-за этой тетраэдрической координации в них всегда есть высокоспиновое железо. Самым простым из таких составов является рубредоксин, в котором только один атом железа координирован с четырьмя атомами серы из цистеин остатки в окружающих пептидных цепях. Другой важный класс железо-серных белков - это ферредоксины, которые имеют несколько атомов железа. Трансферрин не принадлежит ни к одному из этих классов.[139]
Способность моря моллюски удерживать их на скалах в океане облегчается их использование металлоорганический связи на основе железа в их богатых белком кутикула. На основе синтетических реплик присутствие железа в этих структурах увеличилось. модуль упругости 770 раз, предел прочности 58 раз и стойкость 92 раза. Количество стресса, необходимого для их постоянного повреждения, увеличилось в 76 раз.[151]
Питание
Рацион питания
Железо широко распространено, но особенно богатые источники пищевого железа включают: красное мясо, устрицы, чечевица, бобы, домашняя птица, рыбы, листовые овощи, кресс-салат, тофу, нут, спаржевая фасоль, и черная патока.[5] Хлеб и Хлопья на завтрак иногда специально обогащены железом.[5][152]
Утюг предоставлен пищевые добавки часто встречается как фумарат железа (II), несмотря на то что сульфат железа (II) дешевле и одинаково хорошо усваивается.[135] Элементарное железо, или восстановленное железо, несмотря на то, что абсорбируется на уровне от одной трети до двух третей эффективности (по сравнению с сульфатом железа),[153] часто добавляют в такие продукты, как хлопья для завтрака или обогащенную пшеничную муку. Железо наиболее доступно для организма, когда хелатный к аминокислотам[154] а также доступен для использования как обычный добавка железа. Глицин, наименее дорогая аминокислота, чаще всего используется для производства добавок глицината железа.[155]
Диетические рекомендации
Институт медицины США (IOM) обновил ориентировочные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для железа в 2001 году.[5] В настоящее время EAR для женщин в возрасте 14–18 лет составляет 7,9 мг / день, 8,1 мг для возраста 19–50 лет и 5,0 мг в последующий период (после менопаузы). Для мужчин EAR составляет 6,0 мг / день в возрасте от 19 лет и старше. Рекомендуемая суточная норма составляет 15,0 мг / день для женщин в возрасте 15–18 лет, 18,0 мг для женщин 19–50 лет и 8,0 в последующем. Для мужчин: 8,0 мг / день в возрасте от 19 лет и старше. RDA выше, чем EAR, чтобы определить суммы, которые покроют людей с потребностями выше среднего. Рекомендуемая суточная суточная норма для беременности составляет 27 мг / день, а при кормлении грудью - 9 мг / день.[5] Для детей в возрасте 1-3 лет - 7 мг / день, 10 - в возрасте 4-8 лет и 8 - в возрасте 9-13 лет. Что касается безопасности, МОМ также устанавливает Допустимые верхние уровни потребления (UL) для витаминов и минералов, когда доказательств достаточно. В случае железа верхний предел установлен на уровне 45 мг / день. В совокупности EAR, RDA и UL именуются Рекомендуемая диета.[156]
В Европейское агентство по безопасности пищевых продуктов (EFSA) относится к совокупному набору информации как диетические контрольные значения, с контрольным потреблением населения (PRI) вместо RDA и средним потреблением вместо EAR. AI и UL определены так же, как в США. Для женщин в возрасте 15-17 лет PRI составляет 13 мг / день, для женщин в возрасте 18 лет и старше в пременопаузе и 11 мг / день в постменопаузе - 16 мг / день. При беременности и кормлении грудью - 16 мг / сут. Для мужчин PRI составляет 11 мг / день в возрасте от 15 лет и старше. Для детей в возрасте от 1 до 14 лет PRI увеличивается с 7 до 11 мг / день. PRI выше, чем RDA в США, за исключением беременности.[157] EFSA рассмотрело тот же вопрос безопасности, не установив UL.[158]
Младенцам могут потребоваться добавки железа, если они получают коровье молоко из бутылочки.[159] Частый доноры крови подвержены риску низкого уровня железа, и им часто советуют увеличить потребление железа.[160]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% DV). Для целей маркировки железа 100% дневной нормы составляло 18 мг, и по состоянию на 27 мая 2016 г.[Обновить] не изменилась и составила 18 мг.[161][162] Соблюдение обновленных правил маркировки требовалось к 1 января 2020 года для производителей с годовым объемом продаж продуктов питания 10 миллионов долларов США и более и к 1 января 2021 года для производителей с годовым объемом продаж продуктов питания менее 10 миллионов долларов США.[163][164][165] В течение первых шести месяцев после даты соответствия 1 января 2020 года FDA планирует сотрудничать с производителями, чтобы соответствовать новым требованиям к этикеткам Nutrition Facts, и не будет сосредоточиваться на принудительных мерах в отношении этих требований в течение этого времени.[163] Таблица старых и новых дневных значений для взрослых представлена на сайте Эталонное суточное потребление.
Дефицит
Дефицит железа - самый распространенный недостаток питания в мире.[5][166][167][168] Когда потеря железа не компенсируется адекватным потреблением железа с пищей, состояние скрытый дефицит железа происходит, что со временем приводит к железодефицитная анемия при отсутствии лечения, который характеризуется недостаточным количеством эритроцитов и недостаточным количеством гемоглобина.[169] Дети, пременопаузальный Наиболее подвержены заболеванию женщины (женщины детородного возраста) и люди с плохим питанием. В большинстве случаев железодефицитная анемия протекает в легкой форме, но, если ее не лечить, она может вызвать такие проблемы, как быстрое или нерегулярное сердцебиение, осложнения во время беременности и задержку роста у младенцев и детей.[170]
Избыток
Поглощение железа строго регулируется человеческим телом, у которого нет регулируемых физиологических средств выделения железа. Ежедневно теряется лишь небольшое количество железа из-за слущивания эпителиальных клеток слизистых оболочек и кожи, поэтому контроль уровня железа в первую очередь достигается за счет регулирования поглощения.[171] Регуляция усвоения железа у некоторых людей нарушена в результате генетический дефект который отображается в области гена HLA-H на хромосома 6 и приводит к аномально низкому уровню гепсидин, ключевой регулятор поступления железа в систему кровообращения у млекопитающих.[172] У этих людей чрезмерное потребление железа может привести к нарушения перегрузки железом, известный в медицине как гемохроматоз.[5] Многие люди имеют недиагностированную генетическую предрасположенность к перегрузке железом и не знают семейного анамнеза этой проблемы. По этой причине людям не следует принимать добавки железа, если они не страдают от недостаток железа и обратились к врачу. Гемохроматоз считается причиной от 0,3 до 0,8% всех болезней обмена веществ у кавказцев.[173]
Передозировка проглоченного железа может вызвать чрезмерный уровень свободного железа в крови. Высокий уровень свободного двухвалентного железа в крови реагирует с перекиси производить высокореактивные свободные радикалы это может повредить ДНК, белки, липиды, и другие клеточные компоненты. Токсичность железа возникает, когда клетка содержит свободное железо, что обычно возникает, когда уровень железа превышает доступность трансферрин связать утюг. Повреждение клеток желудочно-кишечный тракт может также помешать им регулировать всасывание железа, что приведет к дальнейшему повышению уровня в крови. Железо обычно повреждает клетки в сердце, печень и в других местах, вызывая побочные эффекты, в том числе кома, Метаболический ацидоз, шок, отказ печени, коагулопатия, респираторный дистресс-синдром у взрослых, длительное повреждение органов и даже смерть.[174] Люди испытывают отравление железом, когда содержание железа превышает 20 миллиграммов на каждый килограмм массы тела; 60 миллиграммов на килограмм считается смертельная доза.[175] Чрезмерное потребление железа, часто в результате употребления детьми большого количества сульфат железа Таблетки, предназначенные для употребления взрослыми, являются одной из наиболее частых токсикологических причин смерти детей до шести лет.[175] В Рекомендуемая диета (DRI) устанавливает максимально допустимый уровень потребления (UL) для взрослых на уровне 45 мг / день. Для детей до четырнадцати лет UL составляет 40 мг / день.[176]
Медикаментозное лечение отравления железом сложно и может включать использование специфических хелатирующий агент позвонил дефероксамин связать и изгнать лишнее железо из организма.[174][177][178]
Рак
Роль железа в защите от рака может быть описана как «палка о двух концах» из-за его повсеместного присутствия в непатологических процессах.[179] Люди, имеющие химиотерапия может развиться дефицит железа и анемия, для которого внутривенный терапия железом используется для восстановления уровня железа.[180] Перегрузка железом, которая может возникнуть из-за большого потребления красного мяса,[5] может инициировать опухоль рост и повышение предрасположенности к развитию рака,[180] особенно для колоректальный рак.[5]
Смотрите также
- Эль-Мутун в Боливии, где находится 10% доступной в мире железной руды
- Наночастица железа
- Железо-платиновые наночастицы
- Удобрение железом - предложено удобрение океанов для стимулирования фитопланктон рост
- Железоокисляющие бактерии
- Список стран по производству чугуна
- Пеллетирование - процесс создания железорудных окатышей
- Нержавеющее железо
- Стали
- Железный цикл
Рекомендации
- ^ Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)». Чистая и прикладная химия. 88 (3): 265–91. Дои:10.1515 / pac-2015-0305.
- ^ Рам, Р. С. и Бернат, П. Ф. (2003). "Эмиссионная спектроскопия с преобразованием Фурье g4Δ-а4Δ система FeCl » (PDF). Журнал молекулярной спектроскопии. 221 (2): 261. Bibcode:2003JMoSp.221..261R. Дои:10.1016 / S0022-2852 (03) 00225-X.
- ^ Demazeau, G .; Buffat, B .; Pouchard, M .; Хагенмюллер, П. (1982). «Последние разработки в области высоких степеней окисления переходных элементов в стабилизации оксидов шестикоординированного железа (V)». Zeitschrift für anorganische und allgemeine Chemie. 491: 60–66. Дои:10.1002 / zaac.19824910109.
- ^ Lu, J .; Jian, J .; Huang, W .; Lin, H .; Ли, Дж; Чжоу, М. (2016). «Экспериментальная и теоретическая идентификация степени окисления Fe (VII) в FeO4–». Физическая химия Химическая физика. 18 (45): 31125–31131. Bibcode:2016PCCP ... 1831125L. Дои:10.1039 / C6CP06753K. PMID 27812577.
- ^ а б c d е ж грамм час я j k л м п о п q "Утюг". Информационный центр по микронутриентам, Институт Линуса Полинга, Государственный университет Орегона, Корваллис, Орегон. Апрель 2016 г.. Получено 6 марта 2018.
- ^ а б c d е ж грамм час Гринвуд и Эрншоу, стр. 1075–79.
- ^ Хиросе, К., Татено, С. (2010). «Структура железа во внутреннем ядре Земли». Наука. Американская ассоциация развития науки. 330 (6002): 359–361. Дои:10.1126 / science.1194662. PMID 20947762. S2CID 206528628.
- ^ Чамати, Гаминчев (2014). «Динамическая устойчивость Fe под высоким давлением». Журнал физики. IOP Publishing. 558 (1): 012013. Дои:10.1088/1742-6596/558/1/012013.
- ^ Бёлер, Рейнхард (2000). «Эксперименты при высоком давлении и фазовая диаграмма материалов нижней мантии и ядра». Обзоры геофизики. Американский геофизический союз. 38 (2): 221–45. Bibcode:2000RvGeo..38..221B. Дои:10.1029 / 1998RG000053. S2CID 33458168.
- ^ Стиксруд, Ларс; Вассерман, Евгений; Коэн, Рональд Э. (10 ноября 1997 г.). «Состав и температура внутреннего ядра Земли». Журнал геофизических исследований: твердая Земля. 102 (B11): 24729–39. Bibcode:1997JGR ... 10224729S. Дои:10.1029 / 97JB02125.
- ^ Гринвуд и Эрншоу, стр. 1116
- ^ а б c d е ж Гринвуд и Эрншоу, стр. 1074–75.
- ^ Бёлер, Рейнхард; Росс, М. (2007). «Свойства горных пород и минералов. Плавление при высоком давлении». Минеральная физика. Трактат по геофизике. 2. Эльзевир. С. 527–41. Дои:10.1016 / B978-044452748-6.00047-X. ISBN 9780444527486.
- ^ Стейнмец, Чарльз (1917). «рис. 42». Теория и расчет электрических цепей. Макгроу-Хилл.
- ^ а б Cullity; К. Д. Грэм (2008). Введение в магнитные материалы, 2-е. Нью-Йорк: Wiley – IEEE. п. 116. ISBN 978-0-471-47741-9.
- ^ а б Bramfitt, B.L .; Бенскотер, Арлан О. (2002). «Фазовая диаграмма железа и углерода». Руководство металлографа: практика и процедуры для чугуна и стали. ASM International. С. 24–28. ISBN 978-0-87170-748-2.
- ^ а б Ауди, Жорж; Берсильон, Оливье; Blachot, Жан; Вапстра, Алдерт Хендрик (2003), "ТогдаUBASE оценка ядерных и распадных свойств », Ядерная физика A, 729: 3–128, Bibcode:2003НуФА.729 .... 3А, Дои:10.1016 / j.nuclphysa.2003.11.001
- ^ Rugel, G .; Faestermann, T .; Knie, K .; Корщинек, Г .; Путивцев, М .; Schumann, D .; Kivel, N .; Гюнтер-Леопольд, I .; Weinreich, R .; Вольмутер, М. (2009). "Новое измерение 60Fe Half-Life ". Письма с физическими проверками. 103 (7): 072502. Bibcode:2009ПхРвЛ.103г2502Р. Дои:10.1103 / PhysRevLett.103.072502. PMID 19792637.
- ^ Dauphas, N .; Руссель, О. (2006). «Масс-спектрометрия и естественные вариации изотопов железа» (PDF). Обзоры масс-спектрометрии. 25 (4): 515–50. Bibcode:2006MSRv ... 25..515D. Дои:10.1002 / mas.20078. PMID 16463281. Архивировано из оригинал (PDF) 10 июня 2010 г.
- ^ Mostefaoui, S .; Lugmair, G.W .; Hoppe, P .; Эль Гореси, А. (2004). «Доказательства наличия 60Fe в метеоритах». Новые обзоры астрономии. 48 (1–4): 155–59. Bibcode:2004Новый..48..155M. Дои:10.1016 / j.newar.2003.11.022.
- ^ Фьюэлл, М. П. (1995). «Атомный нуклид с самой высокой средней энергией связи». Американский журнал физики. 63 (7): 653. Bibcode:1995AmJPh..63..653F. Дои:10.1119/1.17828.
- ^ а б c Гринвуд и Эрншоу, стр. 12
- ^ Woosley, S .; Янка, Т. (2006). «Физика сверхновых с коллапсом ядра». Природа Физика. 1 (3): 147–54. arXiv:Astro-ph / 0601261. Bibcode:2005 НатФ ... 1..147Вт. Дои:10.1038 / nphys172. S2CID 118974639.
- ^ McDonald, I .; Sloan, G.C .; Zijlstra, A. A .; Matsunaga, N .; Мацуура, М .; Kraemer, K. E .; Bernard-Salas, J .; Марквик, А. Дж. (2010). «Ржавые старые звезды: источник пропавшего межзвездного железа?». Письма в астрофизический журнал. 717 (2): L92 – L97. arXiv:1005.3489. Bibcode:2010ApJ ... 717L..92M. Дои:10.1088 / 2041-8205 / 717/2 / L92. S2CID 14437704.
- ^ Баутиста, Мануэль А .; Прадхан, Анил К. (1995). «Содержание железа и никеля в областях H ~ II и остатки сверхновых». Бюллетень Американского астрономического общества. 27: 865. Bibcode:1995AAS ... 186.3707B.
- ^ Дайсон, Фриман Дж. (1979). «Время без конца: физика и биология в открытой вселенной». Обзоры современной физики. 51 (3): 447–60. Bibcode:1979РвМП ... 51..447Д. Дои:10.1103 / RevModPhys.51.447.
- ^ Арон, Джейкоб. «Космические пули сверхновой звезды могли засеять железное ядро Земли». Новый ученый. Получено 2 октября 2020.
- ^ Бухвальд, В. Ф. (1992). «Об использовании железа эскимосами в Гренландии». Характеристики материалов. 29 (2): 139–176. Дои:10.1016 / 1044-5803 (92) 90112-У.
- ^ Эмилиани, Чезаре (1992). Планета Земля: космология, геология, эволюция жизни и окружающей среды. Издательство Кембриджского университета. п. 152. Bibcode:1992pecg.book ..... E. ISBN 978-0-521-40949-0.
- ^ Pernet-Fisher, J .; Дэй, J.M.D .; Howarth, G.H .; Рябов, В.В .; Тейлор, Л.А. (2017). «Атмосферная дегазация и образование самородного железа во время взаимодействий углеродистых отложений и базальтового расплава». Письма по науке о Земле и планетах. 460: 201–212. Дои:10.1016 / j.epsl.2016.12.022.
- ^ Старк, Энн М. (2007-09-20) Исследователи обнаруживают зону спинового перехода мантии, что позволяет понять строение Земли.. Национальная лаборатория Лоуренса Ливермора
- ^ Ферропериклаз. Mindat.org
- ^ Мураками, М .; Ohishi Y .; Hirao N .; Хиросе К. (2012). «Перовскитовая нижняя мантия, выведенная из данных о скорости звука при высоком давлении и высокой температуре». Природа. 485 (7396): 90–94. Bibcode:2012Натура 485 ... 90 млн. Дои:10.1038 / природа11004. PMID 22552097. S2CID 4387193.
- ^ Шарп, Т. (27 ноября 2014 г.). «Бриджманит - наконец-то назван». Наука. 346 (6213): 1057–58. Bibcode:2014Наука ... 346.1057S. Дои:10.1126 / science.1261887. PMID 25430755. S2CID 206563252.
- ^ Kong, L.T .; Li, J. F .; Shi, Q.W .; Huang, H.J .; Чжао, К. (6 марта 2012 г.). «Динамическая стабильность железа в условиях высоких температур и высокого давления». EPL. 97 (5): 56004п1–56004п5. Дои:10.1209/0295-5075/97/56004.
- ^ Гаминчев, К. Г .; Чамати, Х. (3 декабря 2014 г.). «Динамическая устойчивость Fe под высоким давлением». J. Phys. 558: 012013(1-7). Дои:10.1088/1742-6596/558/1/012013.
- ^ Морган, Джон В. и Андерс, Эдвард (1980). «Химический состав Земли, Венеры и Меркурия». Proc. Natl. Акад. Sci. 77 (12): 6973–77. Bibcode:1980ПНАС ... 77.6973М. Дои:10.1073 / pnas.77.12.6973. ЧВК 350422. PMID 16592930.
- ^ «Пирротин». Mindat.org. Получено 7 июля 2009.
- ^ Кляйн, Корнелис и Корнелиус С. Херлбут-младшие (1985) Руководство по минералогии, Wiley, 20-е изд., Стр. 278–79. ISBN 0-471-80580-7
- ^ а б Гринвуд и Эрншоу, стр. 1071
- ^ Lyons, T. W .; Рейнхард, К. Т. (2009). «Ранняя Земля: кислород для поклонников хэви-метала». Природа. 461 (7261): 179–181. Bibcode:2009Натура.461..179л. Дои:10.1038 / 461179a. PMID 19741692. S2CID 205049360.
- ^ Облако, П. (1973). «Палеоэкологическое значение полосчатой железной формации». Экономическая геология. 68 (7): 1135–43. Дои:10.2113 / gsecongeo.68.7.1135.
- ^ Дикинсон, Роберт Э. (1964).Германия: региональная и экономическая география (2-е изд.). Лондон: Метуэн.
- ^ Naturwerksteine в земле Баден-Вюртемберг. Landesamt für Geologie, Rohstoffe und Bergbau, Баден-Вюртемберг
- ^ «Сказки с берега реки». Сохранение камня Минервы. Получено 22 сентября 2015.
- ^ Klingelhöfer, G .; Моррис, Р. В .; Соуза, П. А .; Родионов, Д .; Шредер, К. (2007). «Два земных года мессбауэровских исследований поверхности Марса с помощью MIMOS II». Сверхтонкие взаимодействия. 170 (1–3): 169–77. Bibcode:2006HyInt.170..169K. Дои:10.1007 / s10751-007-9508-5. S2CID 98227499.
- ^ Запасы металлов в обществе: научный синтез, 2010, Международная панель ресурсов, ЮНЕП
- ^ Гринвуд и Эрншоу, стр. 905
- ^ а б Гринвуд и Эрншоу, стр. 1070
- ^ Хуанг, Вэй; Сюй, Вэнь-Хуа; Schwarz, W.H.E .; Ли, июн (2 мая 2016 г.). «О высших степенях окисления металлических элементов в МО.4 Молекулы (M = Fe, Ru, Os, Hs, Sm и Pu) ». Неорганическая химия. 55 (9): 4616–25. Дои:10.1021 / acs.inorgchem.6b00442. PMID 27074099.
- ^ Лу, Джун-Бо; Цзянь, Цзивэнь; Хуанг, Вэй; Линь, Хайлу; Ли, Цзюнь; Чжоу Минфэй (16 ноября 2016 г.). «Экспериментальное и теоретическое определение степени окисления Fe (VII) в FeO.4−". Phys. Chem. Chem. Phys. 18 (45): 31125–31131. Bibcode:2016PCCP ... 1831125L. Дои:10.1039 / c6cp06753k. PMID 27812577.
- ^ Нам, Вону (2007). «Высоковалентное железо (IV) –оксокомплексы гемовых и негемовых лигандов в реакциях оксигенации» (PDF). Отчеты о химических исследованиях. 40 (7): 522–531. Дои:10.1021 / ar700027f. PMID 17469792.
- ^ а б c d е ж Холлеман, Арнольд Ф .; Виберг, Эгон; Виберг, Нильс (1985). "Утюг". Lehrbuch der Anorganischen Chemie (на немецком языке) (91–100 изд.). Вальтер де Грюйтер. С. 1125–46. ISBN 3-11-007511-3.
- ^ Рейфф, Уильям Майкл; Лонг, Гэри Дж. (1984). «Мессбауэровская спектроскопия и координационная химия железа». Мессбауэровская спектроскопия в неорганической химии. Springer. С. 245–83. ISBN 978-0-306-41647-7.
- ^ Уэр, Майк (1999). «Введение в монохромном». Цианотипия: история, наука и искусство фотопечати берлинской лазурью. ООО «НМСИ Трейдинг» с. 11–19. ISBN 978-1-900747-07-3.
- ^ Гмелин, Леопольд (1852). «Меркурий и железо». Справочник по химии. 6. Кавендишское общество. С. 128–29.
- ^ а б c Гринвуд и Эрншоу, стр. 1079
- ^ а б c d Гринвуд и Эрншоу, стр. 1082–84.
- ^ а б c d е Гринвуд и Эрншоу, стр. 1088–91.
- ^ а б c Гринвуд и Эрншоу, стр. 1091–97.
- ^ Clausen, C.A .; Хорошо, M.L. (1968). «Стабилизация аниона гексахлорферрата (III) катионом метиламмония». Неорганическая химия. 7 (12): 2662–63. Дои:10.1021 / ic50070a047.
- ^ James, B.D .; Бакалова, М .; Lieseganga, J .; Reiff, W.M .; Hockless, D.C.R .; Skelton, B.W .; Уайт, A.H. (1996). «Анион гексахлорферрата (III), стабилизированный в водородных упаковках. Сравнение рентгеновских кристаллических структур и низкотемпературного магнетизма тетракис (метиламмония) гексахлорферрата (III) хлорида (Я) и тетракис (гексаметилендиаммоний) гексахлорферрат (III) тетрахлорферрат (III) тетрахлорид (II)". Неорганика Chimica Acta. 247 (2): 169–74. Дои:10.1016 / 0020-1693 (95) 04955-Х.
- ^ Giannoccaro, P .; Сакко, А. (1977). Бис [этиленбис (дифенилфосфин)] -водородные комплексы. Неорг. Synth. Неорганические синтезы. 17. С. 69–72. Дои:10.1002 / 9780470132487.ch19. ISBN 978-0-470-13248-7.
- ^ Lee, J .; Jung, G .; Ли, С. (1998). «Структура транс-хлоргидридобис (дифенилфосфиноэтан) железа (II)». Бык. Korean Chem. Soc. 19 (2): 267–69. Дои:10.1007 / BF02698412. S2CID 35665289.
- ^ Этиго, Такуя; Кимата, Мицуёси (2008). "Монокристаллические рентгеноструктурные и спектроскопические исследования гумбольдтина и линдбергита: слабый эффект Яна – Теллера Fe2+ ион ». Phys. Chem. Минералы. 35 (8): 467–75. Bibcode:2008PCM .... 35..467E. Дои:10.1007 / s00269-008-0241-7. S2CID 98739882.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1984). Химия элементов. Оксфорд: Pergamon Press. С. 1282–86. ISBN 978-0-08-022057-4..
- ^ Кили, T.J .; Паусон, П. (1951). «Новый тип железоорганического соединения». Природа. 168 (4285): 1039–40. Bibcode:1951 г., природа. 168,1039K. Дои:10.1038 / 1681039b0. S2CID 4181383.
- ^ Miller, S.A .; Теббот, Дж. А .; Тремейн, Дж. Ф. (1952). «114. Дициклопентадиенилирон». J. Chem. Soc.: 632–635. Дои:10.1039 / JR9520000632.
- ^ Уилкинсон, Г.; Розенблюм, М .; Whiting, M.C .; Вудворд, Р. Б. (1952). «Структура бис-циклопентадиенила железа». Варенье. Chem. Soc. 74 (8): 2125–2126. Дои:10.1021 / ja01128a527.
- ^ Окуда, июн (28 декабря 2016 г.). «Ферроцен - 65 лет спустя». Европейский журнал неорганической химии. 2017 (2): 217–219. Дои:10.1002 / ejic.201601323. ISSN 1434-1948.
- ^ Гринвуд и Эрншоу, стр. 1104
- ^ Баллок, Р. (11 сентября 2007 г.). «Железный катализатор гидрирования кетонов в мягких условиях». Энгью. Chem. Int. Эд. 46 (39): 7360–63. Дои:10.1002 / anie.200703053. PMID 17847139.
- ^ «26 Утюг». Elements.vanderkrogt.net. Получено 12 сентября 2008.
- ^ Харпер, Дуглас (2001–2016). "ферро-". etymonline.com. Получено 7 августа 2016.
- ^ Харпер, Дуглас (2001–2016). "утюг". etymonline.com. Получено 7 августа 2016.
- ^ Гамкрелидзе, Томас В .; Иванов, Вячеслав В. (1995). Индоевропейцы и индоевропейцы: реконструкция и исторический анализ протоязыка и прото-культуры. Вальтер де Грюйтер. п. 615. ISBN 978-3-11-081503-0.
- ^ Чарльтон Т. Льюис; Чарльз Шорт (1879). Латинский словарь. Оксфорд: Clarendon Press.
- ^ Коблин, В. Юг (1986). Список китайско-тибетских лексических соответствий китаеведа. Серия монографий Monumenta Serica. 18. Неттеталь: Стейлер.
- ^ 1988, 国語 大 辞典 (新装 大) (Кокуго Дай Дзитэн, исправленное издание) (на японском языке), Tkyō: Shogakukan
- ^ Недели 1968, п. 4.
- ^ а б Недели 1968, п. 29.
- ^ а б c Недели 1968, п. 31.
- ^ Бьоркман, Джудит Кингстон (1973). «Метеоры и метеориты на древнем Ближнем Востоке». Метеоритика. 8 (2): 91–132. Дои:10.1111 / j.1945-5100.1973.tb00146.x.
- ^ Комелли, Даниэла; д'Орацио, Массимо; Фолько, Луиджи; Эль-Халваги, Махмуд; Фриззи, Томмазо; Альберти, Роберто; Капогроссо, Валентина; Эльнаггар, Абдельразек; Хасан, Хала; Невин, Остин; Порселли, Франко; Рашед, Мохамед Дж. Валентини, Джанлука (2016). «Метеоритное происхождение лезвия железного кинжала Тутанхамона». Метеоритика и планетология. 51 (7): 1301–09. Bibcode:2016M & PS ... 51.1301C. Дои:10.1111 / maps.12664.
- ^ Уолш, Деклан (2 июня 2016 г.). «Кинжал Тутанхамона, сделанный из« Железа с неба », - говорят исследователи». Нью-Йорк Таймс. Получено 4 июн 2016.
Состав лезвия из железа, никеля и кобальта примерно соответствовал метеориту, упавшему в северном Египте. Результат «убедительно свидетельствует о внеземном происхождении».
- ^ Юре, Эндрю (1843). Technisches wörterbuch oder Handbuch der Gewerbskunde ...: Bearb. nach Словарь искусств, производств и шахт доктора Эндрю Юра (на немецком). Г. Хаазе. п. 492.
- ^ а б c d Недели 1968, п. 32.
- ^ МакНатт, Паула (1990 1). Ковка Израиля: технология железа, символизм и традиции в древнем обществе. A&C Black.
- ^ Тевари, Ракеш. «Истоки обработки железа в Индии: новые свидетельства из равнины Центральной Ганги и восточных виндхий» (PDF). Государственный археологический департамент. Получено 23 мая 2010.
- ^ Фото Э. (1989). «Вопрос о метеоритном или плавленом железе с высоким содержанием никеля: археологические свидетельства и экспериментальные результаты». Мировая археология. Taylor & Francis, Ltd. 20 (3): 403–21. Дои:10.1080/00438243.1989.9980081. JSTOR 124562.
- ^ Мухли, Джеймс Д. (2003). «Металлообработка / Горное дело в Леванте». В Лейк, Ричард Вайнона (ред.). Ближневосточная археология IN: Eisenbrauns. 180. С. 174–83.
- ^ Витцель, Майкл (2001), "Автохтонные арийцы? Свидетельства из древнеиндийских и иранских текстов", в Электронный журнал ведических исследований (EJVS) 7-3, стр. 1–93
- ^ Недели, стр. 33, цитируя Клайна, Уолтера (1937) «Горнодобывающая и металлургическая промышленность в негритянской Африке», издательство George Banta Publishing Co., Менаша, Висконсин, стр. 17–23.
- ^ Ридерер, Йозеф; Вартке, Ральф-Б. (2009) «Железо», Канчик, Хуберт; Шнайдер, Гельмут (ред.): Новый Поли Брилла, Брилл.
- ^ Крэддок, Пол Т. (2008): «Горное дело и металлургия», в: Олесон, Джон Питер (ред.): Оксфордский справочник инженерии и технологий в классическом мире, Издательство Оксфордского университета, ISBN 978-0-19-518731-1, п. 108
- ^ Вагнер, Дональд Б. (2001) «Государство и металлургическая промышленность в ханьском Китае», NIAS Publishing, Копенгаген, ISBN 87-87062-77-1, п. 73
- ^ Сойер, Ральф Д. и Сойер, Мей-чюн (1993). Семь военных классиков Древнего Китая. Боулдер: Вествью. ISBN 0-465-00304-4. п. 10.
- ^ Пиготт, Винсент С. (1999). Археометаллургия азиатского Старого Света. Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0, п. 8.
- ^ Голас, Питер Дж. (1999). Наука и цивилизация в Китае: Том 5, Химия и химическая технология, Часть 13, Горное дело. Издательство Кембриджского университета. п. 152. ISBN 978-0-521-58000-7.
самая ранняя доменная печь, обнаруженная в Китае примерно с первого века нашей эры
- ^ Пиготт, Винсент С. (1999). Археометаллургия азиатского Старого Света. Филадельфия: Музей археологии и антропологии Пенсильванского университета. ISBN 0-924171-34-0, п. 191.
- ^ Наступление эпохи стали. Brill Archive. 1961. с. 54.
- ^ Мотт, Р.А. (2014). «Сухая и мокрая лужа». Сделки Общества Ньюкоменов. 49: 156–57. Дои:10.1179 / тнс.1977.011.
- ^ Вагнер, Дональд Б. (2003). «Китайские домны с 10 по 14 века» (PDF). Историческая металлургия. 37 (1): 25–37. Архивировано из оригинал (PDF) 7 января 2018 г.. Получено 7 января 2018. первоначально опубликовано в Вагнер, Дональд Б. (2001). «Китайские домны 10-14 веков». Западноазиатская наука, технологии и медицина. 18: 41–74. Дои:10.1163/26669323-01801008.
- ^ Джаннихедда, Энрико (2007): «Металлургия в поздней античности», в Технологии переходного периода 300–650 гг. Нашей эры Лаван, Л .; Занини, Э. и Сарантис, А. (ред.), Брилл, Лейден; ISBN 90-04-16549-5, п. 200.
- ^ а б c d е ж грамм Биддл, Верн; Паркер, Грегори. Химия, точность и дизайн. A Beka Book, Inc.
- ^ Вагнер, Дональд Б. (1993). Железо и сталь в Древнем Китае. Брилл. С. 335–340. ISBN 978-90-04-09632-5.
- ^ а б c d Гринвуд и Эрншоу, стр. 1072
- ^ Шивельбуш Г. (1986) Путешествие по железной дороге: индустриализация и восприятие времени и пространства в XIX веке. Оксфорд: Берг.
- ^ Шпёрл, Джозеф С. Краткая история производства чугуна и стали В архиве 2 июня 2010 г. Wayback Machine. Колледж Святого Ансельма
- ^ Энгхаг, Пер (8 января 2008 г.). Энциклопедия элементов: Технические данные - История - Обработка - Применение. С. 190–91. ISBN 978-3-527-61234-5.
- ^ Уитакер, Роберт Д. (1975). «Историческая справка о сохранении массы». Журнал химического образования. 52 (10): 658. Bibcode:1975JChEd..52..658W. Дои:10.1021 / ed052p658.
- ^ Фонтенроуз, Джозеф (1974). «Работа, справедливость и пять веков Гесиода». Классическая филология. 69 (1): 1–16. Дои:10.1086/366027. JSTOR 268960. S2CID 161808359.
- ^ Шмидт, Ева (1981) Der preußische Eisenkunstguss. (Искусство прусского чугуна) Technik, Geschichte, Werke, Künstler. Верлаг Манн, Берлин, ISBN 3-7861-1130-8
- ^ Люкс, Х. (1963) "Металлическое железо" в Справочник по препаративной неорганической химии, 2-е изд. Г. Брауэр (редактор), Academic Press, NY. Vol. 2. С. 1490–91.
- ^ Статистический ежегодник 2010 г.. Всемирная ассоциация производителей стали
- ^ а б c d е ж грамм Гринвуд и Эрншоу, стр. 1073
- ^ Сун Инсин (1637): Тиангун Кайу энциклопедия.
- ^ Верховен, Дж. Д. (1975) Основы физического металлургии, Wiley, New York, p. 326
- ^ Гринвуд и Эрншоу, стр. 1070–71.
- ^ а б Коль, Уолтер Х. (1995). Справочник материалов и техники для вакуумных устройств. Springer. С. 164–67. ISBN 1-56396-387-6.
- ^ а б Кун, Ховард; Медлин, Дана; и др., ред. (2000). Справочник ASM - Механические испытания и оценка (PDF). 8. ASM International. п. 275. ISBN 0-87170-389-0.
- ^ «Таблица преобразования твердости». Метрики Мэриленда. Архивировано 18 июня 2015 года.. Получено 23 мая 2010.CS1 maint: BOT: статус исходного URL-адреса неизвестен (связь)
- ^ Такадзи, Кусакава; Тошикацу, Отани (1964). "Свойства различных видов чистого железа: исследование чистого железа I". Тецу-то-Хагане. 50 (1): 42–47. Дои:10.2355 / tetsutohagane1955.50.1_42.
- ^ Рагхаван, В. (2004). Материаловедение и инженерия. PHI Learning Pvt. ООО п. 218. ISBN 81-203-2455-2.
- ^ Мартин, Джон Уилсон (2007). Краткая энциклопедия строения материалов. Эльзевир. п. 183. ISBN 978-0-08-045127-5.
- ^ а б Кэмп, Джеймс Макинтайр; Фрэнсис, Чарльз Блейн (1920). Производство, формовка и обработка стали. Питтсбург: Carnegie Steel Company. С. 173–74. ISBN 1-147-64423-3.
- ^ а б Смит, Уильям Ф .; Хашеми, Джавад (2006), Основы материаловедения и инженерии (4-е изд.), McGraw-Hill, p. 431, ISBN 0-07-295358-6.
- ^ а б «Классификация углеродистых и низколегированных сталей». Получено 5 января 2008.
- ^ HSLA Сталь, 15 ноября 2002 г., архивировано из оригинал 30 декабря 2009 г., получено 11 октября 2008.
- ^ Oberg, E .; и другие. (1996), «Справочник по машинам», Нью-Йорк: Промышленная пресса (25-е изд.), Industrial Press Inc: 440–42, Bibcode:1984мш..книга ..... Р
- ^ Rokni, Sayed H .; Коссэрт, Дж. Дональд; Лю, Джеймс С. (январь 2008 г.). «Радиационная защита на ускорителях электронов и протонов высоких энергий» (PDF). Получено 6 августа 2016.
- ^ а б c Гринвуд и Эрншоу, стр. 1076
- ^ Коласинский, Курт В. (2002). "Где важны гетерогенные реакции". Наука о поверхности: основы катализа и нанонауки. Джон Уайли и сыновья. С. 15–16. ISBN 978-0-471-49244-3.
- ^ МакКетта, Джон Дж. (1989). «Нитробензол и нитротолуол». Энциклопедия химической обработки и проектирования: Том 31 - Жидкости природного газа и природный бензин для морских технологических трубопроводов: высокоэффективные сплавы. CRC Press. С. 166–67. ISBN 978-0-8247-2481-8.
- ^ а б c Вильдермут, Эгон; Старк, Ганс; Фридрих, Габриэле; Эбенхох, Франц Людвиг; Кюборт, Бриджит; Сильвер, Джек; Ритупер, Рафаэль (2000). «Соединения железа». Энциклопедия промышленной химии Ульмана. Дои:10.1002 / 14356007.a14_591. ISBN 3-527-30673-0.
- ^ Страуд, Роберт (1933). Болезни канареек. Компания Canary Publishers. п. 203. ISBN 978-1-4465-4656-7.
- ^ Dlouhy, Adrienne C .; Ауттен, Кэрин Э. (2013). Банчи, Лючия (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. С. 241–78. Дои:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. ЧВК 3924584. PMID 23595675. электронная книга ISBN 978-94-007-5561-1
- ^ Йи, Гереон М .; Толмен, Уильям Б. (2015). Питер М. Кронек; Марта Э. Соса Торрес (ред.). Поддержание жизни на планете Земля: металлоферменты, усваивающие кислород и другие жевательные газы. Ионы металлов в науках о жизни. 15. Springer. С. 131–204. Дои:10.1007/978-3-319-12415-5_5. PMID 25707468.
- ^ а б c d е ж грамм час я j k л м п о п Гринвуд и Эрншоу, стр. 1098–104.
- ^ Lippard, S.J .; Берг, Дж. М. (1994). Принципы биоинорганической химии. Милл-Вэлли: университетские научные книги. ISBN 0-935702-73-3.
- ^ Kikuchi, G .; Yoshida, T .; Ногучи, М. (2005). «Гемоксигеназа и деградация гема». Сообщения о биохимических и биофизических исследованиях. 338 (1): 558–67. Дои:10.1016 / j.bbrc.2005.08.020. PMID 16115609.
- ^ Нейландс, Дж. Б. (1995). «Сидерофоры: структура и функции микробных транспортных соединений железа». Журнал биологической химии. 270 (45): 26723–26. Дои:10.1074 / jbc.270.45.26723. PMID 7592901.
- ^ Нейландс, Дж. Б. (1981). «Микробные соединения железа». Ежегодный обзор биохимии. 50 (1): 715–31. Дои:10.1146 / annurev.bi.50.070181.003435. PMID 6455965.
- ^ Бухалфа, Хаким; Крамблисс, Элвин Л. (2002). «Химические аспекты опосредованного сидерофором транспорта железа». БиоМеталлы. 15 (4): 325–39. Дои:10.1023 / А: 1020218608266. PMID 12405526. S2CID 19697776.
- ^ Nanami, M .; Ookawara, T .; Otaki, Y .; Ито, К .; Moriguchi, R .; Miyagawa, K .; Hasuike, Y .; Идзуми, М .; Eguchi, H .; Сузуки, К .; Наканиши, Т. (2005). "Фактор некроза опухоли-α-индуцированная секвестрация железа и окислительный стресс в эндотелиальных клетках человека". Артериосклероз, тромбоз и биология сосудов. 25 (12): 2495–501. Дои:10.1161 / 01.ATV.0000190610.63878.20. PMID 16224057.
- ^ Руо, Трейси А. (2003). «Как млекопитающие приобретают и распределяют железо, необходимое для кислородного метаболизма». PLOS Биология. 1 (3): e9. Дои:10.1371 / journal.pbio.0000079. ЧВК 300689. PMID 14691550.
- ^ Бун Э.М., Даунс А., Марси Д. «Предлагаемый механизм каталазы». Каталаза: H2О2: H2О2 Оксидоредуктаза: Учебное пособие по структуре каталазы. Получено 11 февраля 2007.
- ^ Бойингтон Дж. К., Гаффни Б. Дж., Амзель Л. М. (1993). «Трехмерная структура 15-липоксигеназы арахидоновой кислоты». Наука. 260 (5113): 1482–86. Bibcode:1993Научный ... 260.1482Б. Дои:10.1126 / science.8502991. PMID 8502991.
- ^ Gray, N.K .; Хенце, М.В. (август 1994 г.). «Регуляторный белок железа предотвращает связывание комплекса предварительной инициации трансляции 43S с ферритином и мРНК eALAS». EMBO J. 13 (16): 3882–91. Дои:10.1002 / j.1460-2075.1994.tb06699.x. ЧВК 395301. PMID 8070415.
- ^ Грегори Б. Васкес; Синьхуа Цзи; Клара Фронтичелли; Гэри Л. Гиллиланд (1998). «Карбоксигемоглобин человека с разрешением 2,2 Å: сравнение структуры и растворителей гемоглобинов R-состояния, R2 и T-состояния». Acta Crystallogr. D. 54 (3): 355–66. Дои:10.1107 / S0907444997012250. PMID 9761903.
- ^ Сандерсон, К. (2017). «Железная рукоятка мидий вдохновляет на прочный и эластичный полимер». Новости химии и машиностроения. Американское химическое общество. 95 (44): 8. Дои:10.1021 / cen-09544-notw3. Получено 2 ноября 2017.
- ^ Агентство по пищевым стандартам - Ешьте хорошо, будьте здоровы - Дефицит железа В архиве 8 августа 2006 г. Wayback Machine. Eatwell.gov.uk (5 марта 2012 г.). Проверено 27 июня 2012 года.
- ^ Hoppe, M .; Hulthén, L .; Холлберг, Л. (2005). «Относительная биодоступность у людей порошков элементарного железа для использования в обогащении пищевых продуктов». Европейский журнал питания. 45 (1): 37–44. Дои:10.1007 / s00394-005-0560-0. PMID 15864409. S2CID 42983904.
- ^ Pineda, O .; Эшмид, Х. Д. (2001). «Эффективность лечения железодефицитной анемии у младенцев и детей раннего возраста с хелатом бис-глицината железа». Питание. 17 (5): 381–4. Дои:10.1016 / S0899-9007 (01) 00519-6. PMID 11377130.
- ^ Эшмид, Х. ДеУэйн (1989). Беседы о хелатировании и минеральном питании. Китс Паблишинг. ISBN 0-87983-501-X.
- ^ Группа по микронутриентам Института медицины (США) (2001 г.). "Утюг" (PDF). Нормы потребления витамина А, витамина К, мышьяка, бора, хрома, меди, йода, железа, марганца, молибдена, никеля, кремния, ванадия и железа. Национальная академия прессы. С. 290–393. ISBN 0-309-07279-4. PMID 25057538.
- ^ «Обзор референсных значений рациона питания для населения ЕС, составленный группой EFSA по диетическим продуктам, питанию и аллергии» (PDF). Европейское агентство по безопасности пищевых продуктов. 2017.
- ^ «Допустимый верхний уровень потребления витаминов и минералов» (PDF). Европейское агентство по безопасности пищевых продуктов. 2006 г.
- ^ "Железодефицитная анемия". MediResource. Получено 17 декабря 2008.
- ^ Мильман, Н. (1996). «Ферритин сыворотки у датчан: исследования статуса железа от младенчества до старости, во время сдачи крови и беременности». Международный журнал гематологии. 63 (2): 103–35. Дои:10.1016/0925-5710(95)00426-2. PMID 8867722.
- ^ "Федеральный регистр, 27 мая 2016 г. Маркировка пищевых продуктов: пересмотр этикеток с указанием пищевых продуктов и добавок. FR страница 33982" (PDF).
- ^ «Справочник дневной нормы в базе данных этикеток пищевых добавок (DSLD)». База данных этикеток диетических добавок (DSLD). Получено 16 мая 2020.
- ^ а б «FDA предоставляет информацию о двойных столбцах на этикетке« Пищевая ценность »». НАС. Управление по контролю за продуктами и лекарствами (FDA). 30 декабря 2019 г.. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Изменения в этикетке с информацией о пищевой ценности». НАС. Управление по контролю за продуктами и лекарствами (FDA). 27 мая 2016. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «Отраслевые ресурсы об изменениях в этикетке с данными о пищевой ценности». НАС. Управление по контролю за продуктами и лекарствами (FDA). 21 декабря 2018 г.. Получено 16 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ Центры по контролю и профилактике заболеваний (2002 г.). «Дефицит железа - США, 1999–2000 гг.». MMWR. 51 (40): 897–99. PMID 12418542.
- ^ Hider, Роберт C .; Конг, Сяоле (2013). «Глава 8. Железо: эффект перегрузки и дефицита». У Астрид Сигель, Гельмута Сигеля и Роланда К.О. Сигель (ред.). Взаимосвязь между ионами эссенциальных металлов и заболеваниями человека. Ионы металлов в науках о жизни. 13. Springer. С. 229–94. Дои:10.1007/978-94-007-7500-8_8. PMID 24470094.
- ^ Dlouhy, Adrienne C .; Ауттен, Кэрин Э. (2013). «Глава 8.4 Поглощение, транспортировка и хранение железа». В Банчи, Лючия (ред.). Металломика и клетка. Ионы металлов в науках о жизни. 12. Springer. Дои:10.1007/978-94-007-5561-1_8. ISBN 978-94-007-5560-4. ЧВК 3924584. PMID 23595675. электронная книга ISBN 978-94-007-5561-1
- ^ Центры CDC по контролю и профилактике заболеваний (3 апреля 1998 г.). «Рекомендации по предотвращению и контролю дефицита железа в Соединенных Штатах». Еженедельный отчет о заболеваемости и смертности (MMWR). 47 (RR3): 1. Получено 12 августа 2014.
- ^ Центры по контролю и профилактике заболеваний. «Железо и дефицит железа». Получено 12 августа 2014.
- ^ Рамзи С. Котран; Винай Кумар; Такер Коллинз; Стэнли Леонард Роббинс (1999). Патологическая основа болезни Роббинса. Сондерс. ISBN 978-0-7216-7335-6. Получено 27 июн 2012.
- ^ Ганц Т. (август 2003 г.). «Гепсидин, ключевой регулятор метаболизма железа и медиатор анемии воспаления». Кровь. 102 (3): 783–8. Дои:10.1182 / кровь-2003-03-0672. PMID 12663437. S2CID 28909635.
- ^ Durupt, S .; Durieu, I .; Nové-Josserand, R .; Bencharif, L .; Rousset, H .; Витал Дюран, Д. (2000). «Наследственный гемохроматоз». Преподобный Мед Интерн. 21 (11): 961–71. Дои:10.1016 / S0248-8663 (00) 00252-6. PMID 11109593.
- ^ а б Cheney, K .; Gumbiner, C .; Benson, B .; Тененбейн, М. (1995). «Выживаемость после тяжелого отравления железом, леченная периодическими вливаниями дефероксамина». J Toxicol Clin Toxicol. 33 (1): 61–66. Дои:10.3109/15563659509020217. PMID 7837315.
- ^ а б «Токсичность, железо». Medscape. Получено 23 мая 2010.
- ^ Рекомендуемая диета (DRI): рекомендуемая доза для физических лиц (PDF), Совет по пищевым продуктам и питанию, Институт медицины, Национальные академии, 2004 г., архивировано с оригинал (PDF) 14 марта 2013 г., получено 9 июн 2009
- ^ Тененбейн, М. (1996). «Преимущества парентерального дефероксамина при остром отравлении железом». J Toxicol Clin Toxicol. 34 (5): 485–89. Дои:10.3109/15563659609028005. PMID 8800185.
- ^ Ву Х, Ву Т, Сюй Х, Ван Дж, Ван Дж (май 2011 г.). «Железная токсичность у мышей с внутримозговым кровоизлиянием, вызванным коллагеназой». J Cereb Blood Flow Metab. 31 (5): 1243–50. Дои:10.1038 / jcbfm.2010.209. ЧВК 3099628. PMID 21102602.
- ^ Тевенод, Франк (2018). «Глава 15. Железо и его роль в защите от рака: обоюдоострый меч». В Сигеле, Астрид; Сигель, Гельмут; Фрайзингер, Ева; Сигель, Роланд К. О. (ред.). Металло-препараты: разработка и действие противоопухолевых средств. Ионы металлов в науках о жизни. 18. Берлин: de Gruyter GmbH. С. 437–67. Дои:10.1515/9783110470734-021. PMID 29394034.
- ^ а б Бегин, Y; Аапро, М; Людвиг, H; Бизань, Л; Остерборг, А (2014). «Эпидемиологические и доклинические исследования влияния железа на канцерогенез - критический обзор». Критические обзоры в онкологии / гематологии. 89 (1): 1–15. Дои:10.1016 / j.critrevonc.2013.10.008. PMID 24275533.
Библиография
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Недели, Мэри Эльвира; Лейчестер, Генри М. (1968). «Элементы, известные древним». Открытие элементов. Истон, Пенсильвания: Журнал химического образования. стр.29–40. ISBN 0-7661-3872-0. LCCN 68-15217.
дальнейшее чтение
- Г. Р. Шуберт, История британской черной металлургии ... до 1775 года нашей эры (Рутледж, Лондон, 1957 г.)
- Р.Ф. Тилекот, История металлургии (Институт материалов, Лондон, 1992 г.).
- Р.Ф. Тайлекот, «Железо в промышленной революции» в J. Day и R.F. Тилекот, Промышленная революция в металлах (Институт материалов, 1991), 200–60.
внешняя ссылка
| Искать утюг в Викисловаре, бесплатном словаре. |
| Викискладе есть медиафайлы по теме Утюг. |
| Wikisource имеет текст 1905 г. Новая международная энциклопедия статья "Утюг". |
- Это элементаль - железо
- Утюг в Периодическая таблица видео (Ноттингемский университет)
- Металлургия для неметаллургов
- Утюг Дж. Б. Калверт