WikiDer > Nav1.8
Nav1.8 это ионный канал натрия подтип, который у человека кодируется SCN10A ген.[5][6][7][8]
Nav1.8-содержащие каналы тетродотоксин (TTX) -стойчивые к напряжению каналы. Nav1.8 выражается конкретно в ганглий дорсального корня (DRG), немиелинизированные, малого диаметра сенсорные нейроны называется C-волокна, и участвует в ноцицепция.[9][10] С-волокна могут активироваться вредными термическими или механическими раздражителями и, таким образом, могут нести боль Сообщения.
Конкретное расположение Nav1,8 в сенсорных нейронах DRG может сделать его ключевой терапевтической мишенью для разработки новых анальгетики[11] и лечение хроническая боль.[12]
Функция
Управляемые напряжением каналы ионов натрия (VGSC) необходимы для производства и распространения потенциалы действия. Тетродотоксин, токсин, содержащийся в рыба фугу, может блокировать некоторые VGSC и поэтому используется для различения различных подтипов. Есть три TTX-устойчивых VGSC: Nav1.5, Nav1.8 и Nav1.9. Nav1.8 и Nav1.9 выражены в ноцицепторы (чувствительные к повреждению нейроны). Nav1.7, Nav1.8 и Nav1.9 находятся в DRG и помогают облегчить хроническую воспалительную боль.[13] Nav1.8 представляет собой субъединицу канала α-типа, состоящую из четырех гомологичных доменов, каждый с шестью трансмембранными областями, один из которых является датчиком напряжения.
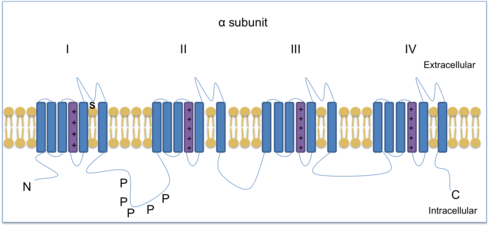
Зажим напряжения методы показали, что NaV1.8 является уникальным среди натриевых каналов тем, что демонстрирует относительно деполяризованную стационарную инактивацию. Таким образом, NaV1.8 остается доступным для работы, когда нейроны деполяризованы до уровней, которые инактивируют другие натриевые каналы. Зажим напряжения был использован, чтобы показать, как потенциалы действия в клетках DRG формируются с помощью натриевых каналов, устойчивых к ТТХ. Nav1.8 вносит наибольший вклад в поддержание повторяющихся высокочастотных потенциалов деполяризующей стадии действия в ноцицептивных сенсорных нейронах, потому что активируется быстро и остается активированным после обнаружения вредный раздражитель.[14][15] Следовательно, Nav1.8 способствует гипералгезия (повышенная чувствительность к боли) и аллодиния (боль от раздражителей, которые обычно не вызывают ее), которые являются элементами хронической боли.[16] Nav1.8 нокаутные мыши исследования показали, что канал связан с воспалительной и невропатической болью.[9][17][18] Кроме того, Nav1,8 играет решающую роль в боли от холода.[19] Снижение температуры с 30 ° C до 10 ° C замедляет активацию VGSC и, следовательно, снижает ток. Однако Nav1.8 устойчив к холоду и способен генерировать на холоде потенциалы действия для передачи информации от ноцицепторов к Центральная нервная система (ЦНС). Кроме того, Nav1.8-нулевые мыши не смогли произвести потенциалы действия, что указывает на то, что Nav1,8 важен для восприятия боли при низких температурах.[19]
Хотя ранние исследования биофизики NaVВ каналах грызунов было проведено 1,8 канала, в более поздних исследованиях изучались свойства человеческого NaV1,8 канала. Примечательно, что человеческий NaV1,8 канала демонстрируют зависимость от напряжения инактивации, которая даже более деполяризована, чем у грызунов, а также имеет более высокий постоянный ток.[20] Таким образом, влияние человеческого NaV1,8 канала возбуждения сенсорных нейронов могут быть даже больше, чем у грызунов NaV1,8 канала.
Мутации Na с повышением функцииVБыло обнаружено, что 1.8, идентифицированный у пациентов с болезненными периферическими невропатиями, делает нейроны DRG сверхвозбудимыми и, таким образом, являются причиной боли.[21][22] Хотя НаV1.8 в норме не экспрессируется в мозжечке, его экспрессия повышается в клетках Пуркинье мозжечка в моделях MS (рассеянного склероза) на животных и в человеческом MS.[23] Наличие NaV1,8 канала в этих нейронах мозжечка, где они обычно отсутствуют, увеличивают их возбудимость и изменяют характер их возбуждения. in vitro,[24] а у грызунов с экспериментальным аутоиммунным энцефаломиелитом - модель рассеянного склероза.[25] На поведенческом уровне эктопическая экспрессия NaV1.8 в нейронах Пуркинье мозжечка, как было показано на трансгенной модели, ухудшает двигательную способность.[26]
Клиническое значение
Пути передачи сигналов боли
Ноцицепторы отличаются от других сенсорных нейронов тем, что они имеют низкий порог активации и, как следствие, усиливают реакцию на постоянные стимулы. Следовательно, ноцицепторы легко сенсибилизируются такими агентами, как брадикинин и фактор роста нервов, которые высвобождаются в месте повреждения ткани, в конечном итоге вызывая изменения проводимости ионных каналов. Было показано, что VGSCs увеличивают плотность после повреждения нерва.[27] Следовательно, VGSC могут модулироваться множеством различных гипералгетических агентов, которые высвобождаются после повреждения нерва. Дополнительные примеры включают простагландин E2 (PGE2), серотонин и аденозин, которые все действуют для увеличения тока через Nav1.8.[28]
Простагландины, такие как PGE2 может сенсибилизировать ноцицепторы к тепловым, химическим и механическим раздражителям и увеличивать возбудимость сенсорных нейронов DRG. Это происходит потому, что PGE2 модулирует трафик Nav1.8 путем связывания с G-белком Рецептор EP2, что, в свою очередь, активирует протеинкиназа А.[29][30] Протеинкиназа А фосфорилирует Nav1,8 на внутриклеточных участках, что приводит к увеличению тока ионов натрия. Доказательства связи между PGE2 а гипералгезия возникает в результате нокдауна антисмыслового дезоксинуклеотида Nav1,8 в ДРГ крыс.[31] Другой модулятор Nav1.8 является ε-изоформой PKC. Эта изоформа активируется медиатором воспаления брадикинином и фосфорилирует Nav1.8, вызывая увеличение тока натрия в сенсорных нейронах, что способствует механической гипералгезии.[32]
Синдром Бругада
Мутации в SCN10A связаны с Синдром Бругада.[33]
Мембранная торговля
Уровень фактора роста нервов в воспаленных или поврежденных тканях повышается, что приводит к повышенной чувствительности к боли (гипералгезия).[34] Повышенный уровень фактора роста нервов и фактор некроза опухоли-α (TNF-α) вызывает активацию Nav1,8 в сенсорных нейронах через дополнительный белок p11 (легкая цепь аннексина II). Это было показано с помощью дрожжевой двугибридный метод скрининга, согласно которому p11 связывается с 28-аминокислотным фрагментом на N-конце Nav1.8 и продвигает перемещение к плазматическая мембрана. Это способствует повышенной возбудимости сенсорных нейронов во время боли.[35] p11-нулевые ноцицептивные сенсорные нейроны у мышей, созданные с использованием Cre-loxP рекомбиназа системы, показывают уменьшение Nav1.8 экспрессия на плазматической мембране.[36] Следовательно, нарушая взаимодействия между p11 и Nav1.8 может быть хорошей терапевтической целью для уменьшения боли.
В миелинизированный волокна, VGSC расположены в узлы Ранвье; однако в немиелинизированных волокнах точное местоположение VGSCs не определено. Nav1,8 в немиелинизированных волокнах было обнаружено в кластерах, связанных с липидные рафты вдоль волокон DRG как in vitro и in vivo.[37] Липидные рафты организуют клеточную мембрану, которая включает в себя транспортировку и локализацию ионных каналов. Удаление липидных рафтов в мембране с помощью MβCD, который истощает холестерин из плазматической мембраны, приводит к сдвигу Nav1,8 к неплотной части мембраны, вызывая срабатывание и распространение пониженного потенциала действия.[37]
Болезненные периферические невропатии
Болезненный периферические невропатии или же невропатии мелких волокон являются нарушениями немиелинизированных ноцицептивных С-волокон, вызывающими невропатическую боль; в некоторых случаях причина неизвестна.[38] Генетический скрининг пациентов с этими идиопатическими невропатиями выявил мутации в SCN9A ген, кодирующий родственный канал Nav1.7. А мутация с усилением функции в Nav1.7, расположенные в сенсорных нейронах DRG, были обнаружены у 30% пациентов.[39] Эта мутация с усилением функции вызывает увеличение возбудимости (гипервозбудимости) сенсорных нейронов DRG и, следовательно, усиление боли. NavТаким образом, было показано, что 1.7 связан с человеческой болью; Nav1.8, напротив, до недавнего времени ассоциировался с болью только в исследованиях на животных. Мутация с усилением функции была обнаружена в Nav1.8-кодирование SCN10A ген у пациентов с болезненной периферической невропатией.[21] Исследование 104 пациентов с идиопатический периферические невропатии, у которых не было мутации в SCN9A использовал зажим напряжения и токовые клещи методы, наряду с прогнозирующими алгоритмы, и дали две мутации с усилением функции в SCN10A у трех пациентов. Обе мутации вызывают повышенную возбудимость сенсорных нейронов DRG и, следовательно, способствуют боли, но механизм, с помощью которого они это делают, не изучен.
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000185313 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000034533 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Энтрез Джин: натриевой канал».
- ^ Rabert DK, Koch BD, Ilnicka M, Obernolte RA, Naylor SL, Herman RC, Eglen RM, Hunter JC, Sangameswaran L (ноябрь 1998 г.). «Тетродотоксин-резистентный потенциал-управляемый натриевый канал из ганглиев дорсальных корешков человека, hPN3 / SCN10A». Боль. 78 (2): 107–14. Дои:10.1016 / S0304-3959 (98) 00120-1. PMID 9839820. S2CID 45480324.
- ^ Пламмер Н.В., Мейслер М.Х. (апрель 1999 г.). «Эволюция и разнообразие генов натриевых каналов млекопитающих». Геномика. 57 (2): 323–31. Дои:10.1006 / geno.1998.5735. PMID 10198179.
- ^ Каттералл, В. А., Голдин А. Л., Ваксман С. Г. (декабрь 2005 г.). "Международный союз фармакологии. XLVII. Номенклатура и взаимосвязь между структурой и функцией потенциалзависимых натриевых каналов". Фармакологические обзоры. 57 (4): 397–409. Дои:10.1124 / пр.57.4.4. PMID 16382098. S2CID 7332624.
- ^ а б Акопян А.Н., Суслова В., Инглэнд С., Окусе К., Огата Н., Уре Дж., Смит А., Керр Б.Дж., МакМахон С.Б., Бойс С., Хилл Р., Станфа Л.С., Дикенсон А.Х., Вуд Дж. Н. (июнь 1999 г.). «Тетродотоксин-резистентный натриевой канал SNS выполняет специализированную функцию в болевых путях». Природа Неврологии. 2 (6): 541–8. Дои:10.1038/9195. PMID 10448219. S2CID 17487906.
- ^ Акопян А.Н., Сивилотти Л., Вуд Дж. Н. (январь 1996 г.). «Тетродотоксин-резистентный потенциал-управляемый натриевый канал, экспрессируемый сенсорными нейронами». Природа. 379 (6562): 257–62. Bibcode:1996Натура 379..257А. Дои:10.1038 / 379257a0. PMID 8538791. S2CID 4360775.
- ^ Cummins TR, Sheets PL, Waxman SG (октябрь 2007 г.). «Роль натриевых каналов в ноцицепции: влияние на механизмы боли». Боль. 131 (3): 243–57. Дои:10.1016 / j.pain.2007.07.026. ЧВК 2055547. PMID 17766042.
- ^ а б Swanwick RS, Pristerá A, Okuse K (декабрь 2010 г.). «Торговля Na (V) 1.8». Письма о неврологии. 486 (2): 78–83. Дои:10.1016 / j.neulet.2010.08.074. ЧВК 2977848. PMID 20816723.
- ^ Strickland IT, Martindale JC, Woodhams PL, Reeve AJ, Chessell IP, McQueen DS (июль 2008 г.). «Изменения в экспрессии NaV1.7, NaV1.8 и NaV1.9 в отдельной популяции ганглиев дорсальных корешков, иннервирующих коленный сустав крысы, на модели хронической воспалительной боли в суставах». Европейский журнал боли. 12 (5): 564–72. Дои:10.1016 / j.ejpain.2007.09.001. PMID 17950013. S2CID 24952010.
- ^ Блэр Н.Т., Бин Б.П. (2002). «Роли тетродотоксина (ТТХ) -чувствительного тока Na +, устойчивого к ТТХ тока Na + и тока Са2 + в потенциалах действия ноцицептивных сенсорных нейронов». Журнал неврологии. 22 (23): 10277–10290. Дои:10.1523 / JNEUROSCI.22-23-10277.2002. ЧВК 6758735. PMID 12451128.
- ^ Ренганатан М., Cummins TR и Waxman SG (2001). «Вклад Nav1.8 натриевых каналов в действие потенциального электрогенеза в нейронах DRG». Журнал нейрофизиологии. 86 (2): 629–640. Дои:10.1152 / ян.2001.86.2.629. PMID 11495938.
- ^ Миллан MJ (1999). «Вызывание боли: интегративный обзор». Прогресс в нейробиологии. 57 (1): 1–164. Дои:10.1016 / S0301-0082 (98) 00048-3. PMID 9987804. S2CID 206054345.
- ^ Мэтьюз Э.А., Вуд Дж. Н., Дикенсон А. Х. (февраль 2006 г.). «Na (v) 1,8-нулевые мыши демонстрируют зависимый от стимула дефицит спинномозговой нейрональной активности». Молекулярная боль. 2: 1744-8069–2-5. Дои:10.1186/1744-8069-2-5. ЧВК 1403745. PMID 16478543.
- ^ Джарвис М.Ф., Оноре П., Ши К.К., Чепмен М., Джоши С., Чжан XF, Корт М., Кэрролл В., Маррон Б., Аткинсон Р., Томас Дж., Лю Д., Крамбис М., Лю И., МакГараути С., Чу К., Роелоффс Р. , Чжун К., Микуса Дж. П., Эрнандес Дж., Говин Д., Уэйд К., Чжу К., Пай М., Сканио М., Ши Л., Дризин И., Грегг Р., Матуленко М., Хаким А., Гросс М., Джонсон М., Марш К., Вагонер П.К., Салливан Дж. П., Фалтинек CR, Krafte DS (май 2007 г.). «A-803467, мощный и селективный блокатор натриевых каналов Nav1.8, ослабляет невропатическую и воспалительную боль у крыс». Труды Национальной академии наук Соединенных Штатов Америки. 104 (20): 8520–5. Дои:10.1073 / pnas.0611364104. ЧВК 1895982. PMID 17483457.
- ^ а б Циммерманн К., Леффлер А., Бейбс А., Сендан С. М., Карр Р. У., Кобаяши Дж., Нау С., Вуд Дж. Н., Рих П. В. (июнь 2007 г.). «Сенсорный нейронный натриевой канал Nav1.8 необходим для снятия боли при низких температурах». Природа. 447 (7146): 855–8. Bibcode:2007Натура.447..856Z. Дои:10.1038 / природа05880. PMID 17568746. S2CID 4391511.
- ^ Хан Ч., Estacion M, Хуанг Дж., Васильев Д., Чжао П., Диб-Хадж С.Д., Ваксман С.Г. (май 2015 г.). «Человеческий Na (v) 1.8: усиленные постоянные и нарастающие токи способствуют отличным возбуждающим свойствам нейронов DRG человека». Журнал нейрофизиологии. 113 (9): 3172–85. Дои:10.1152 / ян.00113.2015. ЧВК 4432682. PMID 25787950.
- ^ Хуанг Дж., Ян Й., Чжао П., Герритс М. М., Хойеймейкерс Дж. Г., Бекелаар К., Меркис И. С., Фабер К. Г., Диб-Хадж С. Д., Ваксман С. Г. (август 2013 г.). «Мелковолоконная нейропатия Мутация Nav1.8 смещает активацию в сторону гиперполяризованных потенциалов и увеличивает возбудимость нейронов ганглиев дорзального корешка». Журнал неврологии. 33 (35): 14087–97. Дои:10.1523 / JNEUROSCI.2710-13.2013. ЧВК 6618513. PMID 23986244.
- ^ Блэк Дж. А., Диб-Хадж С., Бейкер Д., Ньюкомб Дж., Кузнер М. Л., Ваксман С. Г. (октябрь 2000 г.). «Сенсорный нейрон-специфический натриевой канал SNS аномально экспрессируется в мозге мышей с экспериментальным аллергическим энцефаломиелитом и людей с рассеянным склерозом». Труды Национальной академии наук Соединенных Штатов Америки. 97 (21): 11598–602. Bibcode:2000PNAS ... 9711598B. Дои:10.1073 / пнас.97.21.11598. ЧВК 17246. PMID 11027357.
- ^ Ренганатан М., Гелдерблом М., Блэк Дж. А., Ваксман С. Г. (январь 2003 г.). «Экспрессия натриевых каналов Nav1.8 нарушает паттерны возбуждения клеток Пуркинье мозжечка». Исследование мозга. 959 (2): 235–42. Дои:10.1016 / с0006-8993 (02) 03750-2. PMID 12493611. S2CID 34784900.
- ^ Saab CY, Craner MJ, Kataoka Y, Waxman SG (сентябрь 2004 г.). «Аномальная активность клеток Пуркинье in vivo при экспериментальном аллергическом энцефаломиелите». Экспериментальное исследование мозга. 158 (1): 1–8. Дои:10.1007 / s00221-004-1867-4. PMID 15118796. S2CID 34656521.
- ^ Шилдс С.Д., Ченг Х, Гассер А., Сааб К.Ю., Тиррелл Л., Истман Э.М., Ивата М., Цвингер П.Дж., Блэк Д.А., Диб-Хадж С.Д., Ваксман С.Г. (февраль 2012 г.). «Каннелопатия способствует дисфункции мозжечка в модели рассеянного склероза». Анналы неврологии. 71 (2): 186–94. Дои:10.1002 / ana.22665. PMID 22367990. S2CID 25128887.
- ^ Девор М; Говрин-Липпманн R & Angelides (1993). «Иммунолокализация Na + -канала в аксонах периферических млекопитающих и изменения после травмы нерва и образования невромы». Журнал неврологии. 13 (5): 1976–1992. Дои:10.1523 / JNEUROSCI.13-05-01976.1993. ЧВК 6576562. PMID 7683047.
- ^ Gold MS, Reichling DB, Шустер MJ, Levine JD (февраль 1996 г.). «Гипералгезирующие средства увеличивают резистентный к тетродотоксину Na + ток в ноцицепторах». Труды Национальной академии наук Соединенных Штатов Америки. 93 (3): 1108–12. Bibcode:1996PNAS ... 93.1108G. Дои:10.1073 / пнас.93.3.1108. ЧВК 40039. PMID 8577723.
- ^ Гектор TH (январь 1975 г.). «Простой метод создания хроматографических записей с использованием прозрачного ацетатного листа». Журнал физиологии. 32 (1): 31–2. Дои:10.1113 / jphysiol.1996.sp021604. ЧВК 1160802. PMID 8887754.
- ^ Лю Ц., Ли Ц., Су И, Бао Л. (март 2010 г.). «Простагландин E2 способствует передаче Na1.8 через свой внутриклеточный мотив RRR через путь протеинкиназы A». Трафик. 11 (3): 405–17. Дои:10.1111 / j.1600-0854.2009.01027.x. PMID 20028484. S2CID 997800.
- ^ Хасар С.Г., Золотой МС и Левин Дж.Д. (1998). «Тетродотоксин-резистентный натриевый ток опосредует воспалительную боль у крыс». Письма о неврологии. 256 (1): 17–20. Дои:10.1016 / s0304-3940 (98) 00738-1. PMID 9832206. S2CID 5614913.
- ^ Ву Д.Ф., Чандра Д., МакМахон Т., Ван Д., Дадгар Дж., Харазия В.Н., Лян Ю.Дж., Ваксман С.Г., Диб-Хадж С.Д., Мессинг РО (апрель 2012 г.). «PKCε фосфорилирование натриевого канала NaV1.8 увеличивает функцию канала и вызывает механическую гипералгезию у мышей». Журнал клинических исследований. 122 (4): 1306–15. Дои:10.1172 / JCI61934. ЧВК 3315445. PMID 22426212.
- ^ Ху Д., Барахас-Мартинес Х., Пфайффер Р., Дези Ф., Пфайфер Дж., Бух Т., Бетценхаузер М.Дж., Белардинелли Л., Калиг К.М., Раджамани С., ДеАнтонио Х.Дж., Майербург Р.Дж., Ито Х., Дешмукх П., Мариеб М., Нам ГБ Бхатия А., Хасдемир С., Хассагер М., Велтманн С., Шимпф Р., Борггрефе М., Вискин С., Анцелевич С. (июль 2014 г.). «Мутации в SCN10A ответственны за большую часть случаев синдрома Бругада». Журнал Американского колледжа кардиологии. 64 (1): 66–79. Дои:10.1016 / j.jacc.2014.04.032. ЧВК 4116276. PMID 24998131.
- ^ McMahon SB (март 1996 г.). «NGF как медиатор воспалительной боли». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 351 (1338): 431–40. Bibcode:1996РСПТБ.351..431М. Дои:10.1098 / рстб.1996.0039. PMID 8730782.
- ^ Окусе К., Малик-Холл М., Бейкер М.Д., Пун В.Й., Конг Х., Чао М.В., Вуд Д.Н. (июнь 2002 г.). «Легкая цепь аннексина II регулирует экспрессию сенсорных нейрон-специфических натриевых каналов». Природа. 417 (6889): 653–6. Bibcode:2002Натура 417..653O. Дои:10.1038 / природа00781. PMID 12050667. S2CID 4423351.
- ^ Фоулкс Т., Нассар М.А., Лейн Т., Мэтьюз Е.А., Бейкер М.Д., Герке В., Окусе К., Дикенсон А.Х., Вуд Дж. Н. (октябрь 2006 г.). «Делеция р11 легкой цепи аннексина 2 в ноцицепторах вызывает дефицит соматосенсорного кодирования и болевого поведения» (PDF). Журнал неврологии. 26 (41): 10499–507. Дои:10.1523 / JNEUROSCI.1997-06.2006. ЧВК 6674704. PMID 17035534.
- ^ а б Pristerà A, Baker MD, Okuse K (2012). «Связь между устойчивыми к тетродотоксину каналами и липидными рафтами регулирует возбудимость сенсорных нейронов». PLOS ONE. 7 (8): e40079. Bibcode:2012PLoSO ... 740079P. Дои:10.1371 / journal.pone.0040079. ЧВК 3411591. PMID 22870192.
- ^ Hoeijmakers JG, Faber CG, Lauria G, Merkies IS, Waxman SG (май 2012 г.). «Мелковолокнистые невропатии - достижения в диагностике, патофизиологии и лечении». Обзоры природы. Неврология. 8 (7): 369–79. Дои:10.1038 / nrneurol.2012.97. PMID 22641108. S2CID 8804151.
- ^ Faber CG, Hoeijmakers JG, Ahn HS, Cheng X, Han C, Choi JS, Estacion M, Lauria G, Vanhoutte EK, Gerrits MM, Dib-Hajj S, Drenth JP, Waxman SG, Merkies IS (январь 2012 г.). «Мутации усиления функции Naν1.7 при идиопатической нейропатии мелких волокон». Анналы неврологии. 71 (1): 26–39. Дои:10.1002 / ana.22485. PMID 21698661. S2CID 11711575.
дальнейшее чтение
- Окусе К. (2007). «Пути передачи сигналов боли: от цитокинов к ионным каналам». Международный журнал биохимии и клеточной биологии. 39 (3): 490–6. Дои:10.1016 / j.biocel.2006.11.016. PMID 17194618.
- Ваксман С.Г. (июль 2013 г.). «Болезненные на-каннелопатии: расширяющаяся вселенная». Тенденции в молекулярной медицине. 19 (7): 406–9. Дои:10.1016 / j.molmed.2013.04.003. PMID 23664154.
- Лай Дж., Поррека Ф., Хантер Дж. С., Gold MS (2004). «Напряжение-управляемые натриевые каналы и гипералгезия». Ежегодный обзор фармакологии и токсикологии. 44: 371–97. Дои:10.1146 / annurev.pharmtox.44.101802.121627. PMID 14744251.
- Вуд Дж. Н., Бурман Дж. П., Окусе К., Бейкер М. Д. (октябрь 2004 г.). «Напряжение-управляемые натриевые каналы и болевые пути». Журнал нейробиологии. 61 (1): 55–71. Дои:10.1002 / neu.20094. PMID 15362153.
- Малик-Холл М., Пун В.Й., Бейкер М.Д., Вуд Дж. Н., Окусе К. (февраль 2003 г.). «Белки сенсорных нейронов взаимодействуют с внутриклеточными доменами натриевого канала NaV1.8». Исследование мозга. Молекулярное исследование мозга. 110 (2): 298–304. Дои:10.1016 / S0169-328X (02) 00661-7. PMID 12591166.
- Ямаока К., Иноуэ М., Миядзаки К., Хирама М., Кондо К., Киношита Е., Миёси Х., Сеяма И. (март 2009 г.). «Синтетические сигуатоксины избирательно активируют химерные натриевые каналы, производные Nav1.8, экспрессируемые в клетках HEK293». Журнал биологической химии. 284 (12): 7597–605. Дои:10.1074 / jbc.M806481200. ЧВК 2658054. PMID 19164297.
- Чой Дж. С., Худмон А., Ваксман С. Г., Диб-Хадж С. Д. (июль 2006 г.). «Кальмодулин регулирует плотность тока и частотно-зависимое ингибирование натриевого канала Nav1.8 в нейронах DRG». Журнал нейрофизиологии. 96 (1): 97–108. Дои:10.1152 / ян.00854.2005. PMID 16598065.
- Лю CJ, Priest BT, Bugianesi RM, Dulski PM, Felix JP, Dick IE, Brochu RM, Knaus HG, Middleton RE, Kaczorowski GJ, Slaughter RS, Garcia ML, Köhler MG (февраль 2006 г.). «Анализ на основе FRET с высокой пропускной способностью мембран для каналов NaV1.8». Технологии анализа и разработки лекарств. 4 (1): 37–48. Дои:10.1089 / adt.2006.4.37. PMID 16506887.
- Браун Л. Е., Блейни Ф. Е., Юсаф С. П., Клэр Дж. Дж., Рэй Д. (апрель 2009 г.). «Структурные детерминанты лекарств, действующих на канал Nav1.8». Журнал биологической химии. 284 (16): 10523–36. Дои:10.1074 / jbc.M807569200. ЧВК 2667739. PMID 19233853.
- Rabert DK, Koch BD, Ilnicka M, Obernolte RA, Naylor SL, Herman RC, Eglen RM, Hunter JC, Sangameswaran L (ноябрь 1998 г.). «Тетродотоксин-резистентный потенциалзависимый натриевый канал из ганглиев дорсальных корешков человека, hPN3 / SCN10A». Боль. 78 (2): 107–14. Дои:10.1016 / S0304-3959 (98) 00120-1. PMID 9839820. S2CID 45480324.
- Пламмер Н.В., Мейслер М.Х. (апрель 1999 г.). «Эволюция и разнообразие генов натриевых каналов млекопитающих». Геномика. 57 (2): 323–31. Дои:10.1006 / geno.1998.5735. PMID 10198179.
- Каттералл, В. А., Голдин А. Л., Ваксман С. Г. (декабрь 2005 г.). "Международный союз фармакологии. XLVII. Номенклатура и взаимосвязь между структурой и функцией потенциалзависимых натриевых каналов". Фармакологические обзоры. 57 (4): 397–409. Дои:10.1124 / пр.57.4.4. PMID 16382098. S2CID 7332624.



