WikiDer > Холин
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC 2-гидрокси-N,N,N-триметилэтан-1-аминий | |
| Другие имена 2-гидрокси-N,N,N-триметилэтанаминий Билинейрин (2-гидроксиэтил) триметиламмоний | |
| Идентификаторы | |
| |
3D модель (JSmol) | |
| 1736748 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.000.487 |
| Номер ЕС |
|
| 324597 | |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Свойства | |
| C5ЧАС14Нет+ | |
| Молярная масса | 104,17 г / моль |
| Внешность | вязкая расплывающаяся жидкость (гидроксид холина)[1] |
| очень растворим (гидроксид холина)[1] | |
| Растворимость | растворим в этиловый спирт,[1] не растворим в диэтиловый эфир и хлороформ (гидроксид холина)[2] |
| Опасности | |
| Пиктограммы GHS |  |
| Сигнальное слово GHS | Опасность |
| H314 | |
| P260, P264, P280, P301 + 330 + 331, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P310, P321, P363, P405, P501 | |
| NFPA 704 (огненный алмаз) | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 3–6 г / кг чб, крысы, оральный[1] |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Холин /ˈkəʊляп/[3] является необходимое питательное вещество для человека и многих других животных.[4] Холин встречается как катион что формирует различные соли (ИКС− в изображенной формуле - неопределенный противодействие).[5] Для поддержания здоровья его необходимо получать из рациона в виде холина или холина. фосфолипиды, любить фосфатидилхолин.[4] Люди и большинство животных производят холин de novo, но продукция у людей и большинства видов недостаточна. Холин часто не классифицируют как витамин, но как питательное вещество с аминокислота-любить метаболизм.[2] У большинства животных холинфосфолипиды являются необходимыми компонентами в клеточные мембраны, в мембранах клетки органеллы, И в липопротеины очень низкой плотности.[4] Холин необходим для производства ацетилхолин - а нейротрансмиттер - и S-аденозилметионинуниверсальный метил донор, участвующий в синтезе гомоцистеин.[4]
Симптоматический дефицит холина - редко у людей - причины неалкогольная жировая болезнь печени и повреждение мышц.[4] Чрезмерное потребление холина (более 7,5 г / день) может вызвать низкое кровяное давление, потливость, понос и рыбный запах тела из-за триметиламин, который образуется в его метаболизме.[4][6] Богатые диетические источники холина и фосфолипидов холина включают: куриное яйцо желток, ростки пшеницы, и мясо, особенно субпродукты, такие как печень говяжья.[4]
Химия
Холин - это семейство водорастворимых четвертичные аммониевые соединения.[5] Холин гидроксид известен как основание холина. это гигроскопичный и поэтому часто встречается как бесцветный вязкий гидратированный сироп с запахом триметиламин (ТМА). Водные растворы холина стабильны, но соединение медленно распадается на этиленгликоль, полиэтиленгликоли, и ТМА.[1]
Хлорид холина можно получить, обработав ТМА 2-хлорэтанол:[1]
- (CH3)3N + ClCH2CH2ОН → (СН3)3N+CH2CH2OH · Cl–
2-хлорэтанол может быть получен из окись этилена. Холин исторически производился из природных источников, таких как гидролиз из лецитин.[1]
Метаболизм
Биосинтез
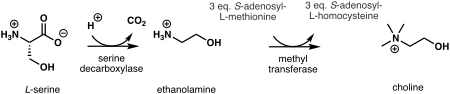
У растений первый шаг в de novo биосинтез холина - это декарбоксилирование из серин в этаноламин, который катализируется сериндекарбоксилаза.[7] Синтез холина из этаноламина может происходить тремя параллельными путями, из которых три последовательных N-стадии метилирования, катализируемые метилтрансфераза выполняются либо на бесплатной основе,[8] фосфо-основания,[9] или фосфатидил-основания.[10] Источником метильной группы является S-аденозил-L-метионин и S-аденозил-L-гомоцистеин создается как побочный продукт.[11]
У людей и большинства других животных de novo синтез холина происходит через фосфатидилэтаноламин N-метилтрансфераза (PEMT) путь,[6] но биосинтеза недостаточно для удовлетворения потребностей человека.[12] При печеночном пути PEMT, 3-фосфоглицерат (3PG) получает 2 ацильные группы от ацил-КоА формирование фосфатидная кислота. Он реагирует с цитидинтрифосфат с образованием цитидиндифосфат-диацилглицерина. это гидроксильная группа реагирует с серин формировать фосфатидилсерин который декарбоксилаты к этаноламин и фосфатидилэтаноламин (PE) формы. А PEMT фермент перемещает три метил группы из трех S-аденозилметионины (SAM) доноры этаноламиновой группы фосфатидилэтаноламина с образованием холина в форме фосфатидилхолина. Три S-аденозилгомоцистеины (SAH) образуются как побочный продукт.[6]
Холин также может высвобождаться из более сложных молекул, содержащих холин. Например, фосфатидилхолины (PC) может быть гидролизован до холина (Chol) в большинстве типов клеток. Холин также может вырабатываться по пути ЦДФ-холин, цитозольный холинкиназы (СК) фосфорилируют холин с АТФ к фосфохолин (ПЧол).[2] Это происходит в некоторых типах клеток, таких как печень и почки. Холин-фосфатцитидилилтрансферазы (CPCT) преобразовать PChol в ЦДФ-холин (CDP-Chol) с цитидинтрифосфатом (CTP). ЦДФ-холин и диглицерид преобразованы в ПК диацилглицерин холинфосфотрансфераза (CPT).[6]
У людей определенный PEMT-фермент мутации и дефицит эстрогена (часто из-за менопауза) увеличивают диетическую потребность в холине. У грызунов 70% фосфатидилхолинов образуются через путь PEMT и только 30% через путь CDP-холин.[6] В нокаутные мыши, Инактивация PEMT делает их полностью зависимыми от пищевого холина.[2]
Абсорбция
У человека холин всасывается из кишечник через SLC44A1 (CTL1) мембранный белок через облегченное распространение регулируется градиентом концентрации холина и электрическим потенциалом на энтероцит мембраны. SLC44A1 имеет ограниченную способность транспортировать холин: при высоких концентрациях часть его остается неабсорбированной. Абсорбированный холин покидает энтероциты через воротная вена, проходит через печень и попадает Систематическая циркуляция. Кишечные микробы разложить неабсорбированный холин до триметиламин, который окисляется в печени до триметиламин N-окись.[6]
Фосфохолин и глицерофосфохолины гидролизуются через фосфолипазы к холину, который попадает в воротную вену. Из-за их водорастворимости некоторые из них в неизменном виде попадают в воротную вену. Жирорастворимые холиносодержащие соединения (фосфатидилхолины и сфингомиелины) либо гидролизуются фосфолипазами, либо попадают в лимфа включены в хиломикроны.[6]
Транспорт
У людей холин переносится в крови в виде свободной молекулы. Холин-содержащий фосфолипиды и другие вещества, такие как глицерофосфохолины, переносятся кровью липопротеины. Плазма крови уровень холина в здоровых голодание взрослым 7–20 летмикромоли на литр (мкмоль / л) и в среднем 10 мкмоль / л. Уровни регулируются, но потребление и дефицит холина изменяют эти уровни. Уровни повышаются примерно через 3 часа после приема холина. Уровень фосфатидилхолина в плазме взрослых натощак составляет 1,5–2,5 ммоль / л. Его потребление повышает уровень свободного холина примерно на 8–12 часов, но не оказывает значительного влияния на уровень фосфатидилхолина.[6]
Холин водорастворимый ион и, следовательно, требует, чтобы транспортеры проходили через жирорастворимые клеточные мембраны. Известны три типа переносчиков холина:[13]
SLC5A7s являются натрий- (Na+) и АТФ-зависимые перевозчики.[13][6] У них высокий связывающая аффинность для холина переносят его в первую очередь в нейроны и косвенно связаны с ацетилхолин производство.[6] Их недостаточная функция вызывает наследственный слабость в легких и других мышцах у людей из-за дефицита ацетилхолина. В нокаутные мышиих дисфункция легко приводит к смерти от цианоз и паралич.[14]
CTL1 обладают умеренным сродством к холину и транспортируют его почти во все ткани, включая кишечник, печень, почки и т. Д. плацента и митохондрии. CTL1 поставляют холин для фосфатидилхолин и триметилглицин производство.[6] CTL2 встречаются особенно в митохондриях языка, почек, мышц и сердца. Они связаны с митохондриальной окисление холина в триметилглицин. CTL1 и CTL2 не связаны с производством ацетилхолина, но транспортируют холин вместе через гематоэнцефалический барьер. На мозговой стороне барьера встречаются только CTL2. Они также удаляют избыток холина из нейронов обратно в кровь. CTL1 встречаются только на кровяной стороне барьера, но также и на мембранах астроциты и нейроны.[13]
OCT1 и OCT2 не связаны с производством ацетилхолина.[6] Они транспортируют холин с низким сродством. OCT1 транспортируют холин в основном в печень и почки; OCT2 в почках и головном мозге.[13]
Место хранения
Холин хранится в клеточные мембраны и органеллы так как фосфолипиды, а внутри ячеек как фосфатидилхолины и глицерофосфохолины.[6]
Экскреция
Даже при дозах холина 2–8 г у человека с мочой выводится небольшое количество холина. Выведение происходит через переносчики, которые происходят в почках (см. транспорт). Триметилглицин деметилируется в печени и почках до диметилглицин (тетрагидрофолат получает одну из метильных групп). Метилглицин формы, выводится с мочой или деметилируется до глицин.[6]
Функция
Холин и его производные выполняют множество функций у людей и других организмов. Наиболее примечательной функцией является то, что холин служит синтетическим предшественником для других важных компонентов клетки и сигнальных молекул, таких как фосфолипиды образуют клеточные мембраны, нейротрансмиттер ацетилхолин и осморегулятор триметилглицин (бетаин). Триметилглицин, в свою очередь, служит источником метильные группы участвуя в биосинтезе S-аденозилметионин.[15][16]
Предшественник фосфолипидов
Холин превращается в разные фосфолипиды, любить фосфатидилхолины и сфингомиелины. Они есть во всех клеточные мембраны и из мембран большинства клеток органеллы.[2] Фосфатидилхолины являются структурно важной частью клеточных мембран. У людей 40–50% фосфолипидов составляют фосфатидилхолины.[6]
Фосфолипиды холина также образуют липидные рафты в клеточных мембранах вместе с холестерин. Плоты являются центрами, например, для рецепторы и рецептор преобразование сигнала ферменты.[2]
Фосфатидилхолины необходимы для синтеза ЛПОНП: 70–95% фосфолипидов в организме человека являются фосфатидилхолинами.[6]
Холин также необходим для синтеза легочный сурфактант, который представляет собой смесь, состоящую в основном из фосфатидилхолинов. Сурфактант отвечает за эластичность легких, то есть за способность ткани легких сокращаться и расширяться. Например, дефицит фосфатидилхолинов в тканях легких был связан с острый респираторный дистресс-синдром.[17]
Фосфатидилхолины выделяются в желчь и работать вместе с желчная кислота соли как поверхностно-активные вещества в нем, тем самым помогая кишечный поглощение липиды.[2]
Синтез ацетилхолина
Холин необходим для производства ацетилхолин. Это нейротрансмиттер что играет важную роль в сокращение мышц, объем памяти и нейронное развитие, Например.[6] Тем не менее, в организме человека мало ацетилхолина по сравнению с другими формами холина.[2] Нейроны также хранят холин в форме фосфолипидов на своих клеточных мембранах для производства ацетилхолина.[6]
Источник триметилглицина
У людей холин окисленный необратимо в митохондриях печени глицин бетаин альдегид от холиноксидазы. Он окисляется митохондриальными или цитозольными бетаин-альдегиддегидрогеназы к триметилглицин.[6] Триметилглицин является необходимым осморегулятор. Он также работает как подложка для BHMT-фермент, который метилирует гомоцистеин к метионин. Это S-аденозилметионин (SAM) предшественник. SAM - обычный реагент в биологических метилирование реакции. Например, он метилирует гуанидины из ДНК и некоторые лизины из гистоны. Таким образом, это часть экспрессия гена и эпигенетическая регуляция. Таким образом, дефицит холина приводит к повышению уровня гомоцистеина и снижению уровня SAM в крови.[6]
Содержание в продуктах
Холин содержится в пищевых продуктах в виде свободной молекулы и в форме фосфолипиды, особенно как фосфатидилхолины. В общий холин содержание всех этих форм является одним из самых высоких среди всех продуктов в курином яйце желток. В нем около 670 миллиграммы общего холина на 100 граммы желтка (мг / 100 г). После яиц содержание уменьшается в целом и соответственно в мясо, зерна, овощи, фрукты и жиры. Растительные масла и другие пищевые жиры содержат около 5 мг / 100 г общего холина.[6] в Соединенные Штаты, этикетки для продуктов питания выразите количество холина в порции в процентах от дневная стоимость (% DV) на основе адекватное потребление 550 мг / сут. 100% дневной нормы означает, что порция пищи содержит 550 мг холина.[18]
Грудное молоко богат холином. Эксклюзивный кормление грудью соответствует примерно 120 мг холина в день для ребенка. Увеличение потребления холина матерью повышает содержание холина в грудном молоке, а низкое потребление снижает его.[6] Детские смеси может содержать или не содержать достаточно холина. в ЕС и НАС, обязательно добавить не менее 7 мг холина на 100килокалории (ккал) на каждую детскую смесь. В ЕС запрещены уровни выше 50 мг / 100 ккал.[6][19]
Триметилглицин это функциональный метаболит холина. Он питательно заменяет холин, но только частично.[2] Большое количество триметилглицина встречается в пшеничные отруби (1339 мг / 100 г), поджаренные ростки пшеницы (1240 мг / 100 г) и шпинат (600–645 мг / 100 г), например.[20]
Содержание холина в продуктах питания (мг / 100 г)[а][20] Мясо Овощи Бекон, приготовленный 124.89 Фасоль, оснастка 13.46 Говядина, обрезной, приготовленный 78.15 Свекла 6.01 Печень говяжья, Жаренный на сковороде 418.22 Брокколи 40.06 Курица, жареный, с кожей 65.83 брюссельская капуста 40.61 Цыпленок, жареный, без кожи 78.74 Капуста 15.45 Куриная печень 290.03 Морковь 8.79 Треска, атлантика 83.63 Цветная капуста 39.10 Говяжий фарш, 75–85% постное, жареное 79.32–82.35 Сладкая кукуруза, желтый 21.95 Свиная корейка приготовленный 102.76 Огурец 5.95 Креветка, консервы 70.60 Салат, айсберг 6.70 Молочные продукты (корова) Салат-латук, ромэн 9.92 Масло сливочноесоленый 18.77 Горох 27.51 Сыр 16.50–27.21 Кислая капуста 10.39 Творог 18.42 Шпинат 22.08 Молоко, целиком / обезжиренным 14.29–16.40 Сладкий картофель 13.11 Сметана 20.33 Помидор 6.74 Йогурт, простой 15.20 Цуккини 9.36 Зерна Фрукты Овсяный отруби, сырой 58.57 яблоко 3.44 Овес, простой 7.42 Авокадо 14.18 Рис белый 2.08 Банан 9.76 Рис, коричневый 9.22 черника 6.04 Пшеницы отруби 74.39 Мускусная дыня 7.58 Зародыши пшеницы, тосты 152.08 Виноград 7.53 Другие Грейпфрут 5.63 Фасоль, темно-синий 26.93 оранжевый 8.38 Яйцо, курица 251.00 персик 6.10 Оливковое масло 0.29 Груша 5.11 Арахис 52.47 Чернослив 9.66 Соя, сырой 115.87 клубника 5.65 Тофу, мягкий 27.37 Арбуз 4.07
- ^ Продукты сырые, если не указано иное. Содержание представляет собой приблизительное количество свободного холина и холина, содержащего фосфолипиды.
Дневные значения
В следующей таблице приведены обновленные источники холина, отражающие новую дневную норму и новые этикетки с фактами о питании и добавками.[18] Он отражает данные Службы сельскохозяйственных исследований Министерства сельского хозяйства США. FoodData Central, 2019.[18]
Избранные пищевые источники холина[18] Еда Миллиграммы (мг) на порцию Процент DV * Печень говяжья, жареный на сковороде, 3 унции (85 г) 356 65 Яйцо, сваренное вкрутую, 1 большое яйцо 147 27 Говядина верхний раунд, только отдельные постные продукты, тушеные, 3 унции (85 г) 117 21 Соевые бобы, жареный,1⁄2 кружка 107 19 Куриная грудка, жареная, 85 г (3 унции) 72 13 Говядина, фарш, 93% нежирного мяса, жареная, 3 унции (85 г) 72 13 Треска Атлантическая, приготовленные, на сухом огне, 3 унции (85 г) 71 13 Грибы, шиитаке, приготовлено,1⁄2 кусочки чашки 58 11 Картофель красный, запеченная, мякоть и кожа, 1 большая картофелина 57 10 Зародыши пшеницы, тосты, 1 унция (28 г) 51 9 Фасоль, почка, консервы,1⁄2 кружка 45 8 Лебеда, приготовленные, 1 стакан 43 8 Молоко, 1% жирности, 1 стакан 43 8 Йогурт, ваниль, обезжиренная, 1 стакан 38 7 брюссельская капуста, вареные,1⁄2 кружка 32 6 Брокколи, рубленые, вареные, осушенные,1⁄2 кружка 31 6 Творог, обезжиренный, 1 стакан 26 5 Тунец, белый, консервированный в воде, высушенный твердыми частицами, 3 унции (85 г) 25 5 Арахис, жареный,1⁄4 кружка 24 4 Цветная капуста, Кусочки 1 дюйм (2,5 см), вареные, осушенные,1⁄2 кружка 24 4 Горох зеленый, вареные,1⁄2 кружка 24 4 Семена подсолнечника, обжаренное в масле,1⁄4 кружка 19 3 Рис, коричневый, длиннозерный, вареный, 1 стакан 19 3 Хлеб, лаваш, цельнозерновой, 1 большой (6 1⁄2 дюймов или диаметром 17 см) 17 3 Капуста, вареные,1⁄2 кружка 15 3 мандарин (мандарин), разделы,1⁄2 кружка 10 2 Фасоль, оснастка, сырье,1⁄2 кружка 8 1 Киви, сырье,1⁄2 чашка нарезанная 7 1 Морковь, сырые, нарезанные,1⁄2 кружка 6 1 Яблокисырые, с кожей, разрезанные на четвертинки или нарезанные,1⁄2 кружка 2 0
DV = дневная стоимость. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разработало DV, чтобы помочь потребителям сравнивать содержание питательных веществ в продуктах питания и пищевых добавках в контексте общей диеты. ДВ холина составляет 550 мг для взрослых и детей в возрасте от 4 лет и старше.[нужна цитата] FDA не требует, чтобы на этикетках пищевых продуктов было указано содержание холина, если холин не был добавлен в пищу. Продукты, обеспечивающие 20% или более DV, считаются богатыми источниками питательных веществ, но продукты, обеспечивающие более низкий процент DV, также вносят свой вклад в здоровое питание.[18]
В FoodData Central Министерства сельского хозяйства США (USDA) перечислено содержание питательных веществ во многих продуктах питания и представлен полный список продуктов, содержащих холин, с разбивкой по содержанию питательных веществ.[18]
Диетические рекомендации
Рекомендации находятся в миллиграммы в сутки (мг / сут). В Европейское агентство по безопасности пищевых продуктов (EFSA) - это общие рекомендации для Страны ЕС. EFSA не установило никаких верхних пределов потребления.[6] В отдельных странах ЕС могут быть более конкретные рекомендации. В Национальная Медицинская Академия (NAM) рекомендации применяются в Соединенные Штаты,[18] Австралия и Новая Зеландия.[21]
Рекомендации по холину (мг / день) Возраст EFSA адекватное потребление[6] США NAM адекватное потребление[18] НАМ США допустимые верхние уровни потребления[18] Младенцы и дети 0–6 месяцев Не установлено 125 Не установлено 7–12 месяцев 160 150 Не установлено 1–3 года 140 200 1,000 4–6 лет 170 250 1,000 7–8 лет 250 250 1,000 9–10 лет 250 375 1,000 11–13 лет 340 375 2,000 Самцы 14 лет 340 550 3,000 15–18 лет 400 550 3,000 19+ лет 400 550 3,500 Самки 14 лет 340 400 3,000 15–18 лет 400 400 3,000 19+ лет 400 425 3,500 Если беременна 480 450 3500 (3000, если ≤18 лет) При грудном вскармливании 520 550 3500 (3000, если ≤18 лет)
Потребление населения
Двенадцать опросов, проведенных в 9 ЕС В период с 2000 по 2011 год потребление холина взрослым в этих странах оценивалось в 269–468 человек. миллиграммы в день. Потребление составляло 269–444 мг / день для взрослых женщин и 332–468 мг / день для взрослых мужчин. Потребление составляло 75–127 мг / день для младенцев, 151–210 мг / день для детей 1-3 лет, 177–304 мг / день для детей 3–10 лет и 244–373 мг / день в 10–18 лет. . Средняя оценка общего потребления холина составляла 336 мг / день для беременных подростков и 356 мг / день для беременных женщин.[6]
Исследование, основанное на NHANES Исследование 2009–2012 годов показало, что потребление холина в некоторых НАС субпопуляции. Потребление было 315,2–318,8 мг / сут у детей в возрасте от 2 лет в этот период времени. Из детей 2+ лет только 15.6±0.8% мужчин и 6.1±0.6% женщин превысили адекватное потребление (AI). ИИ был превышен 62.9±3.1% 2–3-летних, 45.4±1.6% детей в возрасте от 4 до 8 лет, 9.0±1.0% 9–13-летних, 1.8±0.4% 14–18 и 6.6±0.5% от 19 лет. Ни в одной из подгрупп не превышен верхний уровень потребления.[22]
Исследование NHANES, проведенное среди населения США в 2013–2014 гг., Показало, что потребление холина у детей в возрасте от 2 до 19 лет составляет 256±3.8 мг / день и 339±3.9 мг / день у взрослых от 20 лет и старше. Прием был 402±6.1 мг / сут для мужчин 20 лет и старше и 278 мг / сут для женщин 20 лет и старше.[23]
Дефицит
Признаки и симптомы
Симптоматический дефицит холина у людей встречается редко. Большинство из них получают его в достаточном количестве с пищей и способны биосинтезировать ограниченное количество.[2] Симптоматическая недостаточность часто вызывается определенными заболеваниями или другими косвенными причинами. Тяжелый дефицит вызывает повреждение мышц и неалкогольная жировая болезнь печени, который может развиться в цирроз.[24]
Помимо людей, жирная печень также является типичным признаком дефицита холина у других животных. У некоторых видов также может наблюдаться кровотечение из почек. Предполагается, что это связано с дефицитом холина, производного триметилглицин, который функционирует как осморегулятор.[2]
Причины и механизмы
Эстроген продукция является важным фактором, который предрасполагает людей к дефициту наряду с низким потреблением холина с пищей. Эстрогены активируют фосфатидилхолин производство PEMT ферменты. Женщины до менопауза имеют более низкую диетическую потребность в холине, чем мужчины, из-за более высокой выработки эстрогена у женщин. Без эстрогеновая терапия, потребности женщин в постменопаузе в холине аналогичны потребностям мужчин. Немного однонуклеотидные полиморфизмы (генетические факторы), влияющие на холин и фолиевая кислота метаболизм также имеют значение. Определенный кишечные микробы также расщепляют холин более эффективно, чем другие, поэтому они также актуальны.[24]
При дефиците снижается доступность фосфатидилхолинов в печени - они необходимы для образования ЛПОНП. Таким образом, опосредованные ЛПОНП жирная кислота транспорт из печени уменьшается, что приводит к накоплению жира в печени.[6] Также были предложены другие одновременно возникающие механизмы, объясняющие наблюдаемое повреждение печени. Например, фосфолипиды холина также необходимы в митохондриальный мембраны. Их недоступность приводит к неспособности митохондриальных мембран поддерживать надлежащее состояние. электрохимический градиент, который, помимо прочего, необходим для разрушения жирные кислоты через β-окисление. Следовательно, метаболизм жиров в печени снижается.[24]
Избыточное потребление
Чрезмерные дозы холина могут иметь побочные эффекты. Например, было обнаружено, что ежедневные дозы холина 8–20 г вызывают низкое кровяное давление, тошнота, понос и рыбный запах тела. Запах возникает из-за триметиламин (TMA) сформированный кишечные микробы из неабсорбированного холина (см. триметиламинурия).[6]
Печень окисляет ТМА до триметиламин N-окись (ТМАО). Повышенные уровни ТМА и ТМАО в организме связаны с повышенным риском атеросклероз и смертность. Таким образом, предполагается, что чрезмерное потребление холина увеличивает эти риски в дополнение к карнитин, который также образует TMA и TMAO. Тем не менее, потребление холина не увеличивает риск смерти от сердечно-сосудистые заболевания.[25] Вполне вероятно, что повышенные уровни ТМА и ТМАО являются лишь симптомом других основных заболеваний или генетических факторов, которые предрасполагают людей к повышенной смертности. Такие факторы, возможно, не были должным образом учтены в некоторых исследованиях, посвященных смертности, связанной с уровнями ТМА и ТМАО. Причинно-следственная связь может быть обратной или смешанной, а потребление большого количества холина может не увеличивать смертность людей. Например, дисфункция почек предрасполагает к сердечно-сосудистые заболевания, но также может снизить выведение ТМА и ТМАО.[26]
Влияние на здоровье
Закрытие нервной трубки
Некоторые исследования на людях показали, что низкое потребление холина матерью значительно увеличивает риск дефекты нервной трубки (NTD) у новорожденных.[4] Фолиевая кислота дефицит также вызывает NTD.Холин и фолат, взаимодействуя с витамин B12, действуют как доноры метила для гомоцистеин формировать метионин, который затем может перейти в SAM (S-аденозилметионин).[4] SAM является субстратом почти для всех реакций метилирования у млекопитающих. Было высказано предположение, что нарушенное метилирование посредством SAM может быть ответственным за связь между фолатом и NTD.[27] Это также может относиться к холину.[нужна цитата] Определенный мутации которые нарушают метаболизм холина, увеличивают распространенность NTD у новорожденных, но роль диетического дефицита холина остается неясной по состоянию на 2015 год.[Обновить][4]
Сердечно-сосудистые заболевания и рак
Дефицит холина может вызвать жирная печень, что увеличивает рак и сердечно-сосудистые заболевания риск. Дефицит холина также снижает выработку SAM, которая участвует в Метилирование ДНК - это уменьшение также может способствовать канцерогенез. Таким образом, был изучен дефицит и его связь с такими заболеваниями.[6] Однако, наблюдательные исследования свободных популяций не показали убедительно связь между низким потреблением холина и сердечно-сосудистыми заболеваниями или большинством видов рака.[4][6] Исследования по рак простаты были противоречивыми.[28][29]
Познание
Исследования, наблюдающие эффект между повышенным потреблением холина и познание были проведены на взрослых людях с противоречивыми результатами.[4][30] Подобные исследования младенцев и детей были противоречивыми и также ограниченными.[4]
Беременность и развитие мозга
Эта секция нужны дополнительные цитаты для проверка. (Декабрь 2016 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Как беременность, так и лактация резко увеличивают потребность в холине. Это требование может быть удовлетворено за счет усиления регулирования PEMT через увеличение эстроген уровни для производства большего количества холина de novo, но даже при повышенной активности PEMT потребность в холине все еще настолько высока, что запасы в организме, как правило, истощаются. Примером этого может служить наблюдение, что Пемт - / - у мышей (мышей, лишенных функционального PEMT) прерывание беременности произойдет через 9–10 дней, если им не давать дополнительный холин.[31]
Хотя запасы холина у матери истощаются во время беременности и кормления грудью, плацента накапливает холин, накачивая холин против градиента концентрации в ткань, где он затем сохраняется в различных формах, в основном в виде ацетилхолин. Концентрация холина в амниотическая жидкость может быть в десять раз выше, чем в материнской крови.[31]
Функции у плода
Холин пользуется большим спросом во время беременности в качестве субстрата для строительства. клеточные мембраны (быстрое расширение тканей плода и матери), повышенная потребность в одном углероде части (подложка для метилирование ДНК и других функций), увеличивая запасы холина в тканях плода и плаценты, а также для увеличения производства липопротеинов (белков, содержащих «жировые» части).[32][33][34] В частности, вызывает интерес влияние потребления холина на мозг. Это связано с использованием холина в качестве материала для изготовления клеточных мембран (особенно при создании фосфатидилхолин). Рост человеческого мозга происходит наиболее быстро во время третий триместр беременности и продолжает быть быстрым примерно до пяти лет.[35] В это время высок спрос на сфингомиелин, который сделан из фосфатидилхолина (и, следовательно, из холина), потому что этот материал используется для миелиновый (утеплить) нервные волокна.[36] Холин также востребован для производства нейротрансмиттер ацетилхолин, которые могут влиять на структуру и организацию областей мозга, нейрогенез, миелинизация и синапс формирование. Ацетилхолин присутствует даже в плаценте и может помочь контролировать распространение клеток и дифференциация (увеличение количества ячеек и превращение многоцелевых ячеек в специализированные клеточные функции) и роды.[37][38]
Поглощение холина мозгом контролируется транспортером с низким сродством, расположенным в гематоэнцефалический барьер.[39] Транспорт происходит при артериальном плазма Концентрация холина увеличивается выше 14 мкмоль / л, что может произойти во время резкого скачка концентрации холина после употребления богатой холином пищи. Нейроны, наоборот, приобретают холин переносчиками как с высоким, так и с низким сродством. Холин хранится в виде мембраносвязанного фосфатидилхолина, который впоследствии может быть использован для синтеза нейротрансмиттера ацетилхолина. Ацетилхолин образуется по мере необходимости, проходит через синапс и передает сигнал следующему нейрону. Впоследствии ацетилхолинэстераза разрушает его, и свободный холин снова поглощается высокоаффинным транспортером в нейрон.[40]
Использует
Холин хлористый и холин битартрат используются в пищевые добавки. Битартрат используется чаще из-за его более низкой гигроскопичность.[2] Некоторые соли холина используются для дополнения курица, индюк и некоторые другие корма для животных. Некоторые соли также используются в качестве промышленных химикатов: например, в фотолитография удалять фоторезист.[1] Холина теофиллинат и холин салицилат используются как лекарства,[1][41] а также структурные аналоги, любить метахолин и карбахол.[42] С радиоактивной меткой холины, как 11C-холин, используются в медицинская визуализация.[43] Другие коммерчески используемые соли включают трихолин. цитрат и холин бикарбонат.[1]
Антагонисты и ингибиторы
Сотни холина антагонисты и ингибиторы ферментов были разработаны для исследовательских целей. Аминометилпропанол является одним из первых, используемых в качестве инструмента исследования. Он подавляет холин и триметилглицин синтез. Он может вызывать дефицит холина, что, в свою очередь, приводит к жирная печень у грызунов. Диэтаноламин - еще одно такое соединение, но также загрязняющее окружающую среду. N-циклогексилхолин подавляет захват холина в основном мозгом. Гемихолиний-3 является более общим ингибитором, но также умеренно ингибирует холинкиназы. Также были разработаны более специфические ингибиторы холинкиназы. Также существуют ингибиторы синтеза триметилглицина: карбоксибутилгомоцистеин является примером конкретного BHMT ингибитор.[2]
В холинергический гипотеза слабоумие привел не только к лекарственным ингибиторы ацетилхолинэстеразы, но и к множеству ингибиторы ацетилхолина. Примеры таких ингибирующих химикатов для исследований включают: триэтилхолин, гомохолин и многие другие N-этилпроизводные холина, которые являются ложный нейротрансмиттер аналоги ацетилхолина. Холина ацетилтрансфераза также были разработаны ингибиторы.[2]
История
Открытие
В 1849 г. Адольф Стрекер был первым, кто выделил холин из свиньи желчь.[44][45] В 1852 г. Л. Бабо и М. Хиршбрунн извлекли холин из белая горчица семена и назвал это синкалин.[45] В 1862 году Стрекер повторил свой эксперимент с желчью свиньи и быка, назвав это вещество холин впервые после греческого слова желчь, холе, и отождествляя его с химическая формула C5ЧАС13Нет.[46][12] В 1850 г. Теодор Николас Гобли извлекается из мозгов и икра из карпы вещество, которое он назвал лецитин после греческого слова "яйцо" желток, лекитос, показав в 1874 году, что это была смесь фосфатидилхолины.[47][48]
В 1865 г. Оскар Либрейх изолированный "нейрин"из мозга животных.[49][12] В структурные формулы из ацетилхолин и «нейрин» Либрейха были разрешены Адольф фон Байер в 1867 г.[50][45] Позже в том же году было показано, что «нейрин» и синкалин - те же вещества, что и холин Стрекера. Таким образом, Байер первым разрешил структуру холина.[51][52][45] Соединение, теперь известное как нейрин не имеет отношения к холину.[12]
Открытие как питательное вещество
В начале 1930-х гг. Чарльз Бест и коллеги отметили, что жирная печень у крыс на специальной диете и диабетик собак можно предотвратить, если их кормить лецитин,[12] доказав в 1932 году, что холин в лецитине несет единоличную ответственность за этот профилактический эффект.[53] В 1998 году США Национальная Медицинская Академия сообщили о своих первых рекомендациях по содержанию холина в рационе человека.[54]
использованная литература
- ^ а б c d е ж г час я j Кирк Р.Э. и др. (2000). Кирк-Отмер энциклопедия химической технологии. Том 6 (4-е изд.). Джон Вили и сыновья. С. 100–102. ISBN 9780471484943.
- ^ а б c d е ж г час я j k л м п Rucker RB, Zempleni J, Suttie JW, McCormick DB (2007). Справочник витаминов (4-е изд.). Тейлор и Фрэнсис. стр.459–477. ISBN 9780849340222.
- ^ «Холин». Словари Lexico. Получено 9 ноября 2019.
- ^ а б c d е ж г час я j k л м «Холин». Информационный центр по микронутриентам, Институт Линуса Полинга, Государственный университет Орегона. Февраль 2015 г.. Получено 11 ноября 2019.
- ^ а б «Холин». База данных метаболома человека. Центр инноваций в области метаболомики, Университет Альберты, Эдмонтон, Канада. 17 августа 2016 г.. Получено 13 сентября 2016.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление «Диетические контрольные значения холина». Журнал EFSA. 14 (8). 2016. Дои:10.2903 / j.efsa.2016.4484.
- ^ Ронтейн Д., Нисида И., Таширо Дж., Йошиока К., Ву В.И., Фолькер Д.Р., Бассет Дж., Хансон А.Д. (сентябрь 2001 г.). «Растения синтезируют этаноламин прямым декарбоксилированием серина с использованием пиридоксальфосфатного фермента». Журнал биологической химии. 276 (38): 35523–9. Дои:10.1074 / jbc.M106038200. PMID 11461929.
- ^ Член парламента Прюдомма, Мур Т.С. (ноябрь 1992 г.). «Синтез фосфатидилхолина в эндосперме клещевины: свободные основания в качестве промежуточных продуктов». Физиология растений. 100 (3): 1527–35. Дои:10.1104 / стр.100.3.1527. ЧВК 1075815. PMID 16653153.
- ^ Нуччио М.Л., Зиемак М.Дж., Генри С.А., Веретильник Е.А., Хансон А.Д. (май 2000 г.). «клонирование кДНК фосфоэтаноламина N-метилтрансфераза из шпината путем добавления в Schizosaccharomyces pombe и характеристика рекомбинантного фермента ». Журнал биологической химии. 275 (19): 14095–101. Дои:10.1074 / jbc.275.19.14095. PMID 10799484.
- ^ McNeil SD, Nuccio ML, Ziemak MJ, Hanson AD (август 2001 г.). «Повышенный синтез холина и глицинбетаина в трансгенных растениях табака, которые сверхэкспрессируют фосфоэтаноламин N-метилтрансферазу». Труды Национальной академии наук Соединенных Штатов Америки. 98 (17): 10001–5. Bibcode:2001ПНАС ... 9810001М. Дои:10.1073 / pnas.171228998. ЧВК 55567. PMID 11481443.
- ^ «Суперпути биосинтеза холина». Коллекция базы данных BioCyc: MetaCyc. SRI International.
- ^ а б c d е Цейзель Ш. (2012). «Краткая история холина». Анналы питания и метаболизма. 61 (3): 254–8. Дои:10.1159/000343120. ЧВК 4422379. PMID 23183298.
- ^ а б c d Иназу М (сентябрь 2019 г.). «Функциональная экспрессия транспортеров холина в гематоэнцефалическом барьере». Питательные вещества. 11 (10): 2265. Дои:10.3390 / nu11102265. ЧВК 6835570. PMID 31547050.
- ^ Барвик К.Е., Райт Дж., Аль-Турки С., Макэнтагарт М.М., Наир А., Чиоза Б. и др. (Декабрь 2012 г.). «Дефектный пресинаптический транспорт холина лежит в основе наследственной моторной нейропатии». Американский журнал генетики человека. 91 (6): 1103–7. Дои:10.1016 / j.ajhg.2012.09.019. ЧВК 3516609. PMID 23141292.
- ^ Глиэр МБ, Грин Т.Дж., Девлин А.М. (январь 2014 г.). «Метиловые нутриенты, метилирование ДНК и сердечно-сосудистые заболевания». Молекулярное питание и пищевые исследования. 58 (1): 172–82. Дои:10.1002 / mnfr.201200636. PMID 23661599.
- ^ Барак AJ, Beckenhauer HC, Junnila M, Tuma DJ (июнь 1993 г.). «Диетический бетаин способствует образованию печеночных S-аденозилметионин и защищает печень от жировой инфильтрации, вызванной этанолом ». Алкоголизм, Клинические и экспериментальные исследования. 17 (3): 552–5. Дои:10.1111 / j.1530-0277.1993.tb00798.x. PMID 8333583.
- ^ Душиантан А., Кьюсак Р., член парламента Грокотта, Postle AD (июнь 2018 г.). «У пациентов с острым респираторным дистресс-синдромом выявлено нарушение синтеза фосфатидилхолина в печени». Журнал липидных исследований. 59 (6): 1034–1045. Дои:10.1194 / мл. P085050. ЧВК 5983399. PMID 29716960.
- ^ а б c d е ж г час я «Холин». Офис диетических добавок (ОРВ) Национального института здоровья. Получено 19 мая 2020.
 Эта статья включает текст из этого источника, который находится в всеобщее достояние.
Эта статья включает текст из этого источника, который находится в всеобщее достояние. - ^ «21 CFR 107.100: Детская смесь; Требования к питательным веществам; Спецификации питательных веществ; Содержание холина». Свод федеральных правил, раздел 21; Управление по контролю за продуктами и лекарствами. 1 апреля 2019 г.. Получено 24 октября 2019.
- ^ а б Zeisel SH, Mar MH, Howe JC, Holden JM (май 2003 г.). «Концентрации холинсодержащих соединений и бетаина в обычных пищевых продуктах». Журнал питания. 133 (5): 1302–7. Дои:10.1093 / jn / 133.5.1302. PMID 12730414.
- ^ Холин (17 марта 2014 г.). «Холин». www.nrv.gov.au. Получено 22 октября 2019.
- ^ Уоллес Т.К., Фулгони В.Л. (2016). «Оценка общего потребления холина в Соединенных Штатах». Журнал Американского колледжа питания. 35 (2): 108–12. Дои:10.1080/07315724.2015.1080127. PMID 26886842. S2CID 24063121.
- ^ "Что мы едим в Америке, NHANES 2013-2014" (PDF). Получено 24 октября 2019.
- ^ а б c Корбин К.Д., Цейсель С.Х. (март 2012 г.). «Метаболизм холина позволяет по-новому взглянуть на неалкогольную жировую болезнь печени и ее прогрессирование». Текущее мнение в гастроэнтерологии. 28 (2): 159–65. Дои:10.1097 / MOG.0b013e32834e7b4b. ЧВК 3601486. PMID 22134222.
- ^ ДиНиколантонио Дж. Дж., Маккарти М, ОКиф Дж (2019). "Ассоциация умеренно повышенного триметиламина N-оксид с риском сердечно-сосудистых заболеваний: является ли ТМАО маркером печеночной инсулинорезистентности ». Открытое сердце. 6 (1): e000890. Дои:10.1136 / openhrt-2018-000890. ЧВК 6443140. PMID 30997120.
- ^ Цзя Дж, Доу П, Гао М, Конг Икс, Ли Си, Лю Зи, Хуан Т. (сентябрь 2019 г.). «Оценка причинно-следственной связи между кишечными микробиотозависимыми метаболитами и кардиометаболическим здоровьем: двунаправленный менделевский рандомизационный анализ». Сахарный диабет. 68 (9): 1747–1755. Дои:10.2337 / db19-0153. PMID 31167879.
- ^ Имбард А. и др. (2013). «Дефекты нервной трубки, фолиевая кислота и метилирование». Международный журнал экологических исследований и общественного здравоохранения. 10 (9): 4352–4389. Дои:10.3390 / ijerph10094352. ЧВК 3799525. PMID 24048206.
- ^ Ричман Э.Л., Кенфилд С.А., Штампфер М.Дж., Джованнуччи Э.Л., Цейсель С.Х., Виллетт В.К., Чан Дж.М. (октябрь 2012 г.). «Потребление холина и риск летального рака простаты: заболеваемость и выживаемость». Американский журнал клинического питания. 96 (4): 855–63. Дои:10.3945 / ajcn.112.039784. ЧВК 3441112. PMID 22952174.
- ^ Хан П., Бидулеску А., Барбер Дж. Р., Цейсель С.Х., Джошу С.Э., Призмент А.Е. и др. (Апрель 2019 г.). «Потребление холина и бетаина с пищей и риск общего и летального рака простаты в исследовании риска атеросклероза в сообществах (ARIC)». Причины рака и борьба с ними. 30 (4): 343–354. Дои:10.1007 / s10552-019-01148-4. ЧВК 6553878. PMID 30825046.
- ^ Видеман А.М., Барр С.И., Грин Т.Дж., Сюй З., Иннис С.М., Киттс Д.Д. (октябрь 2018 г.). «Потребление холина с пищей: текущее состояние знаний на протяжении жизненного цикла». Питательные вещества. 10 (10): 1513. Дои:10.3390 / nu10101513. ЧВК 6213596. PMID 30332744.
- ^ а б Zeisel SH (2006). «Холин: критическая роль во время развития плода и диетические потребности взрослых». Ежегодный обзор питания. 26: 229–50. Дои:10.1146 / annurev.nutr.26.061505.111156. ЧВК 2441939. PMID 16848706.
- ^ Институт медицины, пищевых продуктов и питания. Рекомендованные нормы потребления тиамина, рибофлавина, ниацина, витамина B6, Фолиевая кислота, витамин B12, Пантотеновая кислота, биотин и холин. Вашингтон, округ Колумбия: Пресса национальных академий. 1998 г.
- ^ Аллен Л.Х. (2006). «Беременность и период лактации». В Bowman BA, Russle RM (ред.). Настоящие знания в области питания. Вашингтон, округ Колумбия: ILSI Press. С. 529–543.
- ^ King JC (май 2000 г.). «Физиология беременности и метаболизма питательных веществ». Американский журнал клинического питания. 71 (5 Прил.): 1218S – 25S. Дои:10.1093 / ajcn / 71.5.1218s. PMID 10799394.
- ^ Morgane PJ, Mokler DJ, Galler JR (июнь 2002 г.). «Влияние пренатальной белковой недостаточности на формирование гиппокампа». Неврология и биоповеденческие обзоры. 26 (4): 471–83. Дои:10.1016 / s0149-7634 (02) 00012-х. PMID 12204193. S2CID 7051841.
- ^ Осида К., Симидзу Т., Такасе М., Тамура Ю., Симидзу Т., Ямаширо Ю. (апрель 2003 г.). «Влияние диетического сфингомиелина на миелинизацию центральной нервной системы у развивающихся крыс». Педиатрические исследования. 53 (4): 589–93. Дои:10.1203 / 01.pdr.0000054654.73826.ac. PMID 12612207.
- ^ Sastry BV (июнь 1997 г.). «Плацентарная холинергическая система человека». Биохимическая фармакология. 53 (11): 1577–86. Дои:10.1016 / с0006-2952 (97) 00017-8. PMID 9264309.
- ^ Састри Б.В., Садавонгвивад С. (март 1978 г.). «Холинергические системы в ненервных тканях». Фармакологические обзоры. 30 (1): 65–132. PMID 377313.
- ^ Локман PR, Аллен Д.Д. (август 2002 г.). «Транспорт холина». Разработка лекарств и промышленная аптека. 28 (7): 749–71. Дои:10.1081 / DDC-120005622. PMID 12236062. S2CID 34402785.
- ^ Кодилл MA (август 2010 г.). «До- и послеродовое здоровье: свидетельства повышенной потребности в холине». Журнал Американской диетической ассоциации. 110 (8): 1198–206. Дои:10.1016 / j.jada.2010.05.009. PMID 20656095.
- ^ Раттер П. (2017). Коммунальная аптека: симптомы, диагностика и лечение (4-е изд.). Эльзевир. п. 156. ISBN 9780702069970.
- ^ Хоу-Грант М., Кирк Р. Э., Отмер Д. Ф., ред. (2000). «C2-Хлороуглероды в технологии сжигания». Кирк-Отмер энциклопедия химической технологии. Том 6 (4-е изд.). Джон Вили и сыновья. С. 100–102. ISBN 9780471484943.
- ^ Го Й, Ван Л., Ху Дж, Фэн Д., Сюй Л. (2018). «Диагностическая эффективность холина ПЭТ / КТ для обнаружения метастазов в кости при раке простаты: систематический обзор и метаанализ». PLOS One. 13 (9): e0203400. Bibcode:2018PLoSO..1303400G. Дои:10.1371 / journal.pone.0203400. ЧВК 6128558. PMID 30192819.
- ^ Штрекер А. (1849 г.). "Beobachtungen über die galle verschiedener thiere". Юстус Либигс Энн Хем (на немецком). 70 (2): 149–197. Дои:10.1002 / jlac.18490700203.
- ^ а б c d Себрелл WH, Харрис RS, Алам SQ (1971). Витамины. 3 (2-е изд.). Академическая пресса. С. 4, 12. Дои:10.1016 / B978-0-12-633763-1.50007-5. ISBN 9780126337631.
- ^ Штрекер А. (1862 г.). "Üeber einige neue bestandtheile der schweinegalle". Юстус Либигс Энн Хем (на немецком). 123 (3): 353–360. Дои:10.1002 / jlac.18621230310.
- ^ Гобли Т. (1874 г.). "Sur la lécithine et la cérébrine". J Pharm Chim (На французском). 19 (4): 346–354.
- ^ Суркс Т.Л. (2004). «Открытие лецитина, первого фосфолипида» (PDF). Bull Hist Chem. 29 (1): 9–15. В архиве (PDF) с оригинала 13 апреля 2019 г.
- ^ Либрейх О. (1865). "Üeber die chemische beschaffenheit der gehirnsubstanz". Юстус Либигс Энн Хем (на немецком). 134 (1): 29–44. Дои:10.1002 / jlac.18651340107.
- ^ Байер А. (1867 г.). "I. Üeber das neinin". Юстус Либигс Энн Хем (на немецком). 142 (3): 322–326. Дои:10.1002 / jlac.18671420311.
- ^ Дыбковский W (1867). "Üeber die identität des cholins und des nerins" [О тождестве холина и нейрина]. J Prakt Chem (на немецком). 100 (1): 153–164. Дои:10.1002 / prac.18671000126.
- ^ Клаус А., Кизе С. (1867 г.). "Убер нейрин унд синкалин". J Prakt Chem (на немецком). 102 (1): 24–27. Дои:10.1002 / prac.18671020104.
- ^ Лучший чемпион, Hershey JM, Huntsman ME (май 1932). «Влияние лецитина на отложение жира в печени нормальной крысы». Журнал физиологии. 75 (1): 56–66. Дои:10.1113 / jphysiol.1932.sp002875. ЧВК 1394511. PMID 16994301.
- ^ Постоянный комитет Института медицины (США) по научной оценке рекомендуемых диетических рационов и его комиссия по фолиевой кислоте, другим витаминам B. и холину. Национальная академия прессы (США). 1998. С. xi, 402–413. ISBN 9780309064118.

