WikiDer > ADAM10
| Эндопептидаза ADAM10 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.24.81 | ||||||||
| Количество CAS | 193099-09-1 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
A Дезинтегрин и белок, содержащий домен металлопротеиназы 10, также известен как ADAM10 или CDw156 или CD156c это белок что у людей кодируется ADAM10 ген.[5]
Функция
Члены АДАМ семейство белков клеточной поверхности с уникальной структурой, обладающих как потенциальными адгезия и протеаза домены. Шеддаза, общее название металлопептидазы ADAM, в первую очередь предназначена для расщепления мембранных белков на клеточной поверхности. После расщепления шеддазы высвобождают растворимые эктодомены с измененным местоположением и функцией.[6][7][8]
Хотя одна шеддаза может «сбрасывать» множество веществ, несколько шеддаз могут расщеплять один и тот же субстрат, приводя к различным последствиям. Этот ген кодирует члена семейства ADAM, который расщепляет многие белки, включая TNF-альфа и E-кадгерин.[5]
ADAM10 (EC #: 3.4.24.81) - это Sheddase, и обладает широкой специфичностью в отношении реакций гидролиза пептидов.[9]
ADAM10 раскалывает эфринвнутри комплекса эфрин / эф, образованного между двумя клеточными поверхностями. Когда эфрин высвобождается из противоположной клетки, весь комплекс эфрин / эф подвергается эндоцитозу. Это выделение транс не было ранее показано, но оно вполне может быть связано с другими событиями выделения.[10]
В нейроны, ADAM10 - самый важный фермент, с α-секретаза деятельность для протеолитический обработка белок-предшественник амилоида.[11]
ADAM10 принадлежит к подсемейству A, самому предковому подсемейству белков ADAM, которое разделяют все основные группы животные, хоанофлагелляты, грибы, и зеленые водоросли из класса Mamiellophyceae.[12]
Структура
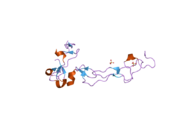
Хотя не было опубликовано никаких кристаллографических анализов дифракции рентгеновских лучей, которые отображали бы всю структуру ADAM10, один домен был исследован с использованием этого метода. Домен, богатый дезтигрином и цистеином (показан справа), играет важную роль в регуляции активности протеазы in vivo. Недавние экспериментальные данные свидетельствуют о том, что эта область, которая отличается от активного центра, может отвечать за субстратную специфичность фермента. Предполагается, что этот домен связывается с определенными областями субстрата фермента, позволяя гидролизу пептидных связей происходить в четко определенных местах на определенных белках-субстратах.[13]
Предлагаемый активный сайт ADAM10 был идентифицирован с помощью анализа последовательности и идентичен ферментам семейства металлопротеиновых доменов змеиного яда. Консенсусная последовательность для каталитически активных белков ADAM: ОНXGЧАСNLGXXЧАСD. Структурный анализ ADAM17, который имеет ту же последовательность активного сайта, что и ADAM10, предполагает, что три гистидина в этой последовательности связывают Zn2+ атом, и что глутамат является каталитическим остатком.[14]
Каталитический механизм
Хотя точный механизм ADAM10 не был полностью исследован, его активный центр гомологичен таковым хорошо изученных цинковых протеаз, таких как карбоксипептидаза А и термолизин. Таким образом, предполагается, что ADAM10 использует аналогичный механизм, как и эти ферменты. В протеазах цинка ключевые каталитические элементы были идентифицированы как остаток глутамата и Zn2+ ион, координированный с остатками гистидина.[15]
Предлагаемый механизм начинается с депротонирования молекулы воды глутаматом. Полученный гидроксид инициирует нуклеофильную атаку на карбонильный углерод пептидного остова с образованием тетраэдрического промежуточного соединения. Этому этапу способствует отрыв электронов от кислорода Zn2+ и последующей стабилизацией цинком отрицательного заряда на атоме кислорода в промежуточном состоянии. По мере того как электроны движутся вниз от атома кислорода, чтобы повторно сформировать двойную связь, тетраэдрический промежуточный продукт разрушается до продуктов с протонированием -NH остатком глутамата.[15]
Клиническое значение
Заболевания головного мозга
ADAM10 играет ключевую роль в модуляции молекулярных механизмов, ответственных за формирование, созревание и стабилизацию дендритных шипов, а также в регуляции молекулярной организации глутаматергического синапса. Следовательно, изменение активности ADAM10 строго коррелирует с началом различных типов синаптопатий, начиная от нарушений развития нервной системы, то есть расстройств аутистического спектра, до нейродегенеративных заболеваний, то есть болезни Альцгеймера.[16]
Взаимодействие с малярийным паразитом
Ряд различных белков на поверхности Плазмодий falciparum Малярийные паразиты помогают захватчикам связываться с эритроцитами. Но после присоединения к клеткам крови хозяина паразитам необходимо избавляться от «липких» поверхностных белков, которые в противном случае препятствовали бы проникновению в клетку. Фермент шеддаза, конкретно называемый в этом примере PfSUB2, необходим паразитам для вторжения в клетки; без него паразиты умирают. Согласно исследованию, шеддаза накапливается и выделяется из клеточных компартментов возле кончика паразита. Оказавшись на поверхности, фермент прикрепляется к двигателю, который перемещает его спереди назад, высвобождая липкие поверхностные белки. После удаления этих белков паразит получает доступ к эритроциту. Вся инвазия длится около 30 секунд, и без этой металлопептидазы ADAM малярия была бы неэффективна для вторжения в эритроциты.[17]
Рак молочной железы
В сочетании с низкими дозами герцептин, селективные ингибиторы ADAM10 уменьшают пролиферацию HER2 сверхэкспрессирующие клеточные линии, в то время как ингибиторы, которые не ингибируют ADAM10, не влияют. Эти результаты согласуются с тем, что ADAM10 является основным детерминантом выделения HER2, ингибирование которого может обеспечить новый терапевтический подход к лечению рака молочной железы и множества других видов рака с активной передачей сигналов HER2.[18]
Наличие продукта этого гена в синапсах нейронов в сочетании с белком AP2 было замечено в повышенных количествах в нейронах гиппокампа Болезнь Альцгеймера пациенты.[19]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000137845 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000054693 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б "Ген Entrez: ADAM10 ADAM металлопептидазный домен 10".
- ^ Мосс М.Л., Барч Дж.В. (июнь 2004 г.). «Терапевтические преимущества от нацеливания на членов семьи ADAM». Биохимия. 43 (23): 7227–35. Дои:10.1021 / bi049677f. PMID 15182168.
- ^ Нагано О., Сая Х (декабрь 2004 г.). «Механизм и биологическое значение расщепления CD44». Наука о раке. 95 (12): 930–5. Дои:10.1111 / j.1349-7006.2004.tb03179.x. PMID 15596040.
- ^ Блобель С.П. (январь 2005 г.). «ADAM: ключевые компоненты в передаче сигналов EGFR и развитии». Обзоры природы. Молекулярная клеточная биология. 6 (1): 32–43. Дои:10.1038 / nrm1548. PMID 15688065.
- ^ "Запись эндопептидазы ADAM10 (EC-номер 3.4.24.81)".
- ^ Janes PW, Saha N, Barton WA, Kolev MV, Wimmer-Kleikamp SH, Nievergall E, et al. (Октябрь 2005 г.). «Адам встречает Эф: модуль распознавания субстрата ADAM действует как молекулярный переключатель для расщепления эфрина в транс». Ячейка. 123 (2): 291–304. Дои:10.1016 / j.cell.2005.08.014. PMID 16239146.
- ^ Хаасс К., Кетер С., Тинакаран Г., Сисодия С. (май 2012 г.). «Торговля и протеолитический процессинг APP». Перспективы Колд-Спринг-Харбор в медицине. 2 (5): a006270. Дои:10.1101 / cshperspect.a006270. ЧВК 3331683. PMID 22553493.
- ^ Соуза Дж., Лисбоа А., Сантос Т., Андраде М., Невес В., Телес-Соуза Дж., Хесус Х., Безерра Т., Фалькао В., Оливейра Р., Дель-Бем Л. (2020). «Эволюция семейства генов ADAM у эукариот». Геномика. Дои:10.1016 / j.ygeno.2020.05.010.
- ^ Смит К.М., Готье А., Кузен Х., Альфандари Д., Уайт Дж. М., ДеСимон Д.В. (декабрь 2002 г.). «Богатый цистеином домен регулирует функцию протеазы ADAM in vivo». Журнал клеточной биологии. 159 (5): 893–902. Дои:10.1083 / jcb.200206023. ЧВК 2173380. PMID 12460986.
- ^ Вольфсберг Т.Г., Примакофф П., Майлс Д.Г., Уайт Дж. М. (октябрь 1995 г.). «ADAM, новое семейство мембранных белков, содержащих домен дезинтегрина и металлопротеиназы: мультипотенциальные функции во взаимодействиях клетка-клетка и клетка-матрикс». Журнал клеточной биологии. 131 (2): 275–8. Дои:10.1083 / jcb.131.2.275. ЧВК 2199973. PMID 7593158.
- ^ а б Лолис Э., Петско Г.А. (1990). «Аналоги переходного состояния в кристаллографии белков: исследования структурного источника ферментного катализа». Ежегодный обзор биохимии. 59: 597–630. Дои:10.1146 / annurev.bi.59.070190.003121. PMID 2197984.
- ^ Марчелло Э., Боррони Б., Пелуччи С., Гардони Ф., Ди Лука М. (ноябрь 2017 г.). «ADAM10 как терапевтическая мишень при заболеваниях головного мозга: от нарушений развития до болезни Альцгеймера». Мнение экспертов о терапевтических целях. 21 (11): 1017–1026. Дои:10.1080/14728222.2017.1386176. PMID 28960088.
- ^ "'Sheddase «помогает малярийным паразитам проникать в эритроциты». Архивировано из оригинал на 2008-04-12.
- ^ Лю П.С., Лю X, Ли Y, Ковингтон М., Винн Р., Хубер Р. и др. (Июнь 2006 г.). «Идентификация ADAM10 как основного источника активности шеддазы эктодомена HER2 в клетках рака молочной железы, сверхэкспрессирующих HER2». Биология и терапия рака. 5 (6): 657–64. Дои:10.4161 / cbt.5.6.2708. PMID 16627989.
- ^ Марчелло Э., Сарасено С., Мусардо С., Вара Х., де ла Фуэнте А.Г., Пелуччи С. и др. (Июнь 2013). «Эндоцитоз синаптического ADAM10 в пластичности нейронов и болезнь Альцгеймера». Журнал клинических исследований. 123 (6): 2523–38. Дои:10.1172 / JCI65401. ЧВК 3668814. PMID 23676497.
дальнейшее чтение
- Вольфсберг Т.Г., Примакофф П., Майлс Д.Г., Уайт Дж. М. (октябрь 1995 г.). «ADAM, новое семейство мембранных белков, содержащих домен дезинтегрина и металлопротеиназы: мультипотенциальные функции во взаимодействиях клетка-клетка и клетка-матрикс». Журнал клеточной биологии. 131 (2): 275–8. Дои:10.1083 / jcb.131.2.275. ЧВК 2199973. PMID 7593158.
- О'Брайан Дж. П., Фриделл Ю. В., Коски Р., Варнум Б., Лю Е. Т. (январь 1995 г.). «Трансформирующая рецепторная тирозинкиназа, Axl, посттрансляционно регулируется протеолитическим расщеплением». Журнал биологической химии. 270 (2): 551–7. Дои:10.1074 / jbc.270.2.551. PMID 7822279.
- Ховард Л., Лу Х, Митчелл С., Гриффитс С., Глинн П. (июль 1996 г.). «Молекулярное клонирование MADM: каталитически активная дезинтегрин-металлопротеиназа млекопитающих, экспрессируемая в различных типах клеток». Биохимический журнал. 317 (Pt 1) (1): 45–50. Дои:10.1042 / bj3170045. ЧВК 1217484. PMID 8694785.
- Маккай Н., Эдвардс Т., Даллас Д. Д., Хоутон А., Стрингер Б., Грэм Р. и др. (Январь 1997 г.). «Экспрессия членов нового семейства мембранных металлопротеиназ (ADAM) в суставных хондроцитах человека». Сообщения о биохимических и биофизических исследованиях. 230 (2): 335–9. Дои:10.1006 / bbrc.1996.5957. PMID 9016778.
- Rosendahl MS, Ko SC, Long DL, Brewer MT, Rosenzweig B, Hedl E, et al. (Сентябрь 1997 г.). «Идентификация и характеристика фермента, обрабатывающего фактор некроза опухоли альфа, из семейства металлопротеаз цинка ADAM». Журнал биологической химии. 272 (39): 24588–93. Дои:10.1074 / jbc.272.39.24588. PMID 9305925.
- Ямазаки К., Мидзуи Ю., Танака И. (октябрь 1997 г.). «Радиационное гибридное картирование человеческого гена ADAM10 на хромосоме 15». Геномика. 45 (2): 457–9. Дои:10.1006 / geno.1997.4910. PMID 9344679.
- Ямазаки К., Мидзуи Ю., Сагане К., Танака И. (декабрь 1997 г.). «Присвоение гена дезинтегрина и металлопротеиназы домена 10 (Adam10) хромосоме 9 мыши». Геномика. 46 (3): 528–9. Дои:10.1006 / geno.1997.5043. PMID 9441766.
- Явари Р., Адида С., Брей-Уорд П., Рассол М., Сюй Т. (июль 1998 г.). «Металлопротеаза-дезинтегрин человека Кузбаниан регулирует судьбу симпатоадреналовых клеток в развитии и неоплазии». Молекулярная генетика человека. 7 (7): 1161–7. Дои:10.1093 / hmg / 7.7.1161. PMID 9618175.
- Dallas DJ, Genever PG, Patton AJ, Millichip MI, McKie N, Skerry TM (июль 1999 г.). «Локализация ADAM10 и рецепторов Notch в кости». Кость. 25 (1): 9–15. Дои:10.1016 / S8756-3282 (99) 00099-X. PMID 10423016.
- Диас Нето Э., Корреа Р.Г., Верджовски-Алмейда С., Брионес М.Р., Нагаи М.А., да Силва В. и др. (Март 2000 г.). «Секвенирование человеческого транскриптома с использованием тегов последовательности, экспрессируемой ORF». Труды Национальной академии наук Соединенных Штатов Америки. 97 (7): 3491–6. Bibcode:2000PNAS ... 97.3491D. Дои:10.1073 / pnas.97.7.3491. ЧВК 16267. PMID 10737800.
- Хаттори М., Остерфилд М., Фланаган Дж. Г. (август 2000 г.). «Регулируемое расщепление опосредованного контактом репеллента аксонов». Наука. 289 (5483): 1360–5. Bibcode:2000Sci ... 289.1360H. Дои:10.1126 / science.289.5483.1360. PMID 10958785.
- Винсент Б., Пайтель Э., Сафтиг П., Фроберт Ю., Хартманн Д., Де Струпер Б. и др. (Октябрь 2001 г.). «Дезинтегрины ADAM10 и TACE вносят вклад в конститутивное и регулируемое сложным форболом нормальное расщепление клеточного прионного белка». Журнал биологической химии. 276 (41): 37743–6. Дои:10.1074 / jbc.M105677200. PMID 11477090.
- Чубинская С., Михаил Р., Дойч А., Тиндал М. Х. (сентябрь 2001 г.). «Белок ADAM-10 присутствует в суставном хряще человека в основном в мембраносвязанной форме и активируется при остеоартрите и в ответ на IL-1альфа в носовом хряще крупного рогатого скота». Журнал гистохимии и цитохимии. 49 (9): 1165–76. Дои:10.1177/002215540104900910. PMID 11511685.
- Лемджаббар Х., Басбаум С. (январь 2002 г.). «Рецептор фактора активации тромбоцитов и ADAM10 опосредуют ответы на Staphylococcus aureus в эпителиальных клетках». Природа Медицина. 8 (1): 41–6. Дои:10.1038 / нм0102-41. PMID 11786905.
- Хили Э. Ф., Романо П., Мехиа М., Линдфорс Дж. (Ноябрь 2010 г.). «Ацетиленовые ингибиторы ADAM10 и ADAM17: in silico анализ эффективности и селективности». Журнал молекулярной графики и моделирования. 29 (3): 436–42. Дои:10.1016 / j.jmgm.2010.08.006. PMID 20863729.
- Арндт М., Лендекель У., Рёкен С., Неппле К., Вольке С., Списс А. и др. (Февраль 2002 г.). «Измененная экспрессия ADAM (дезинтегрин и металлопротеиназа) в фибриллирующих предсердиях человека». Тираж. 105 (6): 720–5. Дои:10.1161 / hc0602.103639. PMID 11839628.
- Колчиаги Ф., Боррони Б., Пасторино Л., Марчелло Э., Циммерманн М., Каттабени Ф. и др. (Февраль 2002 г.). «Альфа-секретаза ADAM10, а также альфа АРР снижается в тромбоцитах и спинномозговой жидкости у пациентов с болезнью Альцгеймера». Молекулярная медицина. 8 (2): 67–74. Дои:10.1007 / BF03402076. ЧВК 2039975. PMID 12080182.
- Lim R, Winteringham LN, Williams JH, McCulloch RK, Ingley E, Tiao JY и др. (Октябрь 2002 г.). «MADM, новый адаптерный белок, который опосредует фосфорилирование сайта связывания 14-3-3 фактора 1 миелоидного лейкоза» (PDF). Журнал биологической химии. 277 (43): 40997–1008. Дои:10.1074 / jbc.M206041200. PMID 12176995.
- Гатта Л. Б., Альбертини А., Равид Р., Финацци Д. (ноябрь 2002 г.). «Уровни мРНК бета-секретазы BACE и альфа-секретазы ADAM10 в гиппокампе при болезни Альцгеймера». NeuroReport. 13 (16): 2031–3. Дои:10.1097/00001756-200211150-00008. PMID 12438920.
- Gutwein P, Mechtersheimer S, Riedle S, Stoeck A, Gast D, Joumaa S и др. (Февраль 2003 г.). «ADAM10-опосредованное расщепление молекулы адгезии L1 на поверхности клетки и в высвобожденных мембранных везикулах». Журнал FASEB. 17 (2): 292–4. Дои:10.1096 / fj.02-0430fje. PMID 12475894.
внешние ссылки
- ADAM10 расположение человеческого гена в Браузер генома UCSC.
- ADAM10 детали человеческого гена в Браузер генома UCSC.
- Обзор всей структурной информации, доступной в PDB для UniProt: O14672 (Дезинтегрин и белок 10, содержащий домен металлопротеиназы) на PDBe-KB.
Эта статья включает текст из Национальная медицинская библиотека США, который находится в всеобщее достояние.