WikiDer > Бета-карболин
Эта статья нужны дополнительные цитаты для проверка. (Декабрь 2007 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК 9ЧАС-β-карболин | |
Другие имена
| |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.005.418 |
| MeSH | Norharman |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C11ЧАС8N2 | |
| Молярная масса | 168,20 г / моль |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
β-Карболин (9ЧАС-пиридо[3,4-б]индол), также известный как Norharmane, представляет собой азот, содержащий гетероцикл. Это также прототип класса индол алкалоид соединения известные как β-карболины.[1]
Фармакология
β-карболин алкалоиды широко распространены в растения и животные, и часто действуют как ГАМКА обратные агонисты. В составе лианы Банистериопсис каапи, β-карболины гармин, гармалин, и тетрагидрогармин играют ключевую роль в фармакологии коренных психоделический препарат аяхуаска предотвращая поломку диметилтриптамин в кишечнике путем обратимого ингибирования моноаминоксидаза, что делает его психоактивным при пероральном приеме. Некоторые β-карболины, особенно триптолин и пинолин, может образовываться естественным образом в организме человека. Последний, возможно, замешан вместе с мелатонин в роли шишковидная железа в регулировании цикл сна-бодрствования.[нужна цитата] β-карболин - это ГАМКА бензодиазепиновый сайт обратный агонист и поэтому может иметь судороги, анксиогенный и эффекты улучшения памяти.[2] 3-гидроксиметил-бета-карболин блокирует стимулирующий сон эффект флуразепама у грызунов и сам по себе может уменьшать сон в зависимости от дозы.[3] 9-метил-β-карболины кажется, чтобы побудить Повреждение ДНК при воздействии ультрафиолетовый свет.[4]
Структура
β-Карболин принадлежит к группе индольные алкалоиды и состоит из пиридин кольцо, которое сплавлено с индол скелет.[5] Структура β-карболина аналогична структуре триптамин, с этиламин цепь повторно подключена к индол звонить через дополнительный углерод атом, чтобы получить трехкольцевую структуру. Считается, что биосинтез β-карболинов идет по этому пути из аналогичных триптаминов.[6] Различные уровни насыщенность возможны в третьем кольце, которое указано здесь в структурная формула окрашивая необязательно двойные связи в красный и синий цвет:
Примеры β-карболинов
Некоторые из наиболее важных β-карболинов представлены в таблице по структуре ниже. Их структуры могут содержать вышеупомянутые связи, отмеченные красным или синим цветом.
| Короткое имя | Red Bond | Blue Bond | R1 | R6 | R7 | R9 | Структура |
|---|---|---|---|---|---|---|---|
| β-карболин | × | × | ЧАС | ЧАС | ЧАС | ЧАС |  |
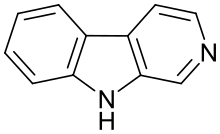
| Триптолин | ЧАС | ЧАС | ЧАС | ЧАС | 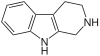 | ||
| Пинолин | ЧАС | ОСН3 | ЧАС | ЧАС |  | ||
| Харман | × | × | CH3 | ЧАС | ЧАС | ЧАС |  |
| Гармин | × | × | CH3 | ЧАС | ОСН3 | ЧАС |  |
| Гармалин | × | CH3 | ЧАС | ОСН3 | ЧАС |  | |
| Тетрагидрогармин | CH3 | ЧАС | ОСН3 | ЧАС |  | ||
| 9-метил-β-карболин | × | × | ЧАС | ЧАС | ЧАС | CH3 | 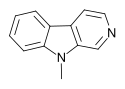 |
Встречаемость в природе
Эта секция возможно содержит несоответствующие или неверно истолкованные цитаты это не проверять текст. (Декабрь 2007 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Известно, что восемь семейств растений содержат 64 различных вида бета-карболиновых алкалоидов. По сухому весу семена Пеганум хармала (Сирийская рута) содержат 0,16%[7] и 5,9%[8] β-карболиновые алкалоиды.
В результате наличия β-карболинов в кутикула из скорпионы, их кожа известна флуоресценция при воздействии определенных длин волн ультрафиолетовый свет, такой как производимый черный свет.[9]
Группа производных β-карболина, называемая эвдистомин были извлечены из асцидии (морской оболочки семьи Ascidiacea), подобно Ritterella sigillinoides,[10] Лиссоклин хрупкий [11] или же Золотистая псевдодистома.[12] Ностокарболин был изолирован от пресной воды цианобактерии.
Известно, что производные β-карболина индуцируют образование вторичный метаболит в различных почвенных обитателях видов Streptomyces.[13][14] Известно, что эти молекулы, определяемые как биомедиаторы, усиливают экспрессию вторичный метаболит биосинтетические гены путем связывания с большим регулятором связывания АТФ семейства LuxR.
Смотрите также
Рекомендации
- ^ «β-Карболиновые алкалоидные составляющие из штамма Thermoactinomyces SP., выделенного с острова Ливингстон, Антарктида». Дои:10.5504 / BBEQ.2012.0021. Цитировать журнал требует
| журнал =(помощь) - ^ Venault P, Chapouthier G (2007). «От поведенческой фармакологии бета-карболинов до судорог, беспокойства и памяти». ScientificWorldJournal. 7: 204–23. Дои:10.1100 / tsw.2007.48. ЧВК 5901106. PMID 17334612.
- ^ Mendelson, W .; Каин, М; Cook, J .; Paul, S .; Сколник, П. (1983-01-28). «Антагонист бензодиазепиновых рецепторов уменьшает сон и отменяет снотворное действие флуразепама». Наука. 219 (4583): 414–416. Bibcode:1983Наука ... 219..414М. Дои:10.1126 / science.6294835. ISSN 0036-8075. PMID 6294835. S2CID 43038332.
- ^ Виньони М., Рассе-Суриани Ф.А., Буцбах К., Эрра-Бальселлс Р., Эпе Б., Кабреризо Ф.М. (2013). «Механизмы повреждения ДНК фотовозбужденными 9-метил-β-карболинами». Org Biomol Chem. 11 (32): 5300–9. Дои:10.1039 / c3ob40344k. PMID 23842892.
- ^ Энциклопедия психоактивных растений: этнофармакология и ее приложения. Ратч, Кристиан. Park Street Press c. 2005 г.
- ^ Байгет, Джессика; Ллона-Мингес, Сабин; Ланг, Стюарт; Маккей, Саймон П.; Сосунок, Колин Дж; Сатклифф, Оливер Б. (2011). «Диоксид марганца, опосредованный синтезом метил-9Н-пиридо [3,4-b] индол-1-карбоксилата в одном сосуде: Краткий синтез алангиобуссинина». Журнал органической химии Байльштейна. 7: 1407–11. Дои:10.3762 / bjoc.7.164. ЧВК 3201054. PMID 22043251.
- ^ Хемматинеджад Б., Аббаспур А., Магами Х., Мири Р., Панджешахин М. Р. (август 2006 г.). «Метод многомерной спектральной калибровки на основе частичных наименьших квадратов для одновременного определения производных бета-карболина в экстрактах семян Peganum harmala». Анальный Chim Acta. 575 (2): 290–9. Дои:10.1016 / j.aca.2006.05.093. PMID 17723604.
- ^ Эррайс Т., Гонсалес Д., Ансин-Аспиликуэта С., Аран В.Дж., Гильен Х. (2010). «Алкалоиды бета-карболина в Peganum harmala и ингибирование человеческой моноаминоксидазы (МАО)». Food Chem. Токсикол. 48 (3): 839–43. Дои:10.1016 / j.fct.2009.12.019. HDL:10261/77694. PMID 20036304.
- ^ Stachel SJ, Stockwell SA, van Vranken DL (август 1999 г.). «Флуоресценция скорпионов и катарактогенез». Chem. Биол. 6 (8): 531–9. Дои:10.1016 / S1074-5521 (99) 80085-4. PMID 10421760.
- ^ Озеро Р.Дж., Блант Д.В., Манро М.Х. (1989). «Эвдистомин из новозеландского асцидиана Ritterella sigillinoides". Aust. J. Chem. 42 (7): 1201–1206. Дои:10.1071 / CH9891201.
- ^ Бадре А., Буланже А., Абу-Мансур Е., Банайгс Б., Комбо Г., Франсиско С. (апрель 1994 г.). «Евдистомин U и изоэудистомин U, новые алкалоиды из карибского асцидиана. Лиссоклин хрупкий". J. Nat. Прод. 57 (4): 528–533. Дои:10.1021 / np50106a016. PMID 8021654.
- ^ Дэвис Р.А., Кэрролл А.Р., Куинн Р.Дж. (июнь 1998 г.). «Евдистомин V, новый бета-карболин из австралийского асцидиана. Золотистая псевдодистома". J. Nat. Прод. 61 (7): 959–960. Дои:10.1021 / np9800452. PMID 9677285.
- ^ Панте, S; Такахаши, S; Хаяси, Т; Симидзу, Т; Osada, H (9 апреля 2019 г.). «Биомедиаторы β-карболина индуцируют продукцию реверомицина в Streptomyces sp. SN-593». Научные отчеты. 9 (1): 5802. Дои:10.1038 / с41598-019-42268-ш. PMID 30967594.
- ^ Панте, S; Kito, N; Хаяси, Т; Симидзу, Т; Ishikawa, J; Хамамото, H; Osada, H; Такахаши, С. (23 июня 2020 г.). «Химические сигналы β-карболина индуцируют продукцию реверомицина через регулятор семейства LuxR у Streptomyces sp. SN-593». Научные отчеты. 10 (1): 10230. Дои:10.1038 / с41598-020-66974-у. PMID 32576869.
внешняя ссылка
- Бета-карболины в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- TiHKAL №44
- TiHKAL в целом
- Бета-карболины в кофе
- Фарзин Д., Мансури Н. (июль 2006 г.). «Подобный антидепрессанту эффект гармана и других бета-карболинов в тесте принудительного плавания мышей». Eur Neuropsychopharmacol. 16 (5): 324–8. Дои:10.1016 / j.euroneuro.2005.08.005. PMID 16183262.

