WikiDer > Тетрахлорметан
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Тетрахлорметан, тетрахлорметан | |||
| Другие имена Бензиформ бензиноформ хлористый углерод углерод тет. Фреон-10 Хладагент-10 Галон-104 тетрахлорид метана метилтетрахлорид перхлорметан Тетраформ Тетрасол TCM | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| 1098295 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.000.239 | ||
| Номер ЕС |
| ||
| 2347 | |||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 1846 | ||
| |||
| |||
| Характеристики | |||
| CCl4 | |||
| Молярная масса | 153.81 г / моль | ||
| Внешность | Бесцветная жидкость | ||
| Запах | Милая, хлороформ-подобный запах | ||
| Плотность |
| ||
| Температура плавления | -22,92 ° С (-9,26 ° F, 250,23 К) | ||
| Точка кипения | 76,72 ° С (170,10 ° F, 349,87 К) | ||
| |||
| Растворимость | Растворим в алкоголь, эфир, хлороформ, бензол, нафта, CS2, муравьиная кислота | ||
| бревно п | 2.64 | ||
| Давление газа | 11.94 кПа при 20 ° C | ||
Закон Генри постоянный (kЧАС) | 2.76×10−2 атм · м3/ моль | ||
| −66.60×10−6 см3/ моль | |||
| Теплопроводность | 0.1036 Вт / м · К (300 K)[1] | ||
| 1.4607 | |||
| Вязкость | 0.86 мПа · с[2] | ||
| 0 Д | |||
| Структура | |||
| Моноклиника | |||
| Тетрагональный | |||
| Тетраэдр | |||
| 0 D | |||
| Термохимия | |||
Теплоемкость (C) | 132.6 Дж / моль · К | ||
Стандартный моляр энтропия (S | 214.42 Дж / моль · К | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −139.3 кДж / моль | ||
Свободная энергия Гиббса (Δжграмм˚) | −686 кДж / моль | ||
| Опасности | |||
| Паспорт безопасности | Видеть: страница данных ICSC 0024 | ||
| Пиктограммы GHS |    | ||
| Сигнальное слово GHS | Опасность | ||
| H301, H311, H331, H351, H372, H412, H420 | |||
| P201, P202, P260, P261, P264, P270, P271, P273, P280, P281, P301 + 310, P302 + 352, P304 + 340, P308 + 313, P311, P312, P314, P321, P322, P330, P361, P363, P403 + 233, P405, P501 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | <982 ° C | ||
| 982 ° С (1800 ° F, 1255 К) | |||
| Смертельная доза или концентрация (LD, LC): | |||
LD50 (средняя доза) | 2350 мг / кг | ||
LC50 (средняя концентрация) |
| ||
LCLo (самый низкий опубликованный) |
| ||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | TWA 10 частей на миллион C 25 частей на миллион 200 ppm (максимум 5 минут за любые 4 часа)[3] | ||
REL (Рекомендуемые) | Ca ST 2 частей на миллион (12,6 мг / м3) [60 минут][3] | ||
IDLH (Непосредственная опасность) | 200 промилле[3] | ||
| Родственные соединения | |||
Другой катионы | Кремния тетрахлорид Тетрахлорид германия Тетрахлорид олова Тетрахлорид свинца | ||
Родственные хлорметаны | Хлорметан Дихлорметан Хлороформ | ||
Родственные соединения | Тетрафторметан Тетрабромметан Тетраиодметан | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Тетрахлорметан, также известный под многими другими именами (например, тетрахлорметан, также признан IUPAC, углеродная тетрадь в клининговая промышленность, Галон-104 в пожаротушении и Хладагент-10 в HVACR) является органическое соединение с химическая формула CCl4. Это бесцветная жидкость со «сладким» запахом, который можно обнаружить при низких уровнях. Практически нет воспламеняемость при более низких температурах. Ранее он широко использовался в огнетушители, как предшественник хладагенты и как чистящее средство, но с тех пор был прекращен из-за опасений токсичности и безопасности. Воздействие высоких концентраций четыреххлористого углерода (включая пар) может повлиять на Центральная нервная система и дегенерируют печень и почки. Продолжительное воздействие может быть смертельным.
Характеристики
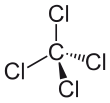
В четыреххлористом углероде молекула, четыре хлор атомы расположены симметрично, как углы в четырехгранный конфигурация соединена с центральным углерод атом за один ковалентные связи. Из-за этой симметричной геометрии CCl4 неполярный. Газ метан имеет ту же структуру, что делает четыреххлористый углерод галометан. Как растворитель, он хорошо подходит для растворения других неполярных соединений, таких как жиры и масла. Он также может растворяться йод. Это несколько летучий, испуская пары с запахом, характерным для других хлорированных растворителей, чем-то похожим на запах тетрахлорэтилен запах напоминает химчисткамагазины.
Твердый тетрахлорметан имеет два полиморфы: кристаллический II ниже -47,5 ° C (225,6 K) и кристаллический I выше -47,5 ° C.[5] При -47,3 ° C он имеет моноклинический кристаллическая структура с пространственной группой C2 / c и постоянные решетки а = 20.3, б = 11.6, c = 19.9 (.10−1 нм), β = 111 °.[6]
С удельный вес больше 1, четыреххлористый углерод будет присутствовать в виде плотная неводная фаза жидкости если в окружающую среду попало достаточное количество.
История и синтез
Тетрахлорметан был первоначально синтезирован французским химиком. Анри Виктор Рено в 1839 г. по реакции хлороформ с хлором,[7] но сейчас его в основном производят из метан:
- CH4 + 4 кл2 → CCl4 + 4 HCl
В производстве часто используются побочные продукты других производителей. хлорирование реакции, например, при синтезе дихлорметан и хлороформ. Высшие хлоруглероды также подвергаются «хлоринолизу»:
- C2Cl6 + Cl2 → 2 CCl4
До 1950-х годов четыреххлористый углерод производился путем хлорирования сероуглерод от 105 до 130 ° C:[8]
Производство тетрахлорметана резко снизилось с 1980-х годов из-за экологических проблем и снижения спроса на ХФУ, которые были получены из четыреххлористого углерода. В 1992 году производство в США / Европе / Японии оценивалось в 720 000 тонн.[8]
Безопасность
Тетрахлорметан - один из самых сильнодействующих гепатотоксины (токсичен для печени), настолько, что широко используется в научных исследованиях для оценки гепатопротекторных агентов.[9][10] Воздействие высоких концентраций четыреххлористого углерода (включая пар) может повлиять на Центральная нервная система и дегенерировать печень[10] и почки,[11] и длительное воздействие может привести к кома или же смерть.[12] Хроническое воздействие тетрахлорметана может вызвать: печень[13][14] и повреждение почек и может привести к рак.[15] Видеть паспорта безопасности.[16]
Воздействие тетрахлорметана на здоровье человека и окружающую среду оценивалось в ДОСТИГАТЬ в 2012 году в контексте оценки вещества, проведенной Францией. После этого у регистрантов была запрошена дополнительная информация. Позже это решение было отменено.[17]
В 2008 году исследование обычных чистящих средств показало присутствие тетрахлорметана в «очень высоких концентрациях» (до 101 мг / м3.3) в результате смешивания производителями поверхностно-активных веществ или мыла с гипохлорит натрия (отбеливать).[18]
Тетрахлорид углерода также является озоноразрушающий[19] и парниковый газ.[20] Однако с 1992 г.[21] его атмосферные концентрации снижаются по причинам, описанным выше (см. графики атмосферных концентраций в галерея). CCl4 имеет время жизни в атмосфере 85 лет.[22]
При высоких температурах воздуха он разлагается или горит с образованием ядовитых веществ. фосген.
Токсикологические исследования
Тетрахлорметан - подозреваемый человек канцероген основано на достаточных доказательствах канцерогенности в исследованиях на экспериментальных животных.[23] Всемирная организация здоровья Сообщается, что тетрахлорметан может вызывать гепатомы и гепатоцеллюлярные карциномы у мышей и крыс. Дозы, вызывающие опухоли печени, выше, чем дозы, вызывающие токсичность клеток.[24] В Международное агентство по изучению рака (IARC) классифицировал это соединение как Группа 2Б, возможно канцерогенный для человека.[25]
Использует
В органическая химия, тетрахлорметан служит источником хлора в Реакция Аппеля.
Одно специальное использование тетрахлорметана - Филателия, чтобы раскрыть водяные знаки на почтовых марках, не повредив их. Небольшое количество жидкости помещают на обратную сторону штампа в черный стакан или обсидиановый поднос. Тогда можно будет отчетливо увидеть буквы или рисунок водяного знака.
Историческое использование
Тетрахлорметан широко применялся в качестве сухая чистка растворитель, как хладагент, И в лавовые лампы.[26] В последнем случае четыреххлористый углерод является ключевым ингредиентом, который увеличивает вес плавучего воска.
Растворитель
Когда-то это был популярный растворитель в органической химии, но из-за его неблагоприятного воздействия на здоровье сегодня он используется редко.[9] Иногда используется в качестве растворителя для ИК-спектроскопия, поскольку значительных полос поглощения выше 1600 см−1. Поскольку четыреххлористый углерод не имеет атомов водорода, он исторически использовался в протонной ЯМР-спектроскопия. Помимо того, что он токсичен, его растворяющая способность низкая.[27] Его использование в спектроскопии ЯМР было в значительной степени заменено дейтерированные растворители. Использование четыреххлористого углерода для определения масла было заменено различными другими растворителями, такими как тетрахлорэтилен.[9] Поскольку четыреххлористый углерод не имеет связей C – H, свободнорадикальные реакции. Это полезный растворитель для галогенирование либо элементалью галоген или реагентом галогенирования, таким как N-бромосукцинимид (эти условия известны как Бромирование Воля-Циглера).
Пожаротушение
В 1910 году компания Pyrene Manufacturing Company из Делавэра подала патент на использование тетрахлорметана для тушения пожаров.[28] Жидкость испарялась из-за высокой температуры сгорания и потухшего пламени, ранней формы газовое пожаротушение. В то время считалось, что газ просто вытесняет кислород в области возле огня, но более поздние исследования показали, что газ фактически подавляет химическую цепную реакцию процесса горения.
В 1911 году Пирен запатентовал небольшой портативный огнетушитель, в котором использовалось это химическое вещество.[29] Огнетушитель состоял из латунь Бутылка со встроенным ручным насосом, который использовался для выпуска струи жидкости в сторону огня. Поскольку в контейнере не было давления, его можно было легко пополнить после использования.[30] Тетрахлорметан подходит для жидкостных и электрических пожаров, а огнетушители часто переносятся на самолетах или автомобилях.
В первой половине 20 века еще одним обычным огнетушителем был одноразовый запечатанный стеклянный шар, известный как «огненная граната», наполненный либо четыреххлористым углеродом, либо соленой водой. Лампочку можно было бросить в основание пламени, чтобы погасить огонь. Тип четыреххлористого углерода также может быть установлен в подпружиненный настенный светильник с припаятьоснованная на сдержанности. Когда припой расплавлялся под воздействием высокой температуры, пружина либо ломала шар, либо выбрасывала его из кронштейна, позволяя огнетушащему веществу автоматически рассеиваться в огне. Хорошо известным брендом была «Красная комета», которая производилась по-разному с другим противопожарным оборудованием в Денвере, штат Колорадо, компанией Red Comet Manufacturing Company с момента ее основания в 1919 году до закрытия производственных операций в начале 1980-х годов.[31]
Хладагенты
До Монреальский протокол, большое количество тетрахлорметана использовалось для производства хлорфторуглерод хладагенты R-11 (трихлорфторметан) и Р-12 (дихлордифторметан). Однако эти хладагенты играют роль в истощение озонового слоя и были прекращены. Тетрахлорметан все еще используется для производства менее разрушительных хладагентов. Тетрахлорметан из тяжелых хлор-37 использовался при обнаружении нейтрино.
Галерея
Рекомендации
- ^ Тулукиан Ю.С., Лили П.Е., Саксена С.С. Теплофизические свойства вещества - ряд данных TPRC. Том 3. Теплопроводность - неметаллические жидкости и газы. Книга данных. 1970 г.
- ^ Рид, Роберт С .; Prausnitz, John M .; Полинг, Брюс Э. (1987), Свойства газов и жидкостей, McGraw-Hill Book Company, стр. 442, г. ISBN 0-07-051799-1
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0107". Национальный институт охраны труда и здоровья (NIOSH).
- ^ а б «Тетрахлорметан». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ «Тетрахлорид углерода». webbook.nist.gov. В архиве с оригинала 30 июня 2017 г.. Получено 28 апреля 2018.
- ^ Ф. Брезина, Дж. Моллин, Р. Пасторек, З. Синделар. Chemicke tabulky anorganickych sloucenin (Химические таблицы неорганических соединений). СНТЛ, 1986.
- ^ В. Реньо (1839) "Sur les chlorures de carbone CCl et CCl"2" (О хлоридах углерода CCl и CCl2 ), Annales de Chimie et de Physique, т. 70, страницы 104-107. Перепечатано на немецком языке как: В. Реньо (1839). "Ueber die Chlorverbindungen des Kohlenstoffs, C2Cl2 и CCl2". Annalen der Pharmacie. 30 (3): 350–352. Дои:10.1002 / jlac.18390300310.
- ^ а б Манфред Россберг, Вильгельм Лендле, Герхард Пфлайдерер, Адольф Тёгель, Эберхард-Людвиг Дреер, Эрнст Лангер, Хайнц Яертс, Петер Кляйншмидт, Хайнц Штрак, Ричард Кук, Уве Бек, Карл-Август Липпер, Теодор Р. Торкельсон, Эклаус Липер Бойтель, «Хлорированные углеводороды» в Энциклопедии промышленной химии Ульмана, 2006 г. Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a06_233.pub2
- ^ а б c Использование озоноразрушающих веществ в лабораториях. ТемаНорд 516/2003. В архиве 27 февраля 2008 г. Wayback Machine
- ^ а б Зейферт В. Ф., Босма А., Брауэр А. и др. (Январь 1994 г.). «Дефицит витамина А усиливает фиброз печени, вызванный тетрахлорметаном у крыс». Гепатология. 19 (1): 193–201. Дои:10.1002 / hep.1840190129. PMID 8276355.CS1 maint: использует параметр авторов (связь)
- ^ Лю К. X., Като Ю., Ямадзаки М., Хигучи О., Накамура Т., Сугияма Ю. (апрель 1993 г.). «Снижение печеночного клиренса фактора роста гепатоцитов у крыс, отравленных тетрахлорметаном». Гепатология. 17 (4): 651–60. Дои:10.1002 / hep.1840170420. PMID 8477970.CS1 maint: использует параметр авторов (связь)
- ^ Рекнагель Р. О .; Glende E. A .; Dolak J. A .; Уоллер Р. Л. (1989). «Механизм токсичности четыреххлористого углерода». Фармакология и терапия. 43 (43): 139–154. Дои:10.1016/0163-7258(89)90050-8. PMID 2675128.
- ^ Рекнагель Р. О. (июнь 1967 г.). «Гепатотоксичность тетрахлорметана». Pharmacol. Rev. 19 (2): 145–208. PMID 4859860.
- ^ Масуда Ю. (октябрь 2006 г.). «[Изучение токсикологии на основе гепатотоксичности, вызванной тетрахлорметаном]». Якугаку Засши (на японском языке). 126 (10): 885–99. Дои:10.1248 / yakushi.126.885. PMID 17016019.
- ^ Руд А. С., МакГэвран П. Д., Аненсон Дж. У., Тилл Дж. Э. (август 2001 г.). «Стохастические оценки воздействия и риска рака из-за выброса тетрахлорметана в воздух заводом по производству каменистых отмелей». Риск анальный. 21 (4): 675–95. Дои:10.1111/0272-4332.214143. PMID 11726020.CS1 maint: использует параметр авторов (связь)
- ^ Паспорт безопасности материала, тетрахлорметан В архиве 2010-09-13 на Wayback Machine в Fisher Scientific.
- ^ «Оценка вещества - CoRAP - ECHA». echa.europa.eu. В архиве с оригинала от 20 августа 2016 г.. Получено 28 апреля 2018.
- ^ Одабаси М. (2008). «Галогенированные летучие органические соединения от использования хлорсодержащих бытовых продуктов». Экологические науки и технологии. 42 (5): 1445–51. Bibcode:2008EnST ... 42.1445O. Дои:10.1021 / es702355u. PMID 18441786.
- ^ Фрейзер П. (1997). «Химия стратосферного озона и разрушение озона». Австралийский метеорологический журнал. 46 (3): 185–193.
- ^ Эванс В. Ф. Дж., Пакрин Э. (1996). "Измерение парникового излучения, связанного с тетрахлорметаном (CCl4)". Письма о геофизических исследованиях. 23 (14): 1769–72. Bibcode:1996GeoRL..23.1769E. Дои:10.1029 / 96GL01258.CS1 maint: использует параметр авторов (связь)
- ^ Уокер, С. Дж .; Вайс Р. Ф. и Саламех П. К. (2000). «Реконструированные истории среднегодовых мольных долей в атмосфере для галогенуглеродов CFC-11, CFC-12, CFC-113 и четыреххлористого углерода». Журнал геофизических исследований. 105 (C6): 14285–96. Bibcode:2000JGR ... 10514285 Вт. Дои:10.1029 / 1999JC900273.
- ^ Атлас изменения климата (2006 г.) Кирстин Доу и Томас Э. Даунинг ISBN 978-0-520-25558-6
- ^ "Отчет о канцерогенных веществах, четырнадцатое издание - тетрахлорметан" (PDF). ntp.niehs.nih.gov.
- ^ «Критерии гигиены окружающей среды 208: ТЕТРАХЛОРИД УГЛЕРОДА» (PDF). who.int.
- ^ «Заявление общественного здравоохранения о тетрахлорметане (Tetracloruro de Carbono)». atsdr.cdc.gov.
- ^ Доэрти Р. Э. (2000). «История производства и использования тетрахлорметана, тетрахлорэтилена, трихлорэтилена и 1,1,1-трихлорэтана в Соединенных Штатах: часть 1 - историческая справка; тетрахлорметан и тетрахлорэтилен». Экологическая экспертиза. 1 (2): 69–81. Дои:10.1006 / enfo.2000.0010.
- ^ W. Reusch. «Введение в спектроскопию ядерного магнитного резонанса». Виртуальный учебник органической химии. Университет штата Мичиган. Архивировано из оригинал 31 августа 2006 г.
- ^ Патент США 1,010,870 , поданной 5 апреля 1910 г.
- ^ Патент США 1105263 , поданной 7 января 1911 г.
- ^ «Пиреновые огнетушители». Старинные огнетушители. Архивировано из оригинал 25 марта 2010 г.. Получено 23 декабря 2009.
- ^ "Производственная компания Красная Комета". Город Литтлтон, Колорадо. В архиве из оригинала на 1 октября 2016 г.. Получено 30 сентября 2016.
внешняя ссылка
- Международная карта химической безопасности 0024
- Карманный справочник NIOSH по химической опасности. "#0107". Национальный институт охраны труда и здоровья (NIOSH).
- «Тетрахлорид углерода (Группа 2В)». Международное агентство по изучению рака (IARC) - Обзоры и оценки. 71: 401. 1999.
- Монография МАИР: «Тетрахлорид углерода»
- Токсикологический профиль тетрахлорметана
- Критерии гигиены окружающей среды для тетрахлорметана
- Паспорт безопасности содержания тетрахлорметана в базе данных по опасным химическим веществам
- Профиль вещества на ntp.niehs.nih.gov
- ChemSub Online: четыреххлористый углерод