WikiDer > Свойства воды
 | |||
 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК вода, оксидан | |||
| Другие имена Гидроксид водорода (HH или HOH), оксид водорода, монооксид дигидрогена (DHMO) (систематическое название[1]), оксид дигидрогена, соляная кислота, гидроксидная кислота, гидроксильная кислота, гидрол,[2] μ-оксидодигидроген, κ1-гидроксил водорода (0) | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| 3587155 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| 117 | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| |||
| Характеристики | |||
| ЧАС 2О | |||
| Молярная масса | 18,01528 (33) г / моль | ||
| Внешность | Белое кристаллическое твердое вещество, почти бесцветная жидкость с оттенком голубого бесцветного газа.[3] | ||
| Запах | Никто | ||
| Плотность | Жидкость:[4] 0,9998396 г / мл при 0 ° C 0,9970474 г / мл при 25 ° C 0,961893 г / мл при 95 ° C Твердый:[5] 0,9167 г / мл при 0 ° C | ||
| Температура плавления | 0,00 ° С (32,00 ° F, 273,15 К) [а] | ||
| Точка кипения | 99,98 ° С (211,96 ° F, 373,13 К) [6][а] | ||
| Нет данных | |||
| Растворимость | Плохо растворим в галогеналканы, алифатический и ароматный углеводороды, эфиры.[7] Повышенная растворимость в карбоксилаты, спирты, кетоны, амины. Смешивается с метанол, этиловый спирт, пропанол, изопропанол, ацетон, глицерин, 1,4-диоксан, тетрагидрофуран, сульфолан, ацетальдегид, диметилформамид, диметоксиэтан, диметилсульфоксид, ацетонитрил. Частично смешивается с Диэтиловый эфир, Метилэтилкетон, Дихлорметан, Ацетат этила, Бром. | ||
| Давление газа | 3,1690 килопаскалей или 0,031276 атм при 25 ° C[8] | ||
| Кислотность (пKа) | 13.995[9][10][b] | ||
| Основность (пKб) | 13.995 | ||
| Конъюгированная кислота | Гидроний | ||
| Основание конъюгата | Гидроксид | ||
| Теплопроводность | 0,6065 Вт / (м · К)[13] | ||
| 1,3330 (20 ° С)[14] | |||
| Вязкость | 0,890 мПа · с (0,890 cP)[15] | ||
| Структура | |||
| Шестиугольный | |||
| C2v | |||
| Согнутый | |||
| 1.8546 D[16] | |||
| Термохимия | |||
Теплоемкость (C) | 75,385 ± 0,05 Дж / (моль · К)[17] | ||
Стандартный моляр энтропия (S | 69,95 ± 0,03 Дж / (моль · К)[17] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -285,83 ± 0,04 кДж / моль[7][17] | ||
Свободная энергия Гиббса (Δжграмм˚) | -237,24 кДж / моль[7] | ||
| Опасности | |||
| Главный опасности | Утопление Лавина (как снег)
| ||
| Паспорт безопасности | SDS | ||
| H317 | |||
| NFPA 704 (огненный алмаз) | |||
| точка возгорания | Негорючий | ||
| Родственные соединения | |||
Другой катионы | Сероводород Селенид водорода Теллурид водорода Полонид водорода Пероксид водорода | ||
Связанный растворители | Ацетон Метанол | ||
| Страница дополнительных данных | |||
| Показатель преломления (п), Диэлектрическая постоянная (εр), так далее. | |||
Термодинамический данные | Фазовое поведение твердое тело – жидкость – газ | ||
| УФ, ИК, ЯМР, РС | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Вода (ЧАС
2О) это полярный неорганическое соединение это в комнатная температура безвкусный и без запаха жидкость, который почти бесцветен, кроме врожденный намек на синий. Это, безусловно, наиболее изученное химическое соединение.[18] и описывается как "универсальный растворитель"[19] и «растворитель жизни».[20] Это самое распространенное вещество на земной шар[21] и единственная общая субстанция, существующая как твердый, жидкость и газ на поверхности Земли.[22] Это также третья по численности молекула во Вселенной (после молекулярный водород и монооксид углерода).[21]
Молекулы воды образуют водородные связи друг с другом и сильно полярны. Эта полярность позволяет ему диссоциировать ионы в солях и связываются с другими полярными веществами, такими как спирты и кислоты, тем самым растворяя их. Его водородные связи обуславливают его многие уникальные свойства, такие как наличие менее плотной твердой формы, чем ее жидкая форма,[c] относительно высокий точка кипения 100 ° C для молярная масса, и высокий теплоемкость.
Вода амфотерный, что означает, что он может проявлять свойства кислоты или основания, в зависимости от pH раствора, в котором он находится; он легко производит оба ЧАС+
и ОЙ−
ионы.[c] Из-за амфотерного характера он подвергается самоионизация. Продукт виды деятельности, или приблизительно, концентрации ЧАС+
и ОЙ−
является константой, поэтому их соответствующие концентрации обратно пропорциональны друг другу.[23]
Физические свойства
Вода - это химическая субстанция с химическая формула ЧАС
2О; один молекула воды имеет два водород атомы ковалентно связанный к одному кислород атом.[24]Вода - безвкусная жидкость без запаха при температура и давление окружающей среды. Жидкая вода имеет слабую полосы поглощения на длинах волн около 750 нм, из-за чего кажется, что он имеет синий цвет.[3] Это легко увидеть в ванне или умывальнике, наполненном водой, с белой подкладкой. Крупные кристаллы льда, как в ледники, также отображаются синим цветом.
Под стандартные условия, вода - это прежде всего жидкость, в отличие от других аналогичных гидридов кислородная семья, которые обычно газообразны. Это уникальное свойство воды связано с водородная связь. Молекулы воды постоянно движутся относительно друг друга, а водородные связи непрерывно разрываются и реформируются во времени быстрее, чем 200 фемтосекунд (2 × 10−13 секунд).[25]Тем не менее, эти связи достаточно сильны, чтобы создавать многие из специфических свойств воды, некоторые из которых делают ее неотъемлемой частью жизни.
Вода, лед и пар
В атмосфере и на поверхности Земли жидкая фаза является наиболее распространенной формой, которую обычно обозначают словом «вода». В твердая фаза воды известен как лед и обычно принимает структуру твердых, амальгамированных кристаллы, Такие как кубики льда, или слабо накопленный гранулированный кристаллы, как снег. Помимо обычный гексагональный кристаллический лед, прочие кристаллические и аморфные фазы льда известны. В газовая фаза воды известен как водяной пар (или же пар). Видимый пар и облака образуются из мельчайших капелек воды, взвешенных в воздухе.
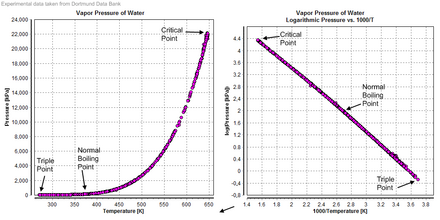
Вода также образует сверхкритическая жидкость. В критическая температура 647 K и критическое давление 22,064 МПа. В природе такое случается редко в крайне неблагоприятных условиях. Вероятный пример естественной сверхкритической воды находится в самых горячих частях глубоководья. гидротермальные источники, в котором вода нагревается до критической температуры за счет вулканический перья а критическое давление вызвано весом океана на крайней глубине, где расположены жерла. Это давление достигается на глубине около 2200 метров, что намного меньше средней глубины океана (3800 метров).[26]
Теплоемкость и теплота испарения и плавления
Вода имеет очень высокий удельная теплоемкость 4181,4 Дж / (кг · К) при 25 ° C - второй по величине среди всех гетероатомных видов (после аммиак), а также высокий теплота испарения (40,65 кДж / моль или 2257 кДж / кг при нормальной температуре кипения), оба из которых являются результатом обширного водородная связь между его молекулами. Эти два необычных свойства позволяют воде смягчать земные климат буферизируя большие колебания температуры. Большая часть дополнительной энергии, накопленной в климатической системе с 1970 года, аккумулирована в океанах.[27]
Конкретные энтальпия плавления (более известная как скрытая теплота) воды составляет 333,55 кДж / кг при 0 ° C: для таяния льда требуется такое же количество энергии, как для нагрева льда от -160 ° C до точки его плавления или для нагрева такого же количества воды примерно на 80 ° C. Из обычных веществ выше только аммиак. Это свойство придает устойчивость к таянию льда ледники и дрейфующий лед. До и после появления механических охлаждение, лед был и до сих пор широко используется для замедления порчи пищевых продуктов.
Удельная теплоемкость льда при −10 ° C составляет 2030 Дж / (кг · К).[28]а теплоемкость пара при 100 ° C составляет 2080 Дж / (кг · К).[29]
Плотность воды и льда
В плотность воды составляет около 1 грамма на кубический сантиметр (62 фунта / куб фут): это соотношение изначально использовалось для определения грамма.[30] Плотность изменяется с температурой, но не линейно: по мере увеличения температуры плотность повышается до пика при 3,98 ° C (39,16 ° F), а затем уменьшается;[31] это необычно.[d] Обычный, шестиугольный лед также менее плотный, чем жидкая вода - при замерзании плотность воды уменьшается примерно на 9%.[34][e]
Эти эффекты связаны с уменьшением теплового движения при охлаждении, что позволяет молекулам воды образовывать больше водородных связей, которые не позволяют молекулам приближаться друг к другу.[31] В то время как при температуре ниже 4 ° C разрыв водородных связей из-за нагрева позволяет молекулам воды сближаться, несмотря на увеличение теплового движения (которое имеет тенденцию расширять жидкость), при температуре выше 4 ° C вода расширяется при повышении температуры.[31] Вода, близкая к точке кипения, примерно на 4% менее плотная, чем вода при температуре 4 ° C (39 ° F).[34][f]
Под повышением давления лед претерпевает ряд переходов в другие полиморфы с более высокой плотностью, чем жидкая вода, например лед II, лед III, аморфный лед высокой плотности (HDA) и аморфный лед очень высокой плотности (VHDA).[35][36]
Необычная кривая плотности и более низкая плотность льда, чем у воды, жизненно важны для жизни - если бы вода была наиболее плотной в точке замерзания, то зимой очень холодная вода на поверхности озер и других водоемов тонула бы, озера могли бы замерзнуть. снизу вверх, и все живое в них погибнет.[34] Кроме того, учитывая, что вода является хорошим теплоизолятором (из-за ее теплоемкости), некоторые замерзшие озера летом могут не полностью оттаивать.[34] Слой льда, который плавает сверху, изолирует воду внизу.[37] Вода с температурой около 4 ° C (39 ° F) также опускается на дно, таким образом поддерживая температуру воды на дне постоянной (см. Диаграмму).[34]
Плотность соленой воды и льда

Плотность соленой воды зависит от содержания растворенной соли, а также от температуры. Лед все еще плавает в океанах, иначе они бы замерзли снизу вверх. Однако содержание соли в океанах снижает температуру замерзания примерно на 1,9 ° C.[38] (видеть здесь для объяснения) и понижает температуру максимума плотности воды до прежней точки замерзания при 0 ° C. Вот почему в океанской воде нисходящая конвекция более холодной воды нет блокируется расширением воды, так как она становится холоднее около точки замерзания. Холодная вода океанов около точки замерзания продолжает тонуть. Итак, существа, обитающие на дне холодных океанов, такие как Арктический океан обычно живут в воде на 4 ° C холоднее, чем на дне замерзшего пресная вода озера и реки.
Как поверхность соленой воды начинает замерзать (при -1,9 ° C[38] для нормальной солености морская вода3,5%) образующийся лед практически не содержит соли и имеет примерно такую же плотность, как и пресноводный лед. Этот лед плавает на поверхности, а «замороженная» соль добавляет соленость и плотность морской воды чуть ниже, в процессе, известном как отказ от рассола. Эта более плотная соленая вода опускается за счет конвекции, и замещающая морская вода подвергается тому же процессу. В результате получается пресноводный лед при -1,9 ° C.[38] на поверхности. Повышенная плотность морской воды под формирующимся льдом заставляет его опускаться ко дну. В больших масштабах процесс отклонения рассола и опускания холодной соленой воды приводит к формированию океанских течений, которые переносят такую воду от полюсов, что приводит к глобальной системе течений, называемой термохалинная циркуляция.
Смешиваемость и конденсация
Вода смешивающийся со многими жидкостями, в том числе этиловый спирт во всех пропорциях. Вода и большая часть масла обычно не смешиваются, образуя слои в зависимости от увеличения плотности сверху. Это можно предсказать, сравнив полярность. Вода, являющаяся относительно полярным соединением, будет иметь тенденцию смешиваться с жидкостями высокой полярности, такими как этанол и ацетон, тогда как соединения с низкой полярностью будут иметь тенденцию быть несмешиваемыми и плохо смешиваемыми. растворимый например, с углеводороды.
В качестве газа водяной пар полностью смешивается с воздухом. С другой стороны, максимальная вода давление газа которое является термодинамически стабильным с жидкостью (или твердым телом) при данной температуре, относительно низкое по сравнению с общим атмосферным давлением. Например, если пар частичное давление составляет 2% от атмосферного давления, и воздух охлаждается от 25 ° C, начиная с примерно 22 ° C вода начинает конденсироваться, определяя точка росы, и создание туман или же роса. Обратный процесс объясняет, что туман сгорает утром. Если влажность повышается при комнатной температуре, например, при использовании горячего душа или ванны, а температура остается примерно такой же, пар вскоре достигает давления для фазового перехода, а затем конденсируется в виде мельчайших капель воды, обычно называемых как пар.
Насыщенный газ или газ с относительной влажностью 100% - это когда давление пара воды в воздухе находится в равновесии с давлением пара из-за (жидкой) воды; вода (или лед, если она достаточно холодная) не теряет массу за счет испарения при воздействии насыщенного воздуха. Поскольку количество водяного пара в воздухе невелико, относительная влажность, отношение парциального давления водяного пара к парциальному давлению насыщенного пара является гораздо более полезным. Давление пара выше 100% относительной влажности называется перенасыщенным и может произойти, если воздух быстро охлаждается, например, из-за внезапного восходящего потока.[грамм]
Давление газа
Сжимаемость
В сжимаемость воды является функцией давления и температуры. При 0 ° C на пределе нулевого давления сжимаемость составляет 5.1×10−10 Па−1. На пределе нулевого давления сжимаемость достигает минимум 4.4×10−10 Па−1 около 45 ° C, а затем снова увеличится с увеличением температуры. По мере увеличения давления сжимаемость уменьшается, составляя 3.9×10−10 Па−1 при 0 ° C и 100 мегапаскалей (1000 бар).[39]
В объемный модуль воды составляет около 2,2 ГПа.[40] Низкая сжимаемость негазовых газов, в частности воды, приводит к тому, что их часто считают несжимаемыми. Низкая сжимаемость воды означает, что даже в глубоких океаны на глубине 4 км, где давление составляет 40 МПа, объем уменьшается всего на 1,8%.[40]
Тройная точка

В температура и давление при котором обычная твердая, жидкая и газообразная вода сосуществуют в равновесии, является тройная точка воды. С 1954 года эта точка использовалась для определения базовой единицы температуры, кельвин[41][42] но, начиная с 2019 года, теперь кельвин определяется с помощью Постоянная Больцмана, а не тройная точка воды.[43]
Из-за существования многих полиморфы (образует) лед, вода имеет другие тройные точки, которые имеют либо три полиморфа льда, либо два полиморфа льда и жидкости в равновесии.[42] Густав Генрих Иоганн Аполлон Тамманн в Геттингене были получены данные по нескольким другим тройным точкам в начале 20 века. Камб и другие задокументировали дальнейшие тройные точки в 1960-х годах.[44][45][46]
| Фазы в устойчивом равновесии | Давление | Температура |
|---|---|---|
| жидкая вода, лед ячас, и водяной пар | 611,657 Па[47] | 273,16 К (0,01 ° С) |
| жидкая вода, лед Iчас, и лед III | 209,9 МПа | 251 К (-22 ° С) |
| жидкая вода, лед III и лед V | 350,1 МПа | -17,0 ° С |
| жидкая вода, лед V и лед VI | 632,4 МПа | 0,16 ° С |
| лед ячас, Лед II, и лед III | 213 МПа | −35 ° С |
| лед II, лед III и лед V | 344 МПа | −24 ° С |
| лед II, лед V и лед VI | 626 МПа | −70 ° С |
Температура плавления
Температура плавления льда составляет 0 ° C (32 ° F; 273 K) при стандартном давлении; однако чистая жидкая вода может быть переохлажденный значительно ниже этой температуры без замерзания, если жидкость не подвергается механическим воздействиям. Он может оставаться в жидком состоянии вплоть до однородного состояния. зарождение температура около 231 K (-42 ° C; -44 ° F).[48] Температура плавления обычного гексагонального льда немного падает при умеренно высоком давлении, на 0,0073 ° C (0,0131 ° F) / атм.[час] или около 0,5 ° C (0,90 ° F) / 70 атм.[я][49] поскольку энергия стабилизации водородных связей превосходит межмолекулярное отталкивание, но когда лед превращается в свои полиморфы (см. кристаллическое состояние льда) выше 209,9 МПа (2072 атм.) температура плавления заметно возрастает. с давлением, т.е. достигая 355 К (82 ° C) при 2,216 ГПа (21870 атм) (тройная точка Лед VII[50]).
Электрические свойства
Электрическая проводимость
Чистая вода, не содержащая экзогенных ионы отличный изолятор, но даже «деионизированная» вода не полностью свободна от ионов. Вода подвергается автоионизация в жидком состоянии, когда две молекулы воды образуют один гидроксид-анион (ОЙ−
) и один катион гидроксония (ЧАС
3О+
).
Поскольку вода является таким хорошим растворителем, в ней почти всегда есть растворенное вещество растворяется в нем, часто соль. Если в воде есть хотя бы крошечное количество такой примеси, ионы могут переносить заряды туда и обратно, что позволяет воде гораздо легче проводить электричество.
Известно, что теоретическое максимальное электрическое сопротивление воды составляет примерно 18,2 МОм · см (182 кОм· М) при 25 ° С.[51] Эта цифра хорошо согласуется с тем, что обычно можно увидеть на обратный осмос, ультрафильтрованный и системы деионизированной сверхчистой воды, используемые, например, на заводах по производству полупроводников. Уровень примесей соли или кислоты, превышающий даже 100 частей на триллион (ppt) в сверхчистой воде в остальном, начинает заметно снижать ее удельное сопротивление на величину до нескольких кОм · м.[нужна цитата]
В чистой воде чувствительное оборудование может обнаружить очень незначительное электрическая проводимость 0,05501 ± 0,0001 мкСм/см при 25,00 ° С.[51] Вода также может быть электролизованный в газообразные кислород и водород, но в отсутствие растворенных ионов это очень медленный процесс, так как ток проходит очень мало. Во льду основными носителями заряда являются протоны (видеть протонный проводник).[52] Ранее считалось, что лед имеет небольшую, но измеримую проводимость 1×10−10 См / см, но теперь считается, что эта проводимость почти полностью обусловлена поверхностными дефектами, а без них лед является изолятором с неизмеримо малой проводимостью.[31]
Полярность и водородная связь
Важной особенностью воды является ее полярный характер. В конструкции есть изогнутая молекулярная геометрия для двух атомов водорода из кислородной вершины. Атом кислорода также имеет два одинокие пары электронов. Один эффект, который обычно приписывают неподеленным парам, заключается в том, что угол изгиба газовой фазы H – O – H составляет 104,48 °,[53] что меньше типичного четырехгранный угол 109,47 °. Неподеленные пары ближе к атому кислорода, чем электроны. сигма связана к водородам, поэтому им требуется больше места. Повышенное отталкивание неподеленных пар сближает связи O – H друг с другом.[54]
Еще одно следствие его структура это вода полярная молекула. Из-за разницы в электроотрицательность, а дипольный момент связи точки от каждой H к O, делая кислород частично отрицательным, а каждый водород частично положительным. Большой молекулярный диполь, указывает из области между двумя атомами водорода на атом кислорода. Разница в зарядах заставляет молекулы воды агрегироваться (относительно положительные области притягиваются к относительно отрицательным областям). Этот аттракцион, водородная связь, объясняет многие свойства воды, например ее растворяющие свойства.[55]
Хотя водородная связь является относительно слабым притяжением по сравнению с ковалентными связями внутри самой молекулы воды, она отвечает за ряд физических свойств воды. Эти свойства включают его относительно высокую таяние и температуры кипения: требуется больше энергии для разрыва водородных связей между молекулами воды. Напротив, сероводород (ЧАС
2S), имеет гораздо более слабую водородную связь из-за более низкой электроотрицательности серы. ЧАС
2S это газ на комнатная температура, несмотря на то, что сероводород имеет почти вдвое большую молярную массу воды. Дополнительная связь между молекулами воды также придает жидкой воде большой удельная теплоемкость. Эта высокая теплоемкость делает воду хорошим теплоносителем (хладагентом) и теплозащитным экраном.
Сплоченность и адгезия
Молекулы воды находятся рядом друг с другом (сплоченность), за счет коллективного действия водородных связей между молекулами воды. Эти водородные связи постоянно разрываются, и новые связи образуются с разными молекулами воды; но в любой момент времени в образце жидкой воды большая часть молекул удерживается вместе такими связями.[56]
Вода также имеет высокий адгезия свойства из-за его полярной природы. На очень чистом / гладком стекло вода может образовывать тонкую пленку, потому что молекулярные силы между стеклом и молекулами воды (силы адгезии) сильнее, чем силы сцепления. органеллы, вода контактирует с мембранами и поверхностями белков, которые гидрофильный; то есть поверхности, которые имеют сильное притяжение к воде. Ирвинг Ленгмюр наблюдали сильную силу отталкивания между гидрофильными поверхностями. Для обезвоживания гидрофильных поверхностей - для удаления прочно удерживаемых слоев гидратационной воды - требуется значительная работа против этих сил, называемых силами гидратации. Эти силы очень велики, но быстро уменьшаются на протяжении нанометра или меньше.[57] Они важны в биологии, особенно когда клетки обезвоживаются в сухой атмосфере или при замораживании внеклеточной среды.[58]

Поверхностное натяжение

Вода имеет необычно высокий поверхностное натяжение 71,99 мН / м при 25 ° C[59] что вызвано прочностью водородной связи между молекулами воды.[60] Это позволяет насекомым ходить по воде.[60]
Капиллярное действие
Поскольку вода имеет сильные силы сцепления и сцепления, она проявляет капиллярное действие.[61] Сильная когезия за счет водородных связей и адгезии позволяет деревьям переносить воду более чем на 100 м вверх.[60]
Вода как растворитель

Вода отличная растворитель из-за высокой диэлектрической проницаемости.[62] Вещества, которые хорошо смешиваются и растворяются в воде, известны как гидрофильный («водолюбивые») вещества, а те, которые плохо смешиваются с водой, известны как гидрофобный («водобоязненные») вещества.[63] Способность вещества растворяться в воде определяется тем, может ли оно соответствовать или лучше сильного силы притяжения молекулы воды образуются между другими молекулами воды. Если вещество обладает свойствами, которые не позволяют ему преодолевать эти сильные межмолекулярные силы, молекулы осажден из воды. Вопреки распространенному заблуждению, вода и гидрофобные вещества не «отталкиваются», и гидратация гидрофобной поверхности является энергетически, но не энтропийной, благоприятной.
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды (гидратация). Относительно небольшой размер молекул воды (~ 3 ангстрем) позволяет множеству молекул воды окружать одну молекулу воды. растворенное вещество. Частично отрицательные дипольные концы воды притягиваются к положительно заряженным компонентам растворенного вещества, и наоборот, к положительным концам диполя.
Как правило, ионные и полярные вещества, такие как кислоты, спирты, и соли относительно растворимы в воде, а неполярные вещества, такие как жиры и масла, нет. Неполярные молекулы остаются вместе в воде, потому что для молекул воды энергетически более выгодно образовывать водородные связи друг с другом, чем взаимодействовать друг с другом. Ван-дер-Ваальсовы взаимодействия с неполярными молекулами.
Пример ионного растворенного вещества: столовая соль; хлорид натрия, NaCl, разделяется на Na+
катионы и Cl−
анионы, каждая из которых окружена молекулами воды. Затем ионы легко уносятся прочь. кристаллическая решетка в раствор. Пример неионогенного растворенного вещества: столовый сахар. Диполи воды образуют водородные связи с полярными областями молекулы сахара (группы ОН) и позволяют уносить ее в раствор.
Квантовое туннелирование
В квантовое туннелирование о динамике воды сообщалось еще в 1992 году. В то время было известно, что существуют движения, которые разрушают и восстанавливают слабые водородная связь за счет внутреннего вращения замещающей воды мономеры.[64] 18 марта 2016 года сообщалось, что водородная связь может быть разорвана квантовым туннелированием в воде. гексамер. В отличие от ранее описанных туннельных движений в воде, это включало согласованный разрыв двух водородных связей.[65] Позже в том же году было сообщено об открытии квантового туннелирования молекул воды.[66]
Электромагнитное поглощение
Вода относительно прозрачна для видимый свет, ближний ультрафиолет свет, и дальний красный свет, но он поглощает больше всего ультрафиолетовый свет, Инфракрасный свет, и микроволны. Наиболее фоторецепторы и фотосинтетические пигменты использовать ту часть светового спектра, которая хорошо проходит через воду. Микроволновые печи Воспользуйтесь преимуществом непрозрачности воды для микроволнового излучения, чтобы нагреть воду внутри продуктов. Голубой цвет воды вызван слабым поглощение в красной части видимый спектр.[3][67]
Структура

Одна молекула воды может участвовать максимум в четырех водородные связи потому что он может принимать две связи, используя неподеленные пары кислорода, и отдавать два атома водорода. Другие молекулы, такие как фтороводород, аммиак и метанол может также образовывать водородные связи. Однако они не показывают аномальных термодинамический, кинетический или структурные свойства, подобные тем, которые наблюдаются в воде, потому что ни одна из них не может образовывать четыре водородные связи: либо они не могут отдавать или принимать атомы водорода, либо есть стерический эффекты в объемных остатках. В воде межмолекулярный четырехгранный структуры образуются из-за четырех водородных связей, тем самым формируя открытую структуру и трехмерную сетку связей, что приводит к аномальному снижению плотности при охлаждении ниже 4 ° C. Эта повторяющаяся, постоянно реорганизуемая единица определяет трехмерную сеть, проходящую по всей жидкости. Эта точка зрения основана на исследованиях рассеяния нейтронов и компьютерном моделировании и имеет смысл в свете однозначно тетраэдрического расположения молекул воды в ледяных структурах.
Однако есть альтернативная теория строения воды. В 2004 г. вышла неоднозначная статья от Стокгольмский университет предположил, что молекулы воды в жидкой форме обычно связываются не с четырьмя, а только с двумя другими; таким образом образуя цепи и кольца. Термин «струнная теория воды» (не путать с теория струн физики). Эти наблюдения были основаны на рентгеновской абсорбционной спектроскопии, которая исследовала локальное окружение отдельных атомов кислорода.[68]
Молекулярная структура
Отталкивающее воздействие двух неподеленных пар на атом кислорода приводит к тому, что вода имеет согнутый, нет линейный, молекулярная структура,[69] позволяя ему быть полярным. Угол водород-кислород-водород составляет 104,45 °, что меньше 109,47 ° для идеального зр3 гибридизация. В теория валентной связи Объяснение состоит в том, что неподеленные пары атома кислорода физически больше и поэтому занимают больше места, чем связи атома кислорода с атомами водорода.[70] В теория молекулярных орбиталей объяснение (Правило Бента) заключается в том, что снижение энергии несвязывающих гибридных орбиталей атома кислорода (путем присвоения им большего s-символа и меньшего p-символа) и, соответственно, повышения энергии гибридных орбиталей атома кислорода, связанных с атомами водорода (путем присвоения им большего p-символа и меньшего s характер) имеет общий эффект снижения энергии занятых молекулярных орбиталей, поскольку энергия несвязывающих гибридных орбиталей атома кислорода вносит полный вклад в энергию неподеленных пар атома кислорода, в то время как энергия двух других гибридных орбиталей атома кислорода вносит вклад только частично в энергию связывающих орбиталей (остальная часть вклада исходит от 1s-орбиталей атомов водорода).
Химические свойства
В жидкой воде есть самодиссоциация давая гидроксоний ионы и гидроксид ионы.
- 2 ЧАС
2О ⇌ ЧАС
3О+
+ ОЙ−
Константа равновесия этой реакции, известная как ионный продукт воды,Kш, имеет значение около 10−14 при 25 ° С. На нейтральном pH, концентрация гидроксид ион (ОЙ−
) равный иону (сольватированного) водорода (ЧАС+
) со значением, близким к 10−7 моль л−1 при 25 ° С.[71] Видеть страница данных для значений при других температурах.
Геохимия
Воздействие воды на породу в течение длительного периода времени обычно приводит к выветривание и водная эрозия, физические процессы, которые превращают твердые породы и минералы в почву и отложения, но при некоторых условиях также происходят химические реакции с водой, приводящие к метасоматоз или же минеральная гидратация, тип химического изменения породы, которое производит глинистые минералы. Это также происходит, когда портландцемент затвердевает.
Может образовываться водяной лед клатратные соединения, известный как клатрат гидраты, с множеством маленьких молекул, которые могут быть встроены в его просторную кристаллическую решетку. Наиболее заметным из них является клатрат метана, 4 CH
4· 23ч
2О, естественно, в больших количествах встречается на дне океана.
Кислотность в природе
Дождь, как правило, умеренно кислый, с pH от 5,2 до 5,8, если не имеет кислоты сильнее, чем углекислый газ.[72] Если большое количество азот и сера оксиды присутствуют в воздухе, они тоже растворяются в облаках и каплях дождя, производя кислотный дождь.
Изотопологи
Несколько изотопы водорода и кислорода существуют, что дает начало нескольким известным изотопологи воды. Венская стандартная средняя океанская вода это действующий международный стандарт для изотопов воды. Природная вода почти полностью состоит из безнейтронного изотопа водорода. протий. Только 155 промилле включают дейтерий (2
ЧАС или D), изотоп водорода с одним нейтроном и менее 20 частей на квинтиллион включают тритий (3
ЧАС или T), имеющий два нейтрона. Кислород также имеет три стабильных изотопа, с 16
О присутствует в 99,76%, 17
О в 0,04%, и 18
О в 0,2% молекул воды.[73]
Оксид дейтерия, D
2О, также известен как тяжелая вода из-за более высокой плотности. Он используется в ядерные реакторы как замедлитель нейтронов. Тритий - это радиоактивный, распадаясь с период полураспада 4500 дней; THO существует в природе только в ничтожных количествах и производится в основном в результате ядерных реакций в атмосфере, вызванных космическими лучами. Вода с одним протием и одним атомом дейтерия HDO естественно встречается в обычной воде в низких концентрациях (~ 0,03%) и D
2О в гораздо меньших количествах (0,000003%), и любые такие молекулы являются временными, поскольку атомы рекомбинируют.
Наиболее заметные физические различия между ЧАС
2О и D
2ОПомимо простой разницы в удельной массе, они включают свойства, на которые влияет водородная связь, например замерзание и кипение, а также другие кинетические эффекты. Это связано с тем, что ядро дейтерия вдвое тяжелее протия, и это вызывает заметные различия в энергиях связи. Разница в температурах кипения позволяет разделить изотопологи. В самодиффузия коэффициент ЧАС
2О при 25 ° C на 23% выше значения D
2О.[74] Поскольку молекулы воды обмениваются атомами водорода друг с другом, оксид водорода дейтерия (DOH) гораздо чаще встречается в тяжелой воде низкой чистоты, чем чистый моноксид дидейтерия. D
2О.
Потребление чистого изолированного D
2О может повлиять на биохимические процессы - прием внутрь больших количеств нарушает функцию почек и центральной нервной системы. Небольшие количества можно употреблять без каких-либо побочных эффектов; люди, как правило, не осознают различия вкусов,[75] но иногда сообщают о жжении[76] или сладкий аромат.[77] Чтобы токсичность стала очевидной, необходимо употребить очень большое количество тяжелой воды. Однако крысы могут избегать тяжелой воды по запаху, и она токсична для многих животных.[78]
Легкая вода относится к обедненной дейтерием воде (DDW), воде, в которой содержание дейтерия было снижено до уровня ниже стандартного. 155 частей на миллион уровень.
Вхождение
Вода - самое распространенное вещество на Земле, а также третья по численности молекула во Вселенной после ЧАС
2 и CO.[21] 0,23 промилле земной массы составляет вода и 97,39% мирового объема воды 1,38×109 км3 водится в океанах.[79]
Реакции
Кислотно-основные реакции
Вода амфотерный: он может действовать как кислота или основание в химических реакциях.[80] Согласно Brønsted-Lowry определение, кислота - это протон (ЧАС+
) донор, а основание - акцептор протонов.[81] При реакции с более сильной кислотой вода действует как основание; при взаимодействии с более сильным основанием действует как кислота.[81] Например, вода получает ЧАС+
ион из HCl, когда соляная кислота сформирован:
- + ⇌ ЧАС
3О+
+ Cl−
В реакции с аммиак, NH
3, вода жертвует ЧАС+
ион, и, таким образом, действует как кислота:
- + ⇌ NH+
4 + ОЙ−
Поскольку атом кислорода в воде имеет два одинокие парывода часто действует как База Льюиса, или донор электронных пар, в реакциях с Кислоты Льюиса, хотя он также может реагировать с основаниями Льюиса, образуя водородные связи между донорами электронных пар и атомами водорода воды. Теория HSAB описывает воду как слабую жесткую кислоту и как слабое твердое основание, что означает, что она реагирует преимущественно с другими твердыми частицами:
- + → ЧАС
3О+
- + → Fe (ЧАС
2О)3+
6
- + → Cl (ЧАС
2О)−
6
Когда соль слабой кислоты или слабого основания растворяется в воде, вода может частично гидролизовать соль, дающая соответствующее основание или кислоту, которая дает водные растворы мыло и пищевая сода их основной pH:
- Na
2CO
3 + ЧАС
2О ⇌ NaOH + NaHCO
3
Химия лигандов
Основной персонаж Льюиса Уотера делает его обычным лиганд в переходный металл комплексы, примеры которых включают металлические акво комплексы Такие как Fe (H
2O)2+
6 к перреновая кислота, который содержит две молекулы воды, координированные рений центр. В твердом гидратывода может быть либо лигандом, либо просто находиться в каркасе, либо и тем, и другим. Таким образом, FeSO
4· 7H
2О состоит из [Fe2(ЧАС2O)6]2+ центры и одна «решетка воды». Вода обычно монодентатный лиганд, т.е. он образует только одну связь с центральным атомом.[82]

Органическая химия
Вода как твердая основа легко вступает в реакцию с органическими карбокатионы; например в реакция гидратации, гидроксильная группа (ОЙ−
) и кислотный протон присоединяются к двум атомам углерода, связанным вместе двойной связью углерод-углерод, в результате получается спирт. Когда добавление воды к органической молекуле расщепляет молекулу на две части, гидролиз говорят, что происходит. Яркими примерами гидролиза являются омыление жиров и пищеварение белков и полисахариды. Вода также может быть уходящая группа в SN2 замены и E2 устранение реакции; последний тогда известен как реакция дегидратации.
Вода в окислительно-восстановительных реакциях
Вода содержит водород в степень окисления +1 и кислород в степени окисления -2.[83] Он окисляет химические вещества, такие как гидриды, щелочь металлы, а некоторые щелочноземельный металлы.[84][85] Одним из примеров реакции щелочного металла с водой является:[86]
- 2 Na + 2 ЧАС
2О → ЧАС
2 + 2 Na+
+ 2 ОЙ−
Некоторые другие химически активные металлы, такие как алюминий и бериллий, тоже окисляются водой, но их оксиды прилипают к металлу и образуют пассивный защитный слой.[87] Обратите внимание, что ржавчина из утюг это реакция между железом и кислородом[88] который растворяется в воде, а не между железом и водой.
Вода может окисляться выделять газообразный кислород, но очень немногие окислители вступают в реакцию с водой, даже если их восстановительный потенциал больше, чем потенциал О
2/ЧАС
2О. Почти все такие реакции требуют катализатор.[89]Пример окисления воды:
- 4 AgF
2 + 2 ЧАС
2О → 4 AgF + 4 HF + О
2
Электролиз
Воду можно разделить на составляющие элементы, водород и кислород, пропуская через нее электрический ток.[90] Этот процесс называется электролизом. Катодная полуреакция:
- 2 ЧАС+
+ 2
е−
→ ЧАС
2
Половина реакции анода:
- 2 ЧАС
2О → О
2 + 4 ЧАС+
+ 4
е−
Газы образовывали пузырьки на поверхности, где их можно было собрать или зажечь пламенем над водой, если это было намерением. Требуемый потенциал для электролиза чистой воды составляет 1,23 В при 25 ° C.[90] Рабочий потенциал при практическом электролизе составляет 1,48 В или выше.
История
Генри Кавендиш показал, что вода состоит из кислорода и водорода в 1781 году.[91] Первое разложение воды на водород и кислород путем электролиз, было сделано в 1800 году английским химиком Уильям Николсон и Энтони Карлайл.[91][92] В 1805 г. Жозеф Луи Гей-Люссак и Александр фон Гумбольдт показал, что вода состоит из двух частей водорода и одной части кислорода.[93]
Гилберт Ньютон Льюис выделил первый образец чистого тяжелая вода в 1933 г.[94]
Свойства воды исторически использовались для определения различных температурные шкалы. Примечательно, что Кельвин, Цельсия, Ренкин, и Фаренгейт шкала была или в настоящее время определяется точками замерзания и кипения воды. Менее распространенные шкалы Delisle, Ньютон, Реомюр и Рёмер были определены аналогично. В тройная точка воды - более часто используемая стандартная точка сегодня.
Номенклатура
Принятые ИЮПАК название воды оксидан или просто воды,[95] или его эквиваленты на разных языках, хотя есть и другие систематические названия, которые можно использовать для описания молекулы. Оксидан предназначен только для использования в качестве названия одноядерного родительский гидрид используется для обозначения производных воды номенклатура заместителей.[96] У этих производных обычно есть другие рекомендуемые названия. Например, название гидроксил рекомендуется более оксиданил для группы –ОН. Название оксан прямо упоминается IUPAC как непригодное для этой цели, поскольку это уже название циклического эфира, также известного как тетрагидропиран.[97][98]
Самое простое систематическое название воды - оксид водорода. Это аналогично родственным соединениям, таким как пероксид водорода, сероводород, и оксид дейтерия (тяжелая вода). Использование химической номенклатуры для ионные бинарные соединения типа I, вода получит имя окись водорода,[99] но этого нет среди имен, опубликованных Международный союз теоретической и прикладной химии (ИЮПАК).[95] Другое имя монооксид дигидрогена, которое является редко используемым названием воды и в основном используется в пародия на монооксид дигидрогена.
Другие систематические названия воды включают: гидроксильная кислота, гидроксильная кислота, и гидроксид водорода, используя кислотные и щелочные названия.[j] Ни одно из этих экзотических имен не используется широко. Поляризованная форма молекулы воды, ЧАС+
ОЙ−
, также называется гидрон гидроксид по номенклатуре IUPAC.[100]
Водное вещество - термин, используемый для обозначения оксида водорода (H2O) когда не хотят уточнять, идет ли речь о жидкости воды, паркакая-то форма лед, или компонент в смеси или минерале.
Смотрите также
Сноски
- ^ а б Венская стандартная средняя океанская вода (VSMOW), используемый для калибровки, плавится при 273,1500089 (10) K (0,000089 (10) ° C и кипит при 373,1339 K (99,9839 ° C). Другие изотопные составы плавятся или кипят при несколько других температурах.
- ^ Обычно цитируемое значение 15,7 используется в основном в органической химии для pKа воды неверно.[11][12]
- ^ а б H + представляет ЧАС
3О+
(ЧАС
2O)
п и более сложные ионы, которые образуются. - ^ Отрицательное тепловое расширение также наблюдается в расплавленный кремнезем.[32] Кроме того, довольно чистый кремний имеет отрицательный коэффициент теплового расширения для температур от 18 до 120 кельвины.[33]
- ^ Другие вещества, расширяющиеся при замерзании: кремний (температура плавления 1687 К (1414 ° C; 2577 ° F)), галлий (температура плавления 303 K (30 ° C; 86 ° F), германий (точка плавления 1211 К (938 ° C; 1720 ° F)), сурьма (температура плавления 904 K (631 ° C; 1168 ° F)), и висмут (точка плавления 545 K (272 ° C; 521 ° F))
- ^ (1-0.95865/1.00000) × 100% = 4.135%
- ^ Адиабатическое охлаждение в результате закон идеального газа.
- ^ Источник дает 0,0072 ° C / атм. Однако автор определяет атмосфера как 1000000 дин / см2 (а бар). Используя стандартное определение атмосферы, 1013 250 дин / см2, это работает до 0,0073 ° С / атм.
- ^ Используя тот факт, что 0,5 / 0,0073 = 68,5.
- ^ Для воды существуют как кислотные, так и основные названия, потому что она амфотерный (способен реагировать как с кислотой, так и с щелочью).
Рекомендации
Примечания
- ^ «наименование молекулярных соединений». www.iun.edu. Получено 1 октября 2018.
Иногда эти соединения имеют общие или общепринятые названия (например, H2O - «вода»), а также систематические названия (например, H2O, монооксид дигидрогена).
- ^ «Определение Hydrol». Мерриам-Вебстер. Получено 21 апреля 2019.
- ^ а б c Браун, Чарльз Л .; Смирнов, Сергей Н. (1993-08-01). "Почему вода голубая?" (PDF). Журнал химического образования. 70 (8): 612. Bibcode:1993JChEd..70..612B. Дои:10.1021 / ed070p612. ISSN 0021-9584.
- ^ Риддик 1970, Таблица физических свойств, Вода 0b. стр. 67-8.
- ^ Lide 2003, Свойства льда и переохлажденной воды в разделе 6.
- ^ Вода в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Проверено 27 мая 2016 г.)
- ^ а б c Анатольевич, Кипер Руслан. «Свойства вещества: вода».
- ^ Lide 2003, Давление паров воды от 0 до 370 ° C в разд. 6.
- ^ Lide 2003, Глава 8: Константы диссоциации неорганических кислот и оснований.
- ^ Weingärtner et al. 2016 г., п. 13.
- ^ "Что такое pKa воды". Калифорнийский университет в Дэвисе. 2015-08-09.
- ^ Silverstein, Todd P .; Хеллер, Стивен Т. (17 апреля 2017 г.). «Ценности pKa в учебной программе бакалавриата: что такое настоящая pKa воды?». Журнал химического образования. 94 (6): 690–695. Bibcode:2017JChEd..94..690S. Дои:10.1021 / acs.jchemed.6b00623.
- ^ Рамирес, Мария Л. В .; Кастро, Карлос А. Ньето де; Нагасака, Ючи; Нагашима, Акира; Assael, Marc J .; Уэйкхэм, Уильям А. (1995-05-01). «Стандартные справочные данные по теплопроводности воды». Журнал физических и химических справочных данных. 24 (3): 1377–1381. Bibcode:1995JPCRD..24.1377R. Дои:10.1063/1.555963. ISSN 0047-2689.
- ^ Lide 2003, 8 - Концентрационные свойства водных растворов: плотность, показатель преломления, понижение точки замерзания и вязкость.
- ^ Lide 2003, 6.186.
- ^ Lide 2003, 9 - Дипольные моменты.
- ^ а б c Вода в Linstrom, Peter J .; Маллард, Уильям Г. (ред.); Веб-книга NIST Chemistry, стандартная справочная база данных NIST номер 69, Национальный институт стандартов и технологий, Гейтерсбург (Мэриленд), http://webbook.nist.gov (Проверено 01.06.2014)
- ^ Гринвуд и Эрншоу 1997, п. 620.
- ^ «Вода - универсальный растворитель». USGS.
- ^ Рис и др. 2013, п. 48.
- ^ а б c Weingärtner et al. 2016 г., п. 2.
- ^ Рис и др. 2013, п. 44.
- ^ «Константа автопротолиза». Сборник химической терминологии ИЮПАК. ИЮПАК. 2009 г. Дои:10.1351 / goldbook.A00532. ISBN 978-0-9678550-9-7.
- ^ Кэмпбелл, Уильямсон и Хейден, 2006 г..
- ^ Смит, Джаред Д .; Кристофер Д. Каппа; Кевин Р. Уилсон; Рональд С. Коэн; Филипп Л. Гейслер; Ричард Дж. Сайкалли (2005). «Единое описание температурных перестроек водородных связей в жидкой воде» (PDF). Proc. Natl. Акад. Sci. Соединенные Штаты Америки. 102 (40): 14171–14174. Bibcode:2005ПНАС..10214171С. Дои:10.1073 / pnas.0506899102. ЧВК 1242322. PMID 16179387.
- ^ Дегучи, Сигэру; Цуджи, Каору (19 июня 2007 г.). «Сверхкритическая вода: восхитительная среда для мягкого вещества». Мягкая материя. 3 (7): 797. Bibcode:2007SMat .... 3..797D. Дои:10.1039 / b611584e. ISSN 1744-6848.
- ^ Райн, М.; Ринтул, С. (2013). «3: Наблюдения: Океан» (PDF). IPCC WGI AR5 (Отчет). п. 257.
Потепление океана доминирует в глобальном перечне изменений энергии. На потепление океана приходится около 93% увеличения запасов энергии Земли в период с 1971 по 2010 год (высокая степень достоверности), при этом потепление в верхних слоях океана (от 0 до 700 м) составляет около 64% от общего объема. Остальные изменения в энергии объясняются таянием льдов (включая арктический морской лед, ледовые щиты и ледники) и потеплением континентов и атмосферы.
- ^ Lide 2003, Глава 6: Свойства льда и переохлажденной воды.
- ^ Lide 2003, 6. Свойства воды и пара в зависимости от температуры и давления.
- ^ «Указ о мерах и весах». 7 апреля 1795 г.
Грамм, le poids Absolu d'un volume d'eau pure égal au cube de la centième partie du mètre, et à la température de la glace fondante.
- ^ а б c d Гринвуд и Эрншоу 1997, п. 625.
- ^ Shell, Scott M .; Debenedetti, Pablo G .; Панагиотопулос, Афанассиос З. (2002). «Молекулярный структурный порядок и аномалии в жидком кремнеземе» (PDF). Phys. Ред. E. 66 (1): 011202. arXiv:cond-mat / 0203383. Bibcode:2002PhRvE..66a1202S. Дои:10.1103 / PhysRevE.66.011202. PMID 12241346. S2CID 6109212. Архивировано из оригинал (PDF) на 2016-06-04. Получено 2009-07-07.
- ^ Буллис, В. Мюррей (1990). "Глава 6". В O'Mara, William C .; Селедка, Роберт Б .; Хант, Ли П. (ред.). Справочник по технологии полупроводникового кремния. Парк-Ридж, Нью-Джерси: Нойес Публикации. п. 431. ISBN 0-8155-1237-6. Получено 2010-07-11.
- ^ а б c d е Перлман, Ховард. «Плотность воды». Школа водных наук USGS. Получено 2016-06-03.
- ^ Лортинг, Томас; Зальцманн, Кристоф; Коль, Ингрид; Майер, Эрвин; Халльбрукер, Андреас (01.01.2001). «Второе отчетливое структурное« состояние »аморфного льда высокой плотности при 77 К и давлении 1 бар». Физическая химия Химическая физика. 3 (24): 5355–5357. Bibcode:2001PCCP .... 3.5355L. Дои:10.1039 / b108676f. ISSN 1463-9084.
- ^ Гринвуд и Эрншоу 1997, п. 624.
- ^ Зумдаль и Зумдаль 2013, п. 493.
- ^ а б c "Может ли океан замерзнуть?". Национальная океанская служба. Национальное управление океанических и атмосферных исследований. Получено 2016-06-09.
- ^ Хорошо, R.A .; Миллеро, Ф.Дж. (1973). «Сжимаемость воды как функция температуры и давления». Журнал химической физики. 59 (10): 5529. Bibcode:1973ЖЧФ..59.5529Ф. Дои:10.1063/1.1679903.
- ^ «Определения базовой единицы: Кельвин». Национальный институт стандартов и технологий. Получено 9 августа 2018.
- ^ а б Weingärtner et al. 2016 г., п. 5.
- ^ Отчет о 106-м заседании. (PDF). Международный комитет мер и весов. Севр. 16–20 октября 2017 г.
- ^ Шлютер, Оливер (28 июля 2003 г.). «Воздействие процессов высокого давления - низких температур на ячеистые материалы, относящиеся к продуктам питания» (PDF). Technischen Universität Berlin. Архивировано из оригинал (PDF) на 2008-03-09. Цитировать журнал требует
| журнал =(помощь) - ^ Тамманн, Густав HJA (1925). «Состояния агрегирования». Констебль и компания. Цитировать журнал требует
| журнал =(помощь) - ^ Льюис и Райс 1922.
- ^ Мерфи, Д. М. (2005). «Обзор давления пара льда и переохлажденной воды для атмосферных условий». Ежеквартальный журнал Королевского метеорологического общества. 131 (608): 1539–1565. Bibcode:2005QJRMS.131.1539M. Дои:10.1256 / qj.04.94.
- ^ Debenedetti, P.G .; Стэнли, Х. Э. (2003). «Переохлажденная и стеклянная вода» (PDF). Физика сегодня. 56 (6): 40–46. Bibcode:2003ФТ .... 56ф..40Д. Дои:10.1063/1.1595053.
- ^ Sharp 1988, п. 27.
- ^ «Пересмотренное значение давления вдоль кривых плавления и сублимации обычных водных веществ» (PDF). IAPWS. Сентябрь 2011 г.. Получено 2013-02-19.
- ^ а б Свет, Трумэн С .; Лихт, Стюарт; Bevilacqua, Anthony C .; Мораш, Кеннет Р. (01.01.2005). «Основные проводимость и удельное сопротивление воды». Электрохимические и твердотельные буквы. 8 (1): E16 – E19. Дои:10.1149/1.1836121. ISSN 1099-0062.
- ^ Крофтс, А. (1996). «Лекция 12: Протонная проводимость, стехиометрия». Иллинойсский университет в Урбана-Шампейн. Получено 2009-12-06.
- ^ Хой, АР; Бункер, PR (1979). «Точное решение изгибающего вращения уравнения Шредингера для трехатомной молекулы в применении к молекуле воды». Журнал молекулярной спектроскопии. 74 (1): 1–8. Bibcode:1979JMoSp..74 .... 1H. Дои:10.1016/0022-2852(79)90019-5.
- ^ Зумдаль и Зумдаль 2013, п. 393.
- ^ Кэмпбелл и Фаррелл 2007С. 37–38.
- ^ Кэмпбелл и Рис 2009, п. 47.
- ^ Кьяваццо, Элиодоро; Фазано, Маттео; Асинари, Пьетро; Декуцци, Паоло (2014). «Масштабирование для переноса воды в наноразмерных геометриях». Nature Communications. 5: 4565. Bibcode:2014 НатКо ... 5.4565C. Дои:10.1038 / ncomms4565. ЧВК 3988813. PMID 24699509.
- ^ «Физические силы, организующие биомолекулы» (PDF). Биофизическое общество. Архивировано 7 августа 2007 года.CS1 maint: неподходящий URL (связь)
- ^ Lide 2003, Поверхностное натяжение обычных жидкостей.
- ^ а б c Рис и др. 2013, п. 46.
- ^ Зумдаль и Зумдаль 2013С. 458–459.
- ^ Гринвуд и Эрншоу 1997, п. 627.
- ^ Зумдаль и Зумдаль 2013, п. 518.
- ^ Пульяно, Н. (1992-11-01). «Вибро-вращательно-туннельная динамика в малых водных кластерах». Лаборатория Лоуренса Беркли, Калифорния (США): 6. Дои:10.2172/6642535. OSTI 6642535. Цитировать журнал требует
| журнал =(помощь) - ^ Ричардсон, Джереми О .; Перес, Кристобаль; Лобсигер, Саймон; Reid, Adam A .; Темелсо, Берхане; Шилдс, Джордж С .; Кисель, Збигнев; Уэльс, Дэвид Дж .; Pate, Brooks H .; Олторп, Стюарт К. (18 марта 2016 г.). «Согласованный разрыв водородной связи путем квантового туннелирования в призме гексамера воды». Наука. 351 (6279): 1310–1313. Bibcode:2016Научный ... 351.1310R. Дои:10.1126 / science.aae0012. ISSN 0036-8075. PMID 26989250.
- ^ Колесников, Александр Иванович (2016-04-22). «Квантовое туннелирование воды в берилле: новое состояние молекулы воды». Письма с физическими проверками. 116 (16): 167802. Bibcode:2016ПхРвЛ.116п7802К. Дои:10.1103 / PhysRevLett.116.167802. PMID 27152824.
- ^ Папа; Фрай (1996). «Спектр поглощения (380-700 нм) чистой воды. II. Измерения интегрированной полости». Прикладная оптика. 36 (33): 8710–23. Bibcode:1997ApOpt..36.8710P. Дои:10.1364 / АО.36.008710. PMID 18264420.
- ^ Болл, Филипп (2008). «Вода - непреходящая загадка». Природа. 452 (7185): 291–292. Bibcode:2008Натура.452..291Б. Дои:10.1038 / 452291a. PMID 18354466. S2CID 4365814.
- ^ Гоник, Ларри; Криддл, Крэйг (2005-05-03). «Глава 3 Единение». Мультяшный гид по химии (1-е изд.). HarperResource. п.59. ISBN 9780060936778.
Вода, H2О, похоже. У него две пары электронов, к которым ничего не прикреплено. Их тоже нужно учитывать. Молекулы типа NH3 и H2O называются согнутый.
- ^ Теодор Л. Браун; и другие. (2015). «9.2 Модель Всепр». Химия: центральная наука (13-е изд.). п. 351. ISBN 978-0-321-91041-7. Получено 21 апреля 2019.
Обратите внимание, что валентные углы уменьшаются с увеличением количества несвязывающих электронных пар. Связующая пара электронов притягивается обоими ядрами связанных атомов, а несвязывающая пара притягивается в основном только одним ядром. Поскольку несвязывающая пара испытывает меньшее ядерное притяжение, ее электронный домен разбросан в пространстве больше, чем электронный домен связывающей пары (рис. 9.7). Поэтому несвязывающие электронные пары занимают больше места, чем связывающие пары; по сути, они действуют как большие и более толстые воздушные шары в нашей аналогии с рис. 9.5. Как результат, электронные домены для несвязывающих электронных пар оказывают большие силы отталкивания на соседние электронные домены и имеют тенденцию сжимать валентные углы
- ^ Бойд 2000, п. 105.
- ^ Бойд 2000, п. 106.
- ^ «Руководство по использованию фундаментальных физических констант и основных констант воды» (PDF). IAPWS. 2001.
- ^ Харди, Эдме Х .; Зыгарь, Астрид; Zeidler, Manfred D .; Хольц, Манфред; Захер, Фрэнк Д. (2001). «Изотопный эффект на поступательное и вращательное движение в жидкой воде и аммиаке». J. Chem. Phys. 114 (7): 3174–3181. Bibcode:2001ЖЧФ.114.3174Н. Дои:10.1063/1.1340584.
- ^ Юри, Гарольд С .; и другие. (15 марта 1935 г.). «О вкусе тяжелой воды». Наука. 81 (2098). Нью-Йорк: The Science Press. п. 273. Bibcode:1935Sci .... 81..273U. Дои:10.1126 / science.81.2098.273-а.
- ^ «Экспериментатор пьет« тяжелую воду »по цене 5000 долларов за кварту». Ежемесячный научно-популярный журнал. 126 (4). Нью-Йорк: издательство Popular Science. Апрель 1935 г. с. 17. Получено 7 янв 2011.
- ^ Мюллер, Гровер К. (июнь 1937 г.). «Является ли« Тяжелая вода »источником молодости?». Ежемесячный научно-популярный журнал. 130 (6). Нью-Йорк: издательство Popular Science. стр. 22–23. Получено 7 янв 2011.
- ^ Миллер, Инглис Дж., Мл .; Мозер, Грегори (июль 1979 г.). «Вкусовые реакции на оксид дейтерия». Физиология и поведение. 23 (1): 69–74. Дои:10.1016/0031-9384(79)90124-0. PMID 515218. S2CID 39474797.
- ^ Weingärtner et al. 2016 г., п. 29.
- ^ Зумдаль и Зумдаль 2013, п. 659.
- ^ а б Зумдаль и Зумдаль 2013, п. 654.
- ^ Зумдаль и Зумдаль 2013, п. 984.
- ^ Зумдаль и Зумдаль 2013, п. 171.
- ^ «Гидриды». Chemwiki. Калифорнийский университет в Дэвисе. Получено 2016-06-25.
- ^ Зумдаль и Зумдаль 2013, стр.932, 936.
- ^ Зумдаль и Зумдаль 2013, п. 338.
- ^ Зумдаль и Зумдаль 2013, п. 862.
- ^ Зумдаль и Зумдаль 2013, п. 981.
- ^ Шарлот 2007, п. 275.
- ^ а б Зумдаль и Зумдаль 2013, п. 866.
- ^ а б Гринвуд и Эрншоу 1997, п. 601.
- ^ «Предприятие и электролиз ...» Королевское химическое общество. Август 2003 г.. Получено 2016-06-24.
- ^ «Жозеф Луи Гей-Люссак, французский химик (1778–1850)». Энциклопедия 1902 года. Сноска 122-1. Получено 2016-05-26.
- ^ Льюис, Г. Н .; Макдональд, Р. Т. (1933). «Концентрация изотопа Н2». Журнал химической физики. 1 (6): 341. Bibcode:1933ЖЧФ ... 1..341Л. Дои:10.1063/1.1749300.
- ^ а б Ли, Фавр и Метаномски 1998, п. 34.
- ^ ИЮПАК 2005, п. 85.
- ^ Ли, Фавр и Метаномски 1998, п. 99.
- ^ «Тетрагидропиран». Pubchem. Национальные институты здоровья. Получено 2016-07-31.
- ^ Ли, Фавр и Метаномски 1998С. 27–28.
- ^ "Резюме соединения для CID 22247451". База данных Pubchem Compound. Национальный центр биотехнологической информации.
Библиография
- Бойд, Клод Э. (2000). «pH, двуокись углерода и щелочность». Качество воды. Бостон, Массачусетс: Спрингер. С. 105–122. Дои:10.1007/978-1-4615-4485-2_7. ISBN 9781461544852.
- Кэмпбелл, Мэри К .; Фаррелл, Шон О. (2007). Биохимия (6-е изд.). Cengage Learning. ISBN 978-0-495-39041-1.
- Кэмпбелл, Нил А .; Рис, Джейн Б. (2009). Биология (8-е изд.). Пирсон. ISBN 978-0-8053-6844-4.
- Кэмпбелл, Нил А .; Уильямсон, Брэд; Хейден, Робин Дж. (2006). Биология: изучение жизни. Бостон, Массачусетс: Пирсон Прентис Холл. ISBN 978-0-13-250882-7.
- Шарло, Г. (2007). Качественный неорганический анализ. Читать книги. ISBN 978-1-4067-4789-8.
- Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- Международный союз теоретической и прикладной химии (2005-11-22). Номенклатура неорганической химии: Рекомендации ИЮПАК 2005 г. (PDF). Королевское химическое общество. ISBN 978-0-85404-438-2. Получено 2016-07-31.
- Leigh, G.J .; Favre, H.A; Метаномски, В. В. (1998). Принципы химической номенклатуры: руководство по рекомендациям IUPAC (PDF). Оксфорд: Blackwell Science. ISBN 978-0-86542-685-6. OCLC 37341352. Архивировано из оригинал (PDF) на 2011-07-26.
- Льюис, Уильям К.М.; Райс, Джеймс (1922). Система физической химии. Longmans, Green and Co.
- Лиде, Дэвид Р. (19.06.2003). Справочник CRC по химии и физике, 84-е издание. Справочник CRC. CRC Press. ISBN 9780849304842.
- Рис, Джейн Б.; Урри, Лиза А .; Каин, Майкл Л .; Вассерман, Стивен А .; Минорский, Петр V .; Джексон, Роберт Б. (2013-11-10). Кэмпбелл Биология (10-е изд.). Бостон, штат Массачусетс: Пирсон. ISBN 9780321775658.
- Риддик, Джон (1970). Физические свойства органических растворителей и методы очистки. Методы химии. Wiley-Interscience. ISBN 978-0471927266.
- Шарп, Роберт Филлип (1988-11-25). Живой лед: ледники и оледенение. Издательство Кембриджского университета. п.27. ISBN 978-0-521-33009-1.
- Вайнгертнер, Германн; Тирманн, Илка; Борхерс, Ульрих; Бальсаа, Питер; Lutze, Holger V .; Schmidt, Torsten C .; Франк, Эрнст Ульрих; Виганд, Габриэле; Дахмен, Николай; Шведт, Георг; Frimmel, Fritz H .; Гордалла, Биргит К. (2016). «Вода, 1. Свойства, анализ и гидрологический цикл». Энциклопедия промышленной химии Ульмана. Wiley-VCH Verlag GmbH & Co. KGaA. Дои:10.1002 / 14356007.a28_001.pub3. ISBN 9783527306732.
- Zumdahl, Steven S .; Зумдал, Сьюзан А. (2013). Химия (9-е изд.). Cengage Learning. ISBN 978-1-13-361109-7.
дальнейшее чтение
- Бен-Наим, А. (2011), Молекулярная теория воды и водных растворов, Всемирный научный
внешняя ссылка
| Викискладе есть медиафайлы по теме Молекула воды. |
| Викискладе есть медиафайлы по теме Вода. |
| В Викиверситете есть учебные ресурсы о Инженерная термодинамика / Паровые столы |
- «Свойства воды и измерения». Геологическая служба США. 2 мая, 2016. Получено 31 августа, 2016.
- Выпуск по формуле IAPWS 1995 для термодинамических свойств обычных водных веществ для общего и научного использования (более простая формулировка)
- Онлайн-калькулятор с использованием дополнительного выпуска IAPWS о свойствах жидкой воды при 0,1 МПа, сентябрь 2008 г.
- Чаплин, Мартин. «Структура воды и наука». Лондонский университет Южного берега. Получено 2020-11-23.
- Расчет давление газа, плотность жидкости, динамическая вязкость жидкости, и поверхностное натяжение воды
- Калькулятор плотности воды
- Почему в моем напитке плавает лед?, НАСА